人教版选择性必修一2.2.2 化学平衡常数课件15张
文档属性
| 名称 | 人教版选择性必修一2.2.2 化学平衡常数课件15张 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 14:54:13 | ||
图片预览





文档简介
(共15张PPT)
化学平衡常数
——人教化学选修一《化学反应原理》第二章第二节
人们
物质
化工合成
化学反应
反应程度(K)
反应快慢(v)
一、回顾化学平衡常数
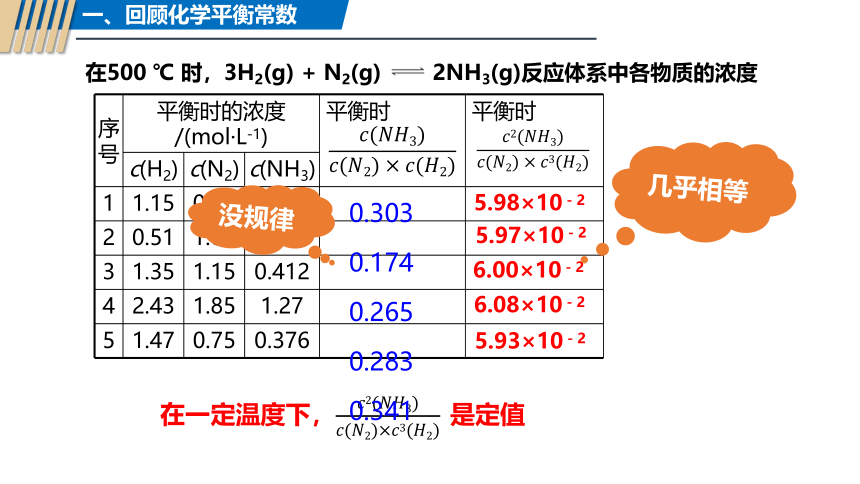
在500 ℃ 时,3H2(g) + N2(g) 2NH3(g)反应体系中各物质的浓度
序号 平衡时的浓度/(mol·L-1) 平衡时 平衡时
c(H2) c(N2) c(NH3) 1 1.15 0.75 0.261
2 0.51 1.00 0.089
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
6.00×10-2
5.98×10-2
5.97×10-2
5.93×10-2
6.08×10-2
在一定温度下,是定值
没规律
几乎相等
一、回顾化学平衡常数
对于一般的可逆反应: m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时,各物质的平衡浓度满足的数学关系式为:
K =
cp(C) cq(D)
cm(A) cn(B)
科学家们通过大量实验数据,证明了上述结论适用于所有可逆反应,都存在一个化学平衡常数,用K来表示
一、回顾化学平衡常数
Q1:请用化学平衡的理论分析,在一定温度下
3H2(g) + N2(g) 2NH3(g)到达平衡时必然存在平衡常数K
化学史: 1864年,挪威数学家古德贝格和化学家瓦格做了300多个实验,发现速率与浓度之间存在关系:υ正=k1.c3(H2).c(N2) υ逆=k2.c2(NH3)(其中k1 ,k2在温度确定时是常数)
实验 理论
Q2 小组讨论:写出下列方程式中平衡常数的表达式
(1)CO (g)+H2O (g) CO2 (g) +H2 (g)
(2)C (s) + H2O (g) CO (g) + H2 (g)
(3)FeCl3 (aq) +3KSCN (aq) Fe(SCN)3 (aq) +3KCl (aq)
(4)Cl2(aq) + H2O (l) H+ (aq)+Cl- (aq) + HClO (aq)
(5)CH3COOH (l) +CH3CH2OH (l) CH3COOC2H5 (l) +H2O (l)
若某微粒的浓度是常数或不参与反应的离子或可看作常数,均不写入平衡常数K的表达式中
二、平衡常数K的书写及化学意义
二、平衡常数K的书写及化学意义
还原法:
氧化法:
常温 K=3.8×10-31
N2(g) + O2(g) 2NO(g)
常温 K=5.0×108
N2(g) + 3H2(g) 2NH3(g)
Q3:氮的固定有以下两种方法,从反应程度角度考虑,你会选择哪种作为工业固氮的方法?为什么?
根据平衡常数的表达式,K可以表征反应进行的程度
K 越大,反应正向进行的程度越大
一般认为:K > 105,正反应进行得基本完全
Q4:常温下该反应已经基本完全反应,为什么工业上还要加热加压?
平衡常数K 越大,不代表速率越大
反应加催化剂后,可简化为以下两步基元反应:
平衡常数K与反应历程无关
A(g)+M(s)=AM(g)
AM(g)+B(g)=AB(g)+M(s)
总反应:A(g)+B(g)=AB(g)
K1=
K2=
K3=
K1=
= K3
反应①+反应②=反应③,K1 ,K2和 K3之间有什么联系呢?
二、平衡常数K的书写及化学意义
针对复杂反应2NO +O2 2NO2
2NO(g) N2O2 (g)
N2O2 (g) +O2 (g) 2NO2 (g)
Q5:催化剂能改变反应历程,对化学平衡常数K有影响吗?
将1 mol CO与1 mol H2O气体混合充入1L密闭容器中,发生反应 CO(g) + H2O(g) CO2(g) + H2(g),加热到800 ℃ ,充分反应达到平衡,化学平衡常数K=1 。
(1)求该反应平衡时CO的转化率。
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 1 1 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 1-x 1-x x x
三、平衡常数K的应用
K=
解得: x=0.5mol/L
α(CO)=50%
(2)在上述温度下, CO的量不变,将气态H2O的投料改为3 mol,反应一段时间后测得体系中CO的浓度为0.5 mol·L-1 ,此时反应是否达到平衡状态?若否,请判断反应进行的方向
三、平衡常数K的应用
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 1 3 0 0
变化浓度/(mol·L-1 ) 0.5 0.5 0.5 0.5
平衡浓度/(mol·L-1 ) 0.5 2.5 0.5 0.5
Q=
(3)在(2)条件下,反应达到平衡时,CO和H2O的平衡转化率会发生什么变化?
增大H2O(g)浓度, CO (g)转化率增大,H2O(g)转化率减小
反应正向进行
Q6:实际生产中,原料中N2和H2物质的量之比为1:2.8。
请分析说明原料气中N2稍过量的理由
信息提示1:原料投料比对平衡混合气中氨含量的影响
信息提示2: 有资料显示纯度99.999%的氮气和氢气价格分别为290元/瓶、400元/瓶(40L/瓶)
三、平衡常数K的应用
信息提示3:氮气在催化剂表面吸附分解的速率慢,是控制总反应速率的关键步骤
小结
实验 理论 实践
化学平衡常数
1.存在的实践经验和理论推理
2. 表达式书写和化学意义
3.应用及社会价值
拓展提升
(2022全国卷选)在1470K 、100kPa反应条件下,将n(H2S) :n(Ar)=1:4的混合气发生热分解反应
2H2S (g) S2 (g)+2H2 (g) 。平衡时混合气中H2S 与 H2的分压相等, H2S平衡转化率为________,平衡常数 Kp=________ kPa。 (Kp为压强平衡常数,用各气体的分压来代替浓度,pH2S=xH2Sp,p为平衡总压,xH2S为平衡体系中H2S 的物质的量分数 )
思考题
下列可逆反应的平衡常数表达式K1 和K2、K3有什么关系?
1.
2.
3.
N2(g) + 3H2(g) 2NH3(g)
1.
2.
3.
2NH3(g) N2(g) + 3H2(g)
N2(g)+ H2(g) NH3(g)
1
2
3
2
c2(NH3)
K1
=
c(N2) c3(H2)
K2
=
c2(NH3)
c(N2) c3(H2)
K3
=
c1/2(N2) c3/2(H2)
c(NH3)
K1 =
K2
1
= K32
平衡常数表达式与化学方程式的书写一一对应。
谢谢大家!
欢迎批评指正!
化学平衡常数
——人教化学选修一《化学反应原理》第二章第二节
人们
物质
化工合成
化学反应
反应程度(K)
反应快慢(v)
一、回顾化学平衡常数
在500 ℃ 时,3H2(g) + N2(g) 2NH3(g)反应体系中各物质的浓度
序号 平衡时的浓度/(mol·L-1) 平衡时 平衡时
c(H2) c(N2) c(NH3) 1 1.15 0.75 0.261
2 0.51 1.00 0.089
3 1.35 1.15 0.412
4 2.43 1.85 1.27
5 1.47 0.75 0.376
6.00×10-2
5.98×10-2
5.97×10-2
5.93×10-2
6.08×10-2
在一定温度下,是定值
没规律
几乎相等
一、回顾化学平衡常数
对于一般的可逆反应: m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时,各物质的平衡浓度满足的数学关系式为:
K =
cp(C) cq(D)
cm(A) cn(B)
科学家们通过大量实验数据,证明了上述结论适用于所有可逆反应,都存在一个化学平衡常数,用K来表示
一、回顾化学平衡常数
Q1:请用化学平衡的理论分析,在一定温度下
3H2(g) + N2(g) 2NH3(g)到达平衡时必然存在平衡常数K
化学史: 1864年,挪威数学家古德贝格和化学家瓦格做了300多个实验,发现速率与浓度之间存在关系:υ正=k1.c3(H2).c(N2) υ逆=k2.c2(NH3)(其中k1 ,k2在温度确定时是常数)
实验 理论
Q2 小组讨论:写出下列方程式中平衡常数的表达式
(1)CO (g)+H2O (g) CO2 (g) +H2 (g)
(2)C (s) + H2O (g) CO (g) + H2 (g)
(3)FeCl3 (aq) +3KSCN (aq) Fe(SCN)3 (aq) +3KCl (aq)
(4)Cl2(aq) + H2O (l) H+ (aq)+Cl- (aq) + HClO (aq)
(5)CH3COOH (l) +CH3CH2OH (l) CH3COOC2H5 (l) +H2O (l)
若某微粒的浓度是常数或不参与反应的离子或可看作常数,均不写入平衡常数K的表达式中
二、平衡常数K的书写及化学意义
二、平衡常数K的书写及化学意义
还原法:
氧化法:
常温 K=3.8×10-31
N2(g) + O2(g) 2NO(g)
常温 K=5.0×108
N2(g) + 3H2(g) 2NH3(g)
Q3:氮的固定有以下两种方法,从反应程度角度考虑,你会选择哪种作为工业固氮的方法?为什么?
根据平衡常数的表达式,K可以表征反应进行的程度
K 越大,反应正向进行的程度越大
一般认为:K > 105,正反应进行得基本完全
Q4:常温下该反应已经基本完全反应,为什么工业上还要加热加压?
平衡常数K 越大,不代表速率越大
反应加催化剂后,可简化为以下两步基元反应:
平衡常数K与反应历程无关
A(g)+M(s)=AM(g)
AM(g)+B(g)=AB(g)+M(s)
总反应:A(g)+B(g)=AB(g)
K1=
K2=
K3=
K1=
= K3
反应①+反应②=反应③,K1 ,K2和 K3之间有什么联系呢?
二、平衡常数K的书写及化学意义
针对复杂反应2NO +O2 2NO2
2NO(g) N2O2 (g)
N2O2 (g) +O2 (g) 2NO2 (g)
Q5:催化剂能改变反应历程,对化学平衡常数K有影响吗?
将1 mol CO与1 mol H2O气体混合充入1L密闭容器中,发生反应 CO(g) + H2O(g) CO2(g) + H2(g),加热到800 ℃ ,充分反应达到平衡,化学平衡常数K=1 。
(1)求该反应平衡时CO的转化率。
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 1 1 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 1-x 1-x x x
三、平衡常数K的应用
K=
解得: x=0.5mol/L
α(CO)=50%
(2)在上述温度下, CO的量不变,将气态H2O的投料改为3 mol,反应一段时间后测得体系中CO的浓度为0.5 mol·L-1 ,此时反应是否达到平衡状态?若否,请判断反应进行的方向
三、平衡常数K的应用
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 1 3 0 0
变化浓度/(mol·L-1 ) 0.5 0.5 0.5 0.5
平衡浓度/(mol·L-1 ) 0.5 2.5 0.5 0.5
Q=
(3)在(2)条件下,反应达到平衡时,CO和H2O的平衡转化率会发生什么变化?
增大H2O(g)浓度, CO (g)转化率增大,H2O(g)转化率减小
反应正向进行
Q6:实际生产中,原料中N2和H2物质的量之比为1:2.8。
请分析说明原料气中N2稍过量的理由
信息提示1:原料投料比对平衡混合气中氨含量的影响
信息提示2: 有资料显示纯度99.999%的氮气和氢气价格分别为290元/瓶、400元/瓶(40L/瓶)
三、平衡常数K的应用
信息提示3:氮气在催化剂表面吸附分解的速率慢,是控制总反应速率的关键步骤
小结
实验 理论 实践
化学平衡常数
1.存在的实践经验和理论推理
2. 表达式书写和化学意义
3.应用及社会价值
拓展提升
(2022全国卷选)在1470K 、100kPa反应条件下,将n(H2S) :n(Ar)=1:4的混合气发生热分解反应
2H2S (g) S2 (g)+2H2 (g) 。平衡时混合气中H2S 与 H2的分压相等, H2S平衡转化率为________,平衡常数 Kp=________ kPa。 (Kp为压强平衡常数,用各气体的分压来代替浓度,pH2S=xH2Sp,p为平衡总压,xH2S为平衡体系中H2S 的物质的量分数 )
思考题
下列可逆反应的平衡常数表达式K1 和K2、K3有什么关系?
1.
2.
3.
N2(g) + 3H2(g) 2NH3(g)
1.
2.
3.
2NH3(g) N2(g) + 3H2(g)
N2(g)+ H2(g) NH3(g)
1
2
3
2
c2(NH3)
K1
=
c(N2) c3(H2)
K2
=
c2(NH3)
c(N2) c3(H2)
K3
=
c1/2(N2) c3/2(H2)
c(NH3)
K1 =
K2
1
= K32
平衡常数表达式与化学方程式的书写一一对应。
谢谢大家!
欢迎批评指正!
