人教版选择性必修一2.2.2 化学平衡常数 课件20张
文档属性
| 名称 | 人教版选择性必修一2.2.2 化学平衡常数 课件20张 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-27 14:53:29 | ||
图片预览






文档简介
(共20张PPT)
第2课时 化学平衡常数
第二章 第二节 化学平衡
学习情境
钢铁生产是第一次产业革命的两大产业之一。
19世纪后期,炼铁高炉所排出的高炉气中含有相当多量的CO,开始炼铁工程师们认为是CO与铁矿石接触不充分,于是设法增加高炉的高度。
令人吃惊的是,高炉增高后,高炉尾气中CO的含量竟然没有改变。
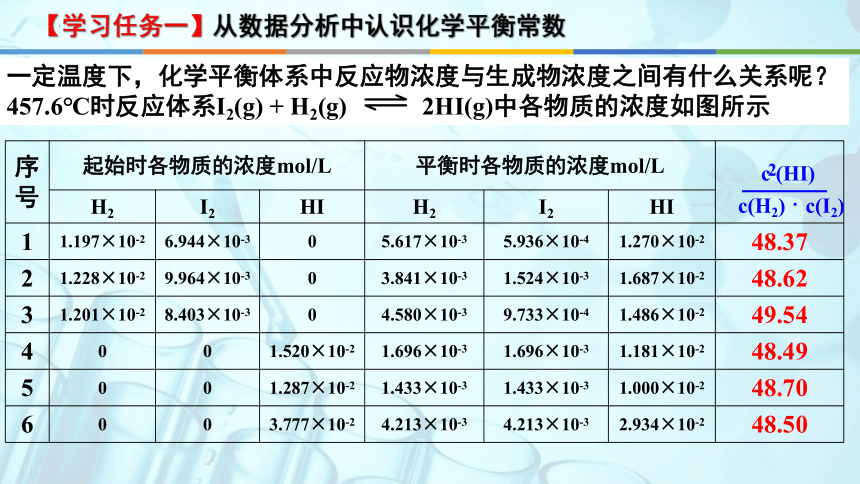
一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?457.6℃时反应体系I2(g) + H2(g) 2HI(g)中各物质的浓度如图所示
【学习任务一】从数据分析中认识化学平衡常数
序号 起始时各物质的浓度mol/L 平衡时各物质的浓度mol/L
H2 I2 HI H2 I2 HI 1 1.197×10-2 6.944×10-3 0 5.617×10-3 5.936×10-4 1.270×10-2 48.37
2 1.228×10-2 9.964×10-3 0 3.841×10-3 1.524×10-3 1.687×10-2 48.62
3 1.201×10-2 8.403×10-3 0 4.580×10-3 9.733×10-4 1.486×10-2 49.54
4 0 0 1.520×10-2 1.696×10-3 1.696×10-3 1.181×10-2 48.49
5 0 0 1.287×10-2 1.433×10-3 1.433×10-3 1.000×10-2 48.70
6 0 0 3.777×10-2 4.213×10-3 4.213×10-3 2.934×10-2 48.50
2
c (HI)
c(H2) · c(I2)
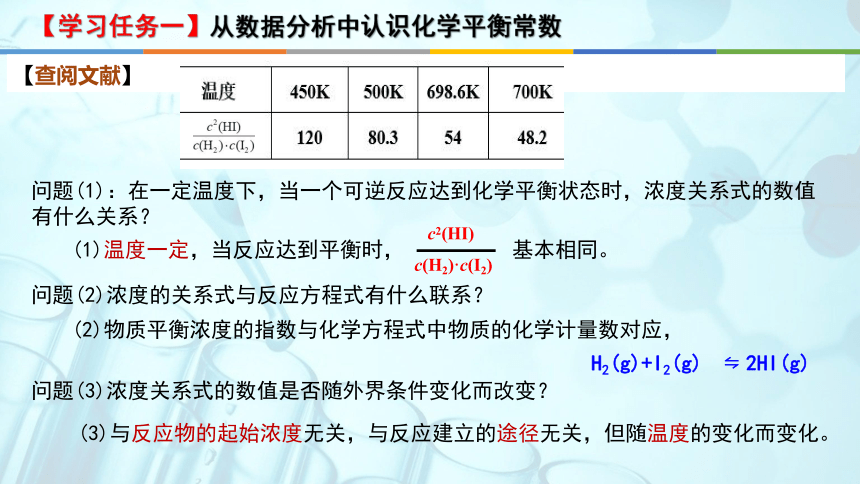
【查阅文献】
问题(1):在一定温度下,当一个可逆反应达到化学平衡状态时,浓度关系式的数值有什么关系?
问题(2)浓度的关系式与反应方程式有什么联系?
【学习任务一】从数据分析中认识化学平衡常数
问题(3)浓度关系式的数值是否随外界条件变化而改变?
(1)温度一定,当反应达到平衡时, 基本相同。
c2(HI)
c(H2)·c(I2)
(2)物质平衡浓度的指数与化学方程式中物质的化学计量数对应,
H2(g)+I2(g) 2HI(g)
(3)与反应物的起始浓度无关,与反应建立的途径无关,但随温度的变化而变化。
【概念建构】
【学习任务一】从数据分析中认识化学平衡常数
化学平衡常数
1、概念
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数叫做该反应的化学平衡常数
2、表达式
例如:mA + nB pC + qD
K
=
生成物浓度幂之积
反应物浓度幂之积
=
cp(C)·cq(D)
cm(A)·cn(B)
其中c为各组分的平衡时浓度
3、书写规则
有气体物质参与的反应中,固体或纯液体视为常数,不写入平衡常数表达式
在稀的水溶液中进行的反应,水的浓度变化不大,不写入平衡常数表达式
【活动1】
【学习任务一】从数据分析中认识化学平衡常数
1.写出下表中各反应的平衡常数表达式:
2NO2(g) N2O4(g)
3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
Br2+H2O H++Br-+HBrO
K= c(CO2)
CaCO3(s) CaO(s)+CO2(g)
【思维拓展】
【学习任务二】化学平衡常数与化学方程式的关系
2.写出下表中各反应的平衡常数表达式:
K
1
)
H
(
c
)
N
(
c
)
NH
(
c
2
3
2
3
2
=
K
2
)
NH
(
c
)
H
(
c
)
N
(
c
3
2
2
3
2
=
K
3
)
H
(
c
)
N
(
c
)
NH
(
c
/
/
2
2
3
2
2
1
3
=
①N2+3H2 2NH3
②2NH3 N2+3H2
N2 + H2 NH3
1
2
3
2
③
K1、K2、K3三者关系为
【思维拓展】
【学习任务二】化学平衡常数与化学方程式的关系
3.写出下表中各反应的平衡常数表达式:
2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K3
K1、K2、K3三者关系为K3 =
K1 K2
C (s) + H2O (g) CO (g) + H2 (g) K4
CO (g) +H2O (g) CO2 (g) + H2 (g) K5
C (s) + CO2(g) 2CO(g) K6
K4、K5、K6三者关系为K6 =
K4
K5
问题(4):化学平衡常数与化学方程式有什么关系
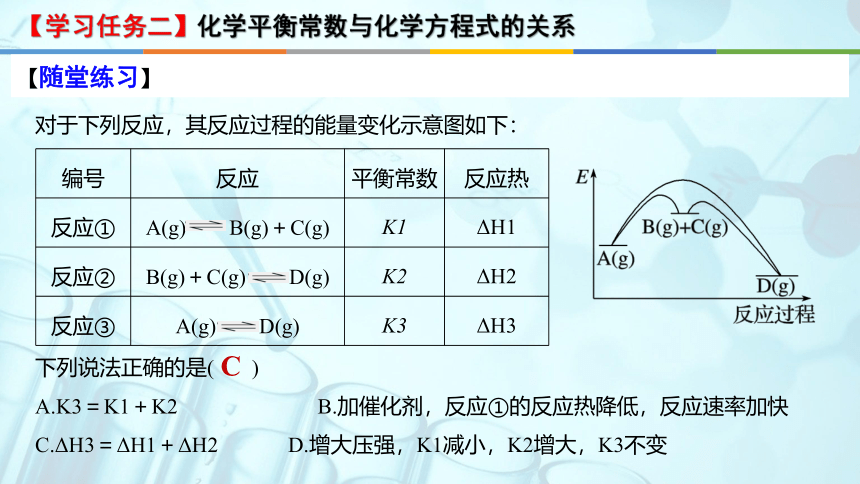
【随堂练习】
【学习任务二】化学平衡常数与化学方程式的关系
编号 反应 平衡常数 反应热
反应① A(g) B(g)+C(g) K1 ΔH1
反应② B(g)+C(g) D(g) K2 ΔH2
反应③ A(g) D(g) K3 ΔH3
对于下列反应,其反应过程的能量变化示意图如下:
下列说法正确的是( )
A.K3=K1+K2 B.加催化剂,反应①的反应热降低,反应速率加快
C.ΔH3=ΔH1+ΔH2 D.增大压强,K1减小,K2增大,K3不变
C
【学习任务三】 了解化学平衡常数的意义
(2)
(1)K值越大, 说明平衡体系中生成物所占的比例越大,正反应进行的程度越_______ ,平衡时反应物的转化率越_______ 。
大
大
化学平衡常数是定量地衡量化学反应进行的程度,
K值只说明反应能达到的最大限度,不能说明反应的速度。
(3)在给定的一个可逆反应中,化学平衡常数不受_______和_______的影响,只受_______的影响。
浓度
压强
温度
【随堂练习】
【学习任务三】 了解化学平衡常数的意义
1.已知450℃时,反应 H2(g)+I2(g) 2HI(g)的K=50,由此推测在450 ℃时,反应2HI(g) H2(g)+I2(g)的化学平衡常数为( )
A.50 B. 0.02
C.100 D.无法确定
B
【学习任务四】化学平衡常数的应用
1、利用平衡常数判断化学反应的可能性
根据下面给出的数据判断下列反应中哪些属于可逆反应,哪些属于非可逆反应?
25 ℃ 时,生成卤化氢反应的平衡常数
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
【学习任务四】化学平衡常数的应用
2、如何利用Qc与K的大小判断反应进行方向
浓度商(Qc)
对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),
浓度商
Q
Q与K的关系:当反应中有关物质的浓度商 平衡常数时,表明反应达到限度,即达到化学平衡状态。
等于
在任意时刻的 ,称为 ,常用 表示,即
【问题5】
【学习任务四】化学平衡常数的应用
【小结】
任何可逆反应的最终目标都是Q=K,多退少补,直到平衡
Q
=
c
p
(
C
)
·
c
q
(
D
)
c
m
(
A
)
·
c
n
(
B
)
则
:
当
Q
=
K
时
,
反应处于平衡状态
;
当
Q
<
K
时
,
反应向正反应方向进行
;
当
Q
>
K
时
,
反应向逆反应方向进行
。
浓度商:
【学习任务四】化学平衡常数的应用
【例1】已知反应 C(s)+H2O(g) CO(g)+H2(g) 的平衡常数K=1.0,某时刻H2O(g)、CO(g)、H2(g)的浓度分别为1.0mol/L,2.0mol/L,1.5mol/L。试回答:
(1)此时反应是否处于平衡状态?
(2)如果不平衡,此时反应朝哪个方向进行?
Q>K,v正<v逆,反应向逆方向进行
【解析】
Q=
c(CO)·c(H2)
c(C)· c(H2O)
=
2.0×1.5
1.0
=3.0mol/L≠K
【学习任务四】化学平衡常数的应用
【练习1】某温度下SO3的转化反应 2SO2(g)+O2(g) 2SO3(g)的K=45.89,下面三个混合体系中各物质的浓度(mol/L)如下表,试判断各体系是否达到平衡状态.
体系 SO2 O2 SO3 是否平衡 反应方向
1 6 4 2
2 0.1 0.30 0.50
否
逆向
否
正向
【课堂小结】化学平衡常数
化学平衡常数
概念与表达式
化学平衡常数的意义
化学平衡常数与化学方程式的关系
化学平衡常数的应用
【课后练习】化学平衡常数
1.正误判断
(1)化学平衡常数等于某一时刻生成物浓度幂之积与反应物浓度幂之积的比值。( )
(2)化学平衡常数与浓度有关,与温度无关。( )
(3)在任何条件下,一个可逆反应的化学平衡常数都是一个恒定值。( )
(4)K 越大,表明可逆反应正向进行的程度越大。( )
(5)平衡常数和平衡转化率都能体现可逆反应进行的程度。( )
(6)其他条件不变,使用不同催化剂,反应的平衡常数不变。( )
√
√
×
×
×
√
【课后练习】化学平衡常数
B
【课后练习】化学平衡常数
C
第2课时 化学平衡常数
第二章 第二节 化学平衡
学习情境
钢铁生产是第一次产业革命的两大产业之一。
19世纪后期,炼铁高炉所排出的高炉气中含有相当多量的CO,开始炼铁工程师们认为是CO与铁矿石接触不充分,于是设法增加高炉的高度。
令人吃惊的是,高炉增高后,高炉尾气中CO的含量竟然没有改变。
一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?457.6℃时反应体系I2(g) + H2(g) 2HI(g)中各物质的浓度如图所示
【学习任务一】从数据分析中认识化学平衡常数
序号 起始时各物质的浓度mol/L 平衡时各物质的浓度mol/L
H2 I2 HI H2 I2 HI 1 1.197×10-2 6.944×10-3 0 5.617×10-3 5.936×10-4 1.270×10-2 48.37
2 1.228×10-2 9.964×10-3 0 3.841×10-3 1.524×10-3 1.687×10-2 48.62
3 1.201×10-2 8.403×10-3 0 4.580×10-3 9.733×10-4 1.486×10-2 49.54
4 0 0 1.520×10-2 1.696×10-3 1.696×10-3 1.181×10-2 48.49
5 0 0 1.287×10-2 1.433×10-3 1.433×10-3 1.000×10-2 48.70
6 0 0 3.777×10-2 4.213×10-3 4.213×10-3 2.934×10-2 48.50
2
c (HI)
c(H2) · c(I2)
【查阅文献】
问题(1):在一定温度下,当一个可逆反应达到化学平衡状态时,浓度关系式的数值有什么关系?
问题(2)浓度的关系式与反应方程式有什么联系?
【学习任务一】从数据分析中认识化学平衡常数
问题(3)浓度关系式的数值是否随外界条件变化而改变?
(1)温度一定,当反应达到平衡时, 基本相同。
c2(HI)
c(H2)·c(I2)
(2)物质平衡浓度的指数与化学方程式中物质的化学计量数对应,
H2(g)+I2(g) 2HI(g)
(3)与反应物的起始浓度无关,与反应建立的途径无关,但随温度的变化而变化。
【概念建构】
【学习任务一】从数据分析中认识化学平衡常数
化学平衡常数
1、概念
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数叫做该反应的化学平衡常数
2、表达式
例如:mA + nB pC + qD
K
=
生成物浓度幂之积
反应物浓度幂之积
=
cp(C)·cq(D)
cm(A)·cn(B)
其中c为各组分的平衡时浓度
3、书写规则
有气体物质参与的反应中,固体或纯液体视为常数,不写入平衡常数表达式
在稀的水溶液中进行的反应,水的浓度变化不大,不写入平衡常数表达式
【活动1】
【学习任务一】从数据分析中认识化学平衡常数
1.写出下表中各反应的平衡常数表达式:
2NO2(g) N2O4(g)
3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
Br2+H2O H++Br-+HBrO
K= c(CO2)
CaCO3(s) CaO(s)+CO2(g)
【思维拓展】
【学习任务二】化学平衡常数与化学方程式的关系
2.写出下表中各反应的平衡常数表达式:
K
1
)
H
(
c
)
N
(
c
)
NH
(
c
2
3
2
3
2
=
K
2
)
NH
(
c
)
H
(
c
)
N
(
c
3
2
2
3
2
=
K
3
)
H
(
c
)
N
(
c
)
NH
(
c
/
/
2
2
3
2
2
1
3
=
①N2+3H2 2NH3
②2NH3 N2+3H2
N2 + H2 NH3
1
2
3
2
③
K1、K2、K3三者关系为
【思维拓展】
【学习任务二】化学平衡常数与化学方程式的关系
3.写出下表中各反应的平衡常数表达式:
2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K3
K1、K2、K3三者关系为K3 =
K1 K2
C (s) + H2O (g) CO (g) + H2 (g) K4
CO (g) +H2O (g) CO2 (g) + H2 (g) K5
C (s) + CO2(g) 2CO(g) K6
K4、K5、K6三者关系为K6 =
K4
K5
问题(4):化学平衡常数与化学方程式有什么关系
【随堂练习】
【学习任务二】化学平衡常数与化学方程式的关系
编号 反应 平衡常数 反应热
反应① A(g) B(g)+C(g) K1 ΔH1
反应② B(g)+C(g) D(g) K2 ΔH2
反应③ A(g) D(g) K3 ΔH3
对于下列反应,其反应过程的能量变化示意图如下:
下列说法正确的是( )
A.K3=K1+K2 B.加催化剂,反应①的反应热降低,反应速率加快
C.ΔH3=ΔH1+ΔH2 D.增大压强,K1减小,K2增大,K3不变
C
【学习任务三】 了解化学平衡常数的意义
(2)
(1)K值越大, 说明平衡体系中生成物所占的比例越大,正反应进行的程度越_______ ,平衡时反应物的转化率越_______ 。
大
大
化学平衡常数是定量地衡量化学反应进行的程度,
K值只说明反应能达到的最大限度,不能说明反应的速度。
(3)在给定的一个可逆反应中,化学平衡常数不受_______和_______的影响,只受_______的影响。
浓度
压强
温度
【随堂练习】
【学习任务三】 了解化学平衡常数的意义
1.已知450℃时,反应 H2(g)+I2(g) 2HI(g)的K=50,由此推测在450 ℃时,反应2HI(g) H2(g)+I2(g)的化学平衡常数为( )
A.50 B. 0.02
C.100 D.无法确定
B
【学习任务四】化学平衡常数的应用
1、利用平衡常数判断化学反应的可能性
根据下面给出的数据判断下列反应中哪些属于可逆反应,哪些属于非可逆反应?
25 ℃ 时,生成卤化氢反应的平衡常数
化学方程式 平衡常数 ( K )
F2(g) + H2(g) 2HF(g) 6.5 ×1095
Cl2(g) + H2(g) 2HCl(g) 2.57 ×1033
Br2(g) + H2(g) 2HBr(g) 1.91 ×1019
I2(g) + H2(g) 2HI(g) 8.67 ×102
【学习任务四】化学平衡常数的应用
2、如何利用Qc与K的大小判断反应进行方向
浓度商(Qc)
对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),
浓度商
Q
Q与K的关系:当反应中有关物质的浓度商 平衡常数时,表明反应达到限度,即达到化学平衡状态。
等于
在任意时刻的 ,称为 ,常用 表示,即
【问题5】
【学习任务四】化学平衡常数的应用
【小结】
任何可逆反应的最终目标都是Q=K,多退少补,直到平衡
Q
=
c
p
(
C
)
·
c
q
(
D
)
c
m
(
A
)
·
c
n
(
B
)
则
:
当
Q
=
K
时
,
反应处于平衡状态
;
当
Q
<
K
时
,
反应向正反应方向进行
;
当
Q
>
K
时
,
反应向逆反应方向进行
。
浓度商:
【学习任务四】化学平衡常数的应用
【例1】已知反应 C(s)+H2O(g) CO(g)+H2(g) 的平衡常数K=1.0,某时刻H2O(g)、CO(g)、H2(g)的浓度分别为1.0mol/L,2.0mol/L,1.5mol/L。试回答:
(1)此时反应是否处于平衡状态?
(2)如果不平衡,此时反应朝哪个方向进行?
Q>K,v正<v逆,反应向逆方向进行
【解析】
Q=
c(CO)·c(H2)
c(C)· c(H2O)
=
2.0×1.5
1.0
=3.0mol/L≠K
【学习任务四】化学平衡常数的应用
【练习1】某温度下SO3的转化反应 2SO2(g)+O2(g) 2SO3(g)的K=45.89,下面三个混合体系中各物质的浓度(mol/L)如下表,试判断各体系是否达到平衡状态.
体系 SO2 O2 SO3 是否平衡 反应方向
1 6 4 2
2 0.1 0.30 0.50
否
逆向
否
正向
【课堂小结】化学平衡常数
化学平衡常数
概念与表达式
化学平衡常数的意义
化学平衡常数与化学方程式的关系
化学平衡常数的应用
【课后练习】化学平衡常数
1.正误判断
(1)化学平衡常数等于某一时刻生成物浓度幂之积与反应物浓度幂之积的比值。( )
(2)化学平衡常数与浓度有关,与温度无关。( )
(3)在任何条件下,一个可逆反应的化学平衡常数都是一个恒定值。( )
(4)K 越大,表明可逆反应正向进行的程度越大。( )
(5)平衡常数和平衡转化率都能体现可逆反应进行的程度。( )
(6)其他条件不变,使用不同催化剂,反应的平衡常数不变。( )
√
√
×
×
×
√
【课后练习】化学平衡常数
B
【课后练习】化学平衡常数
C
