第三章第二节 第三课时 酸碱中和滴定 课件 2022-2023学年高二上学期化学人教版(2019)选择性必修1(19张ppt)
文档属性
| 名称 | 第三章第二节 第三课时 酸碱中和滴定 课件 2022-2023学年高二上学期化学人教版(2019)选择性必修1(19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 26.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-28 17:55:06 | ||
图片预览




文档简介
(共19张PPT)
第二节 水的电离和溶液的pH
凤凰中学
第三课时 酸碱中和滴定
【思考】实验室有一瓶未知浓度的氢氧化钠溶液,我们有没有办法知道它的浓度呢?
我们可以取一定量的该氢氧化钠溶液,用已知浓度的盐酸来与之反应,待恰好完全反应后再通过计算确定它的浓度。
1. 知道酸碱中和滴定的原理;
2. 认识滴定管的结构及使用方法;
3. 掌握酸碱中和滴定的实验操作、计算方法和误差分析。
一、酸碱中和滴定
1、定义:依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
2、原理:
① 中和反应的实质:
H+ + OH- = H2O
标准液
待测液
② 酸碱恰好反应时:
n(H+)酸=n(OH-)碱
即c(H+)酸·V酸=c(OH-)酸·V碱
3、待测液浓度的计算:
成败
关键
①准确量取参加反应的两溶液的体积
②准确判断恰好完全反应时的终点
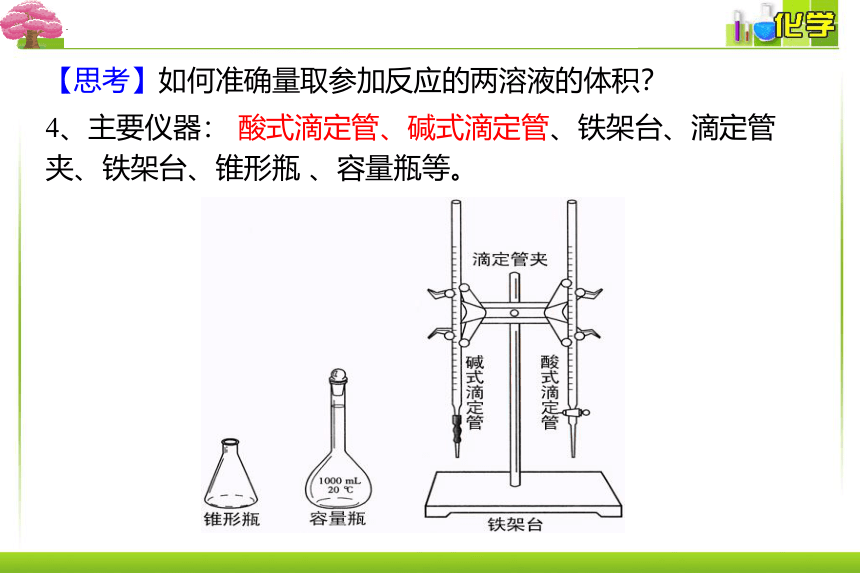
4、主要仪器: 酸式滴定管、碱式滴定管、铁架台、滴定管夹、铁架台、锥形瓶 、容量瓶等。
【思考】如何准确量取参加反应的两溶液的体积?
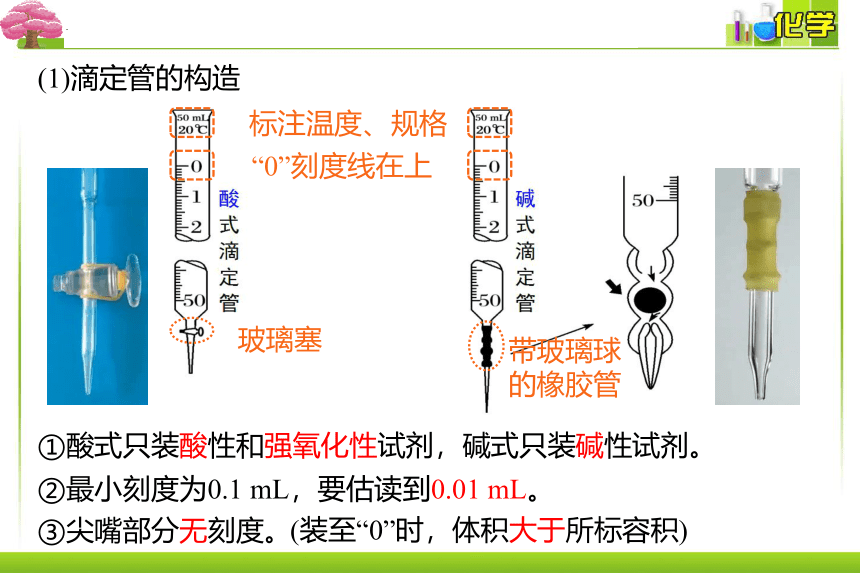
(1)滴定管的构造
标注温度、规格
“0”刻度线在上
玻璃塞
带玻璃球的橡胶管
②最小刻度为0.1 mL,要估读到0.01 mL。
③尖嘴部分无刻度。
(装至“0”时,体积大于所标容积)
①酸式只装酸性和强氧化性试剂,碱式只装碱性试剂。
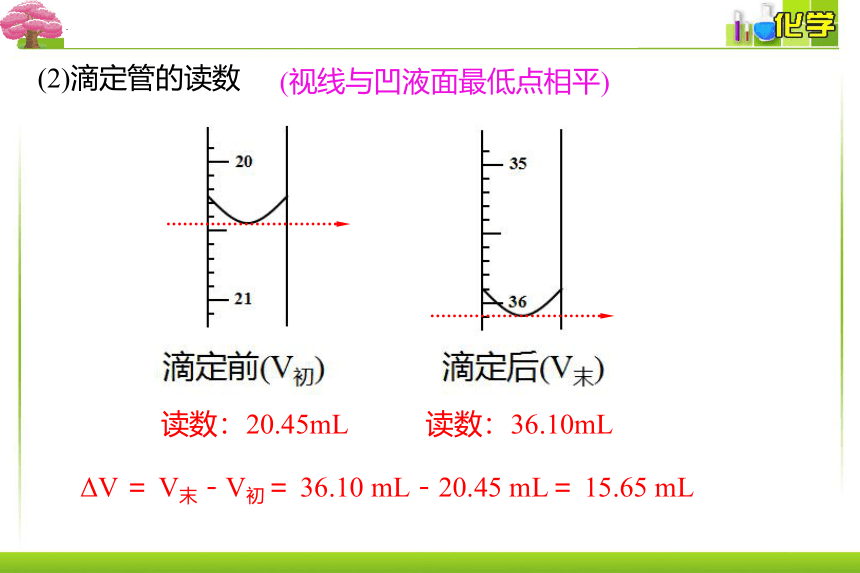
(2)滴定管的读数
(视线与凹液面最低点相平)
读数:20.45mL
读数:36.10mL
ΔV = V末-V初= 36.10 mL-20.45 mL= 15.65 mL
【思考】如何准确判断恰好完全反应时的终点?
5、酸碱指示剂及其变色范围
甲基橙
石蕊
酚酞
指示剂 甲基橙 石蕊 酚酞
变色范围pH 3.1-4.4 5.0-8.0 8.2-10.0
溶液颜色 红、橙、黄 红、紫、蓝 无色、浅红、红
注意:由于石蕊变色不明显,故不用作中和滴定的指示剂。
5、实验操作
(1)准备阶段
①滴定管
检漏
洗涤
润洗
装液
调液
记录
使用滴定管前,首先要检查是否漏水;
用蒸馏水清洗2~3次;
用待装的酸、碱液润洗2~3次;
将酸、碱液分别注入相应的滴定管中,并使液面位于“0”以上2~3 mL处;
让尖嘴部分充满反应液,并使液面处于某一刻度;
记录滴定管的初始读数。
用0.1000 mol/L盐酸滴定20.00 mL未知的浓度的NaOH溶液
洗涤
装液
加指示剂
用蒸馏水洗涤,不能用待测液润洗;
将滴定管中量好的待测氢氧化钠溶液加入其中;
滴入2~3滴指示剂。
5、实验操作
(1)准备阶段
②锥形瓶
用0.1000 mol/L盐酸滴定20.00 mL未知的浓度的NaOH溶液
(2)滴定阶段
控制活塞
摇动锥形瓶
锥形瓶
内溶液颜色变化
滴定过程中先快后慢,当接近终点时,应一滴一摇,甚至半滴一摇。
【思考】如何滴入半滴?
使锥形瓶内壁接触滴定管的尖嘴,用锥形瓶内壁“刮”下半滴标准液。
(3)滴定终点的判断
当滴入最后半滴标准液时,溶液由浅红色变为无色,且半分钟内不恢复为原来的颜色,即达到终点。
【思考】为什么只滴入半滴?
开始时由于待测液的浓度较大,加入少量的标准液对其pH影响不大。当接近滴定终点(pH=7)时,很少量(0.04mL
,约一滴)的碱或酸就会引起溶液pH突变。
例:用0.1000mol/L的HCl溶液,滴定20.00mL 0.1000mol/L的NaOH溶液,pH随V[HCl(aq)]的变化如下表所示:
V (盐酸) 0.00 15.00 19.50 19.98 20.00 20.02 20.50 25.00 40.00
pH 13.00 12.15 11.10 9.70 7.00 4.30 2.91 1.95 1.48
少加半滴
多加半滴
(4)滴定曲线
甲基橙
石蕊
酚酞
注意:滴定终点是指示剂颜色发生突变的点,但不一定是酸、碱的反应终点。通常有一定误差(允许误差)。
酚 酞 甲基橙
强酸滴定强碱
强碱滴定强酸
浅红色→无色
橙色→黄色
无色→浅红色
黄色→橙色
(5)数据处理
用0.1000 mol/L盐酸滴定20.00 mL未知的浓度的NaOH溶液
实验次数 消耗HCl溶液的体积 待测NaOH溶液的体积
1 22.25 20.00
2 23.14 20.00
3 22.27 20.00
平均值
22.26
20.00
若有数据偏差较大,则舍去
舍去
1、如图曲线a、b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )A. 盐酸的物质的量浓度为1 mol/LB. P点时恰好完全反应,溶液呈中性C. 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线D. 酚酞不能用作本实验的指示剂
B
2、25 ℃时,向20.00 mL浓度均为0.100 0 mol/L的三种酸HX、HY、HZ中分别加入浓度为0.100 0 mol/L的NaOH溶液,结果如图所示,下列说法正确的是( )A. 电离常数Ka(HY)=10-5B. 酸性强弱:HX>HY>HZC. HZ的电离方程式为HZ H++Z
D. 若加入过程温度发生变化,则V=40.00mL时Kw最大
A
二、酸碱中和滴定误差分析
1、产生误差的原因:操作不当,滴定终点判断不准等。
2、判断依据:
【例】用0.1000mol/L的HCl溶液,滴定20.00mL 未知浓度的NaOH溶液(用“偏高”、“偏低”或“无影响”填表)。
3、判断方法:看计算所代数据相比实际数据是偏大还是偏小
步骤 操作 V(HCl) c(NaOH)
洗涤 未用标准溶液润洗酸式滴定管
锥形瓶用待测溶液润洗
未用待测溶液润洗碱式滴定管
锥形瓶洗净残留有少量蒸馏水
偏高
偏高
偏高
偏高
偏低
偏低
不影响
不影响
【例】用0.1000mol/L的HCl溶液,滴定20.00mL 未知浓度的NaOH溶液(用“偏高”、“偏低”或“无影响”填表)。
步骤 操作 V(HCl) c(NaOH)
取液 取碱液时尖嘴部开始有气泡,读数时气泡消失
滴定 滴定完毕后立即读数,半分钟后颜色又恢复
滴定前尖嘴部分有气泡,滴定后气泡消失
滴定过程中振荡时有部分酸液滴到锥形瓶外
滴定过程中,锥形瓶内加少量蒸馏水
读数 滴定前仰视读数或滴定后俯视读数
滴定前俯视读数或滴定后仰视读数
偏低
偏低
偏低
偏低
偏高
偏高
偏高
偏高
不影响
不影响
偏低
偏低
偏高
偏高
用0.2000mol·L-1的标准NaOH溶液滴定20.00mL未知浓度的盐酸,用酚酞做指示剂,所得实验数据如下,请回答下列问题。
滴定次数 盐酸体积 消耗NaOH溶液体积
1 20.00 18.10
2 20.00 16.20
3 20.00 16.16
(1)量取20.00mL待测液应使用______________(填仪器名称);
(2)由表可知,第一次消耗NaOH溶液体积偏大,其可能的原因是____;
A. 锥形瓶装液前留有少量蒸馏水 B. 滴定结束时,仰视计数
C. 滴定前滴定管尖嘴有气泡,滴定结束无气泡
D. 滴定过程刚变色就立即停止滴定
(3)到达滴定终点的依据是______________________________________
________________________________________________________。
(4)根据表中记录数据,计算该盐酸浓度为_______mol/L。
酸式滴定管
BC
当滴入最后半滴标准液时,溶液由无色变为浅红色,且半分钟内不恢复为原来的颜色。
0.1618
第二节 水的电离和溶液的pH
凤凰中学
第三课时 酸碱中和滴定
【思考】实验室有一瓶未知浓度的氢氧化钠溶液,我们有没有办法知道它的浓度呢?
我们可以取一定量的该氢氧化钠溶液,用已知浓度的盐酸来与之反应,待恰好完全反应后再通过计算确定它的浓度。
1. 知道酸碱中和滴定的原理;
2. 认识滴定管的结构及使用方法;
3. 掌握酸碱中和滴定的实验操作、计算方法和误差分析。
一、酸碱中和滴定
1、定义:依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
2、原理:
① 中和反应的实质:
H+ + OH- = H2O
标准液
待测液
② 酸碱恰好反应时:
n(H+)酸=n(OH-)碱
即c(H+)酸·V酸=c(OH-)酸·V碱
3、待测液浓度的计算:
成败
关键
①准确量取参加反应的两溶液的体积
②准确判断恰好完全反应时的终点
4、主要仪器: 酸式滴定管、碱式滴定管、铁架台、滴定管夹、铁架台、锥形瓶 、容量瓶等。
【思考】如何准确量取参加反应的两溶液的体积?
(1)滴定管的构造
标注温度、规格
“0”刻度线在上
玻璃塞
带玻璃球的橡胶管
②最小刻度为0.1 mL,要估读到0.01 mL。
③尖嘴部分无刻度。
(装至“0”时,体积大于所标容积)
①酸式只装酸性和强氧化性试剂,碱式只装碱性试剂。
(2)滴定管的读数
(视线与凹液面最低点相平)
读数:20.45mL
读数:36.10mL
ΔV = V末-V初= 36.10 mL-20.45 mL= 15.65 mL
【思考】如何准确判断恰好完全反应时的终点?
5、酸碱指示剂及其变色范围
甲基橙
石蕊
酚酞
指示剂 甲基橙 石蕊 酚酞
变色范围pH 3.1-4.4 5.0-8.0 8.2-10.0
溶液颜色 红、橙、黄 红、紫、蓝 无色、浅红、红
注意:由于石蕊变色不明显,故不用作中和滴定的指示剂。
5、实验操作
(1)准备阶段
①滴定管
检漏
洗涤
润洗
装液
调液
记录
使用滴定管前,首先要检查是否漏水;
用蒸馏水清洗2~3次;
用待装的酸、碱液润洗2~3次;
将酸、碱液分别注入相应的滴定管中,并使液面位于“0”以上2~3 mL处;
让尖嘴部分充满反应液,并使液面处于某一刻度;
记录滴定管的初始读数。
用0.1000 mol/L盐酸滴定20.00 mL未知的浓度的NaOH溶液
洗涤
装液
加指示剂
用蒸馏水洗涤,不能用待测液润洗;
将滴定管中量好的待测氢氧化钠溶液加入其中;
滴入2~3滴指示剂。
5、实验操作
(1)准备阶段
②锥形瓶
用0.1000 mol/L盐酸滴定20.00 mL未知的浓度的NaOH溶液
(2)滴定阶段
控制活塞
摇动锥形瓶
锥形瓶
内溶液颜色变化
滴定过程中先快后慢,当接近终点时,应一滴一摇,甚至半滴一摇。
【思考】如何滴入半滴?
使锥形瓶内壁接触滴定管的尖嘴,用锥形瓶内壁“刮”下半滴标准液。
(3)滴定终点的判断
当滴入最后半滴标准液时,溶液由浅红色变为无色,且半分钟内不恢复为原来的颜色,即达到终点。
【思考】为什么只滴入半滴?
开始时由于待测液的浓度较大,加入少量的标准液对其pH影响不大。当接近滴定终点(pH=7)时,很少量(0.04mL
,约一滴)的碱或酸就会引起溶液pH突变。
例:用0.1000mol/L的HCl溶液,滴定20.00mL 0.1000mol/L的NaOH溶液,pH随V[HCl(aq)]的变化如下表所示:
V (盐酸) 0.00 15.00 19.50 19.98 20.00 20.02 20.50 25.00 40.00
pH 13.00 12.15 11.10 9.70 7.00 4.30 2.91 1.95 1.48
少加半滴
多加半滴
(4)滴定曲线
甲基橙
石蕊
酚酞
注意:滴定终点是指示剂颜色发生突变的点,但不一定是酸、碱的反应终点。通常有一定误差(允许误差)。
酚 酞 甲基橙
强酸滴定强碱
强碱滴定强酸
浅红色→无色
橙色→黄色
无色→浅红色
黄色→橙色
(5)数据处理
用0.1000 mol/L盐酸滴定20.00 mL未知的浓度的NaOH溶液
实验次数 消耗HCl溶液的体积 待测NaOH溶液的体积
1 22.25 20.00
2 23.14 20.00
3 22.27 20.00
平均值
22.26
20.00
若有数据偏差较大,则舍去
舍去
1、如图曲线a、b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )A. 盐酸的物质的量浓度为1 mol/LB. P点时恰好完全反应,溶液呈中性C. 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线D. 酚酞不能用作本实验的指示剂
B
2、25 ℃时,向20.00 mL浓度均为0.100 0 mol/L的三种酸HX、HY、HZ中分别加入浓度为0.100 0 mol/L的NaOH溶液,结果如图所示,下列说法正确的是( )A. 电离常数Ka(HY)=10-5B. 酸性强弱:HX>HY>HZC. HZ的电离方程式为HZ H++Z
D. 若加入过程温度发生变化,则V=40.00mL时Kw最大
A
二、酸碱中和滴定误差分析
1、产生误差的原因:操作不当,滴定终点判断不准等。
2、判断依据:
【例】用0.1000mol/L的HCl溶液,滴定20.00mL 未知浓度的NaOH溶液(用“偏高”、“偏低”或“无影响”填表)。
3、判断方法:看计算所代数据相比实际数据是偏大还是偏小
步骤 操作 V(HCl) c(NaOH)
洗涤 未用标准溶液润洗酸式滴定管
锥形瓶用待测溶液润洗
未用待测溶液润洗碱式滴定管
锥形瓶洗净残留有少量蒸馏水
偏高
偏高
偏高
偏高
偏低
偏低
不影响
不影响
【例】用0.1000mol/L的HCl溶液,滴定20.00mL 未知浓度的NaOH溶液(用“偏高”、“偏低”或“无影响”填表)。
步骤 操作 V(HCl) c(NaOH)
取液 取碱液时尖嘴部开始有气泡,读数时气泡消失
滴定 滴定完毕后立即读数,半分钟后颜色又恢复
滴定前尖嘴部分有气泡,滴定后气泡消失
滴定过程中振荡时有部分酸液滴到锥形瓶外
滴定过程中,锥形瓶内加少量蒸馏水
读数 滴定前仰视读数或滴定后俯视读数
滴定前俯视读数或滴定后仰视读数
偏低
偏低
偏低
偏低
偏高
偏高
偏高
偏高
不影响
不影响
偏低
偏低
偏高
偏高
用0.2000mol·L-1的标准NaOH溶液滴定20.00mL未知浓度的盐酸,用酚酞做指示剂,所得实验数据如下,请回答下列问题。
滴定次数 盐酸体积 消耗NaOH溶液体积
1 20.00 18.10
2 20.00 16.20
3 20.00 16.16
(1)量取20.00mL待测液应使用______________(填仪器名称);
(2)由表可知,第一次消耗NaOH溶液体积偏大,其可能的原因是____;
A. 锥形瓶装液前留有少量蒸馏水 B. 滴定结束时,仰视计数
C. 滴定前滴定管尖嘴有气泡,滴定结束无气泡
D. 滴定过程刚变色就立即停止滴定
(3)到达滴定终点的依据是______________________________________
________________________________________________________。
(4)根据表中记录数据,计算该盐酸浓度为_______mol/L。
酸式滴定管
BC
当滴入最后半滴标准液时,溶液由无色变为浅红色,且半分钟内不恢复为原来的颜色。
0.1618
