3.2.4酸碱中和滴定 课件 2022-2023学年高二上学期化学人教版(2019)选择性必修1(14张ppt)
文档属性
| 名称 | 3.2.4酸碱中和滴定 课件 2022-2023学年高二上学期化学人教版(2019)选择性必修1(14张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-28 17:56:24 | ||
图片预览





文档简介
(共14张PPT)
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第4课时酸碱中和滴定
现实验室有一瓶久置的未知浓度的NaOH溶液和一瓶已知浓度为0.1000mol/LHCl溶液,如何能准确测量出NaOH溶液的浓度呢?
思考与讨论
方法:取一定体积的待测NaOH溶液,向其滴加已知浓度为0.1000mol/LHCl溶液,至恰好完全中和,记录消耗HCl溶液的体积
为什么可行,其原理是?
酸碱中和滴定
一、酸碱中和滴定
酸碱中和滴定:
利用酸碱中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
滴定原理
1.中和反应的实质:
2.在酸碱恰好反应时,
若是一元酸和一元碱反应恰好完全反应时
c酸·V酸=c碱·V碱
H+ + OH- H2O
n(H+)=n(OH-)
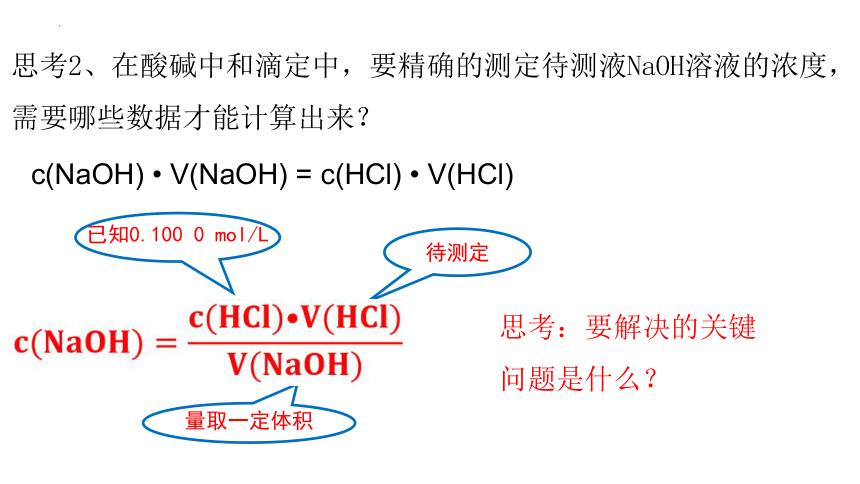
思考2、在酸碱中和滴定中,要精确的测定待测液NaOH溶液的浓度,需要哪些数据才能计算出来?
待测定
量取一定体积
已知0.100 0 mol/L
c(NaOH) V(NaOH) = c(HCl) V(HCl)
思考:要解决的关键问题是什么?
思考3、在下列仪器中选出能够准确量取溶液体积的仪器
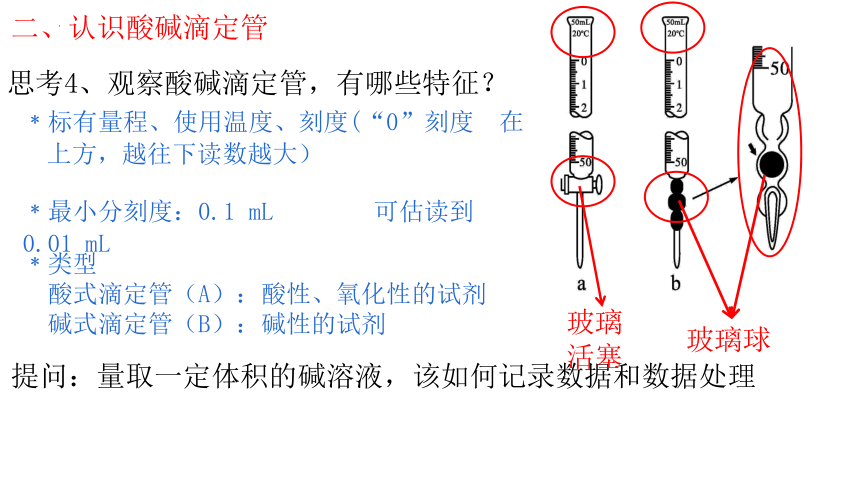
思考4、观察酸碱滴定管,有哪些特征?
二、认识酸碱滴定管
提问:量取一定体积的碱溶液,该如何记录数据和数据处理
﹡标有量程、使用温度、刻度(“0”刻度 在上方,越往下读数越大)
﹡最小分刻度:0.1 mL 可估读到 0.01 mL
﹡类型
酸式滴定管(A):酸性、氧化性的试剂
碱式滴定管(B):碱性的试剂
玻璃球
玻璃活塞
思考5、在解决关键问题以后,是否就能直接进行酸碱中和滴定实验了?
三、酸碱指示剂
疑问:强酸与强碱“恰好”反应时,所得溶液的pH=7,用酚酞作指示剂时,实际滴定终点的 pH=8.2,为什么可以将滴定终点当成“恰好” 反应的点?
几种常用指示剂的变色范围
四、滴定终点前后pH的变化
计算:用0.1000mol/LHCl溶液滴定20mL 0.1000mol/LNaOH溶液过程中溶液的pH
V(HCl)/mL 19.98 20.00 20.02
溶液的pH
碱式滴定管一滴溶液等于1/20 毫升
4.3
7
9.7
pH
12
10
8
6
4
2
10
20
30
40
反应终点
V[HCl(aq)]/mL
中和反应过程中的pH变化曲线
突变范围
0
酚酞
甲基橙
V[HCl(aq)]/mL 19.98 20.00 20.02
pH 9.7 7 4.3
误差 -0.1% 0 +0.1%
允许误差范围内
指示剂选择原则:
在突变范围内指示剂有明显的颜色变化,石蕊的紫色和蓝色差别不够明显,不用作指示剂。
思考6:在三种常用指示剂中,我们在实际实验中如何选择酸碱指示剂?
五、酸碱中和滴定实验
阅读书91-92页 实验活动2
用0.100 0 mol/L的HCl溶液测定未知浓度的NaOH溶液,归纳出实验步骤
1.滴定前的准备
2.滴定操作
3.数据处理
滴定管:查漏→水洗→润洗→注液→调液面→初始读书
锥形瓶:水洗→装液→滴指示剂
滴定速率:先快后慢,逐滴加入,不能成股流下
终点判断:当滴入最后半滴,溶液颜色变化,且半分钟不变为原色
c(标)·V(标)
V(aq)
=
c(待 )
实验反思:在实验中哪些操作会导致实验误差?
c(标)·V(标)
V(aq)
=
c(待 )
依据计算原理,分析V(标)的变化
酸碱中和滴定实验
完成P91-92实验活动,并完成P92数据处理
滴定次数 待测NaOH溶液的体积 HCl溶液 滴定前的刻度/mL 滴定后的刻度/mL 体积/mL
1
2
3
误差分析:在中和滴定操作过程中,用标准液滴定待测液,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空:(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 。 (2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 。 (3)滴定管在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果 。 (4)滴定前平视,滴定终点俯视,使滴定结果 。
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入半滴NaOH溶液时溶液呈浅红色,此时便停止滴定,可能使滴定结果 。 (6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。 (7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。 (8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
第三章 水溶液中的离子反应与平衡
第二节 水的电离和溶液的pH
第4课时酸碱中和滴定
现实验室有一瓶久置的未知浓度的NaOH溶液和一瓶已知浓度为0.1000mol/LHCl溶液,如何能准确测量出NaOH溶液的浓度呢?
思考与讨论
方法:取一定体积的待测NaOH溶液,向其滴加已知浓度为0.1000mol/LHCl溶液,至恰好完全中和,记录消耗HCl溶液的体积
为什么可行,其原理是?
酸碱中和滴定
一、酸碱中和滴定
酸碱中和滴定:
利用酸碱中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
滴定原理
1.中和反应的实质:
2.在酸碱恰好反应时,
若是一元酸和一元碱反应恰好完全反应时
c酸·V酸=c碱·V碱
H+ + OH- H2O
n(H+)=n(OH-)
思考2、在酸碱中和滴定中,要精确的测定待测液NaOH溶液的浓度,需要哪些数据才能计算出来?
待测定
量取一定体积
已知0.100 0 mol/L
c(NaOH) V(NaOH) = c(HCl) V(HCl)
思考:要解决的关键问题是什么?
思考3、在下列仪器中选出能够准确量取溶液体积的仪器
思考4、观察酸碱滴定管,有哪些特征?
二、认识酸碱滴定管
提问:量取一定体积的碱溶液,该如何记录数据和数据处理
﹡标有量程、使用温度、刻度(“0”刻度 在上方,越往下读数越大)
﹡最小分刻度:0.1 mL 可估读到 0.01 mL
﹡类型
酸式滴定管(A):酸性、氧化性的试剂
碱式滴定管(B):碱性的试剂
玻璃球
玻璃活塞
思考5、在解决关键问题以后,是否就能直接进行酸碱中和滴定实验了?
三、酸碱指示剂
疑问:强酸与强碱“恰好”反应时,所得溶液的pH=7,用酚酞作指示剂时,实际滴定终点的 pH=8.2,为什么可以将滴定终点当成“恰好” 反应的点?
几种常用指示剂的变色范围
四、滴定终点前后pH的变化
计算:用0.1000mol/LHCl溶液滴定20mL 0.1000mol/LNaOH溶液过程中溶液的pH
V(HCl)/mL 19.98 20.00 20.02
溶液的pH
碱式滴定管一滴溶液等于1/20 毫升
4.3
7
9.7
pH
12
10
8
6
4
2
10
20
30
40
反应终点
V[HCl(aq)]/mL
中和反应过程中的pH变化曲线
突变范围
0
酚酞
甲基橙
V[HCl(aq)]/mL 19.98 20.00 20.02
pH 9.7 7 4.3
误差 -0.1% 0 +0.1%
允许误差范围内
指示剂选择原则:
在突变范围内指示剂有明显的颜色变化,石蕊的紫色和蓝色差别不够明显,不用作指示剂。
思考6:在三种常用指示剂中,我们在实际实验中如何选择酸碱指示剂?
五、酸碱中和滴定实验
阅读书91-92页 实验活动2
用0.100 0 mol/L的HCl溶液测定未知浓度的NaOH溶液,归纳出实验步骤
1.滴定前的准备
2.滴定操作
3.数据处理
滴定管:查漏→水洗→润洗→注液→调液面→初始读书
锥形瓶:水洗→装液→滴指示剂
滴定速率:先快后慢,逐滴加入,不能成股流下
终点判断:当滴入最后半滴,溶液颜色变化,且半分钟不变为原色
c(标)·V(标)
V(aq)
=
c(待 )
实验反思:在实验中哪些操作会导致实验误差?
c(标)·V(标)
V(aq)
=
c(待 )
依据计算原理,分析V(标)的变化
酸碱中和滴定实验
完成P91-92实验活动,并完成P92数据处理
滴定次数 待测NaOH溶液的体积 HCl溶液 滴定前的刻度/mL 滴定后的刻度/mL 体积/mL
1
2
3
误差分析:在中和滴定操作过程中,用标准液滴定待测液,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空:(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 。 (2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 。 (3)滴定管在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果 。 (4)滴定前平视,滴定终点俯视,使滴定结果 。
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入半滴NaOH溶液时溶液呈浅红色,此时便停止滴定,可能使滴定结果 。 (6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。 (7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 。 (8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
