4-1原电池教学课件2022-2023学年高二上学期化学人教版(2019)选择性必修1(12张ppt)
文档属性
| 名称 | 4-1原电池教学课件2022-2023学年高二上学期化学人教版(2019)选择性必修1(12张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 962.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-28 17:58:35 | ||
图片预览



文档简介
(共12张PPT)
第六章 化学反应与能量
化学反应与电能
(原电池原理与化学电源)
课标要求:
1.通过实验认识构成原电池的条件
2.理解原电池的概念及工作原理
3.能正确判断原电池的正负极,书写电极反应式
4.了解常见的化学电源及分类,知道氢氧燃料电池的原理
【思考1】1.我国目前电能主要来自火力发电,火力发电能量是如何转化的呢?
2.火力发电存在哪些缺点?
经多次转换,能量损耗大,燃料利用率低;污染严重。
化学能 电能
直接
【思考2】
实验 步骤
实验 装置
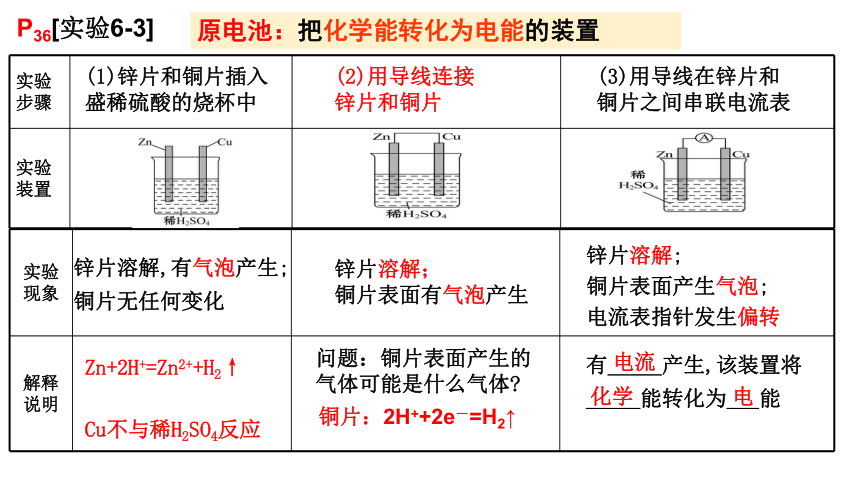
P36[实验6-3]
实验 现象
解释说明
电流
化学
电
(1)锌片和铜片插入
盛稀硫酸的烧杯中
(2)用导线连接锌片和铜片
(3)用导线在锌片和铜片之间串联电流表
有_____产生,该装置将
_____能转化为___能
Zn+2H+=Zn2++H2↑
Cu不与稀H2SO4反应
问题:铜片表面产生的气体可能是什么气体
铜片:2H++2e-=H2↑
原电池:把化学能转化为电能的装置
锌片溶解,有气泡产生;铜片无任何变化
锌片溶解;
铜片表面有气泡产生
锌片溶解;
铜片表面产生气泡;
电流表指针发生偏转
总反应:
Zn+2H+=Zn2++H2↑
Cu
Zn
-
-
-
Zn2+
H+
H+
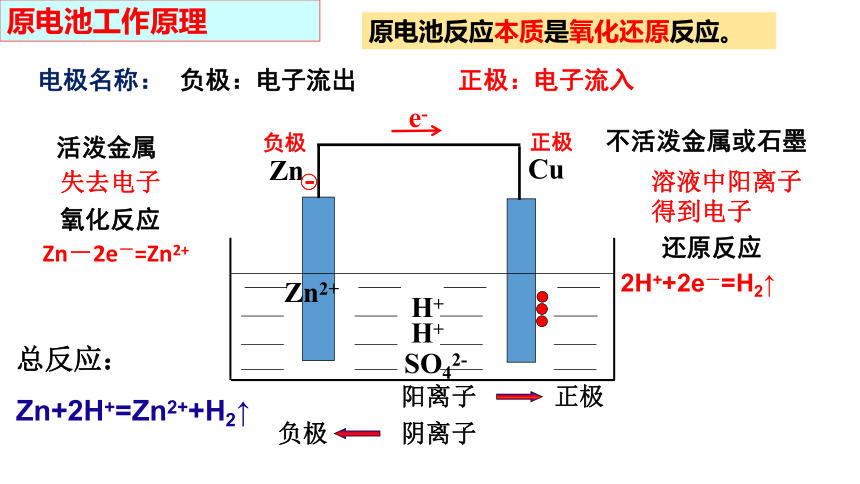
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
负极
正极
阳离子
失去电子
溶液中阳离子得到电子
阴离子
正极
负极
SO42-
原电池工作原理
活泼金属
不活泼金属或石墨
电极名称:
负极:电子流出 正极:电子流入
e-
原电池反应本质是氧化还原反应。
2.简单原电池的构成要素:
(2) 有两个活泼性不同的电极(金属或非金属导体如碳棒)
(3) 有电解质溶液
(4) 形成闭合电路
1.工作原理:
(1)负极(较活泼金属):本身失e-,发生氧化反应
电子:负极 正极
(2)正极(较不活泼金属或非金属导体):
溶液中阳离子得e-,发生还原反应
阳离子移向正极,阴离子移向负极
(1) 有自发的氧化还原反应(本质)
导线
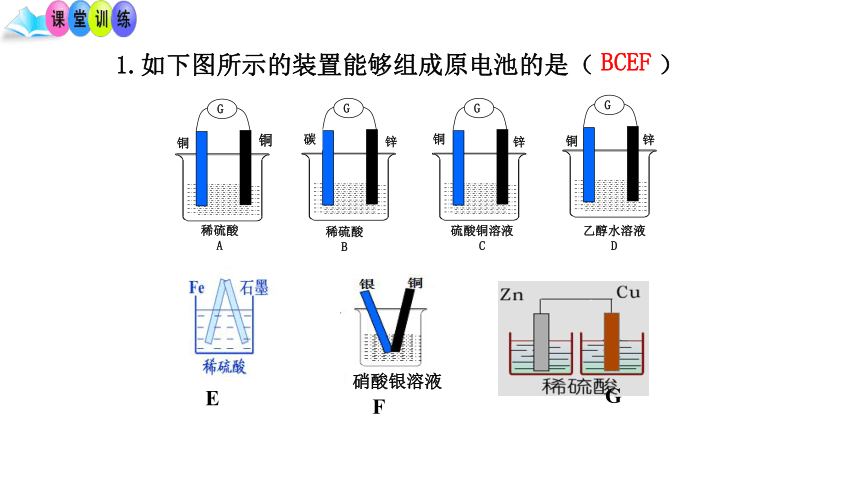
1.如下图所示的装置能够组成原电池的是( )
G
G
G
G
稀硫酸
A
稀硫酸
B
硫酸铜溶液
C
乙醇水溶液
D
铜
银
铜
锌
铜
锌
锌
铜
BCEF
E
F
铜
碳
硝酸银溶液
G
负极( 片):
正极( 片):
总反应:
锌 Zn -2e - = Zn 2+
Zn + Cu2+ = Zn2+ + Cu
3. 电极反应式的书写
负极( ):
正极( ):
总反应:
石墨 2H+ + 2e - = H2↑
Fe + 2H+ = Fe 2+ + H2↑
判断原电池正、负极,并写出电极反应式和总反应式
铜 Cu2+ + 2e - = Cu
Fe Fe -2e - =Fe 2+
电极名称 负极 正极
电子流向
电流流向
电极反应
电极材料
作用结果 (通常)
4.原电池正负极判断
得e-,电子流入
失e-,电子流出
电流流入
电流流出
一般不参与反应,
有气泡或增重
溶解,质量减小
离子移动
方向
阴离子移向负极
阳离子移向正极
氧化反应
还原反应
较活泼金属
较不活泼金属或非金属导体
2.X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为_________________
Z>Y>X>W
(1)一次电池(不可充电)
(2)二次电池(可充电)
(3)新型化学电池
碱性锌锰电池
铅蓄电池
燃料电池
普通锌锰电池
二、化学电源及分类
锂离子电池
三、燃料电池
燃料电池:是一种燃料(如氢气、甲烷、乙醇)和氧化剂(如O2)的化学能直接转化为电能的化学反应装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。
特点:清洁、安全、高效
P39
2、电极反应式:
1、总反应式:
正极:通氧气(氧化剂)
负极:通氢气(燃料)
氢氧燃料电池
2H2 + O2 = 2H2O
2H2 - 4e- +4OH- = 4H2O
O2 +4e- + 2H2O = 4OH-
碱性溶液 如:KOH溶液
酸性溶液 如:硫酸溶液
H2 - 2e- = 2H+
O2 + 4e- + 4H+ = 2H2O
负极:
正极:
负极:
正极:
O2
得电子
+H+
H2O
+H2O
OH-
思考:溶液的碱性 。(增大,不变,减弱)
酸性,反应式不会出现OH-,
碱性,反应式不会出现H+
第六章 化学反应与能量
化学反应与电能
(原电池原理与化学电源)
课标要求:
1.通过实验认识构成原电池的条件
2.理解原电池的概念及工作原理
3.能正确判断原电池的正负极,书写电极反应式
4.了解常见的化学电源及分类,知道氢氧燃料电池的原理
【思考1】1.我国目前电能主要来自火力发电,火力发电能量是如何转化的呢?
2.火力发电存在哪些缺点?
经多次转换,能量损耗大,燃料利用率低;污染严重。
化学能 电能
直接
【思考2】
实验 步骤
实验 装置
P36[实验6-3]
实验 现象
解释说明
电流
化学
电
(1)锌片和铜片插入
盛稀硫酸的烧杯中
(2)用导线连接锌片和铜片
(3)用导线在锌片和铜片之间串联电流表
有_____产生,该装置将
_____能转化为___能
Zn+2H+=Zn2++H2↑
Cu不与稀H2SO4反应
问题:铜片表面产生的气体可能是什么气体
铜片:2H++2e-=H2↑
原电池:把化学能转化为电能的装置
锌片溶解,有气泡产生;铜片无任何变化
锌片溶解;
铜片表面有气泡产生
锌片溶解;
铜片表面产生气泡;
电流表指针发生偏转
总反应:
Zn+2H+=Zn2++H2↑
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
负极
正极
阳离子
失去电子
溶液中阳离子得到电子
阴离子
正极
负极
SO42-
原电池工作原理
活泼金属
不活泼金属或石墨
电极名称:
负极:电子流出 正极:电子流入
e-
原电池反应本质是氧化还原反应。
2.简单原电池的构成要素:
(2) 有两个活泼性不同的电极(金属或非金属导体如碳棒)
(3) 有电解质溶液
(4) 形成闭合电路
1.工作原理:
(1)负极(较活泼金属):本身失e-,发生氧化反应
电子:负极 正极
(2)正极(较不活泼金属或非金属导体):
溶液中阳离子得e-,发生还原反应
阳离子移向正极,阴离子移向负极
(1) 有自发的氧化还原反应(本质)
导线
1.如下图所示的装置能够组成原电池的是( )
G
G
G
G
稀硫酸
A
稀硫酸
B
硫酸铜溶液
C
乙醇水溶液
D
铜
银
铜
锌
铜
锌
锌
铜
BCEF
E
F
铜
碳
硝酸银溶液
G
负极( 片):
正极( 片):
总反应:
锌 Zn -2e - = Zn 2+
Zn + Cu2+ = Zn2+ + Cu
3. 电极反应式的书写
负极( ):
正极( ):
总反应:
石墨 2H+ + 2e - = H2↑
Fe + 2H+ = Fe 2+ + H2↑
判断原电池正、负极,并写出电极反应式和总反应式
铜 Cu2+ + 2e - = Cu
Fe Fe -2e - =Fe 2+
电极名称 负极 正极
电子流向
电流流向
电极反应
电极材料
作用结果 (通常)
4.原电池正负极判断
得e-,电子流入
失e-,电子流出
电流流入
电流流出
一般不参与反应,
有气泡或增重
溶解,质量减小
离子移动
方向
阴离子移向负极
阳离子移向正极
氧化反应
还原反应
较活泼金属
较不活泼金属或非金属导体
2.X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为_________________
Z>Y>X>W
(1)一次电池(不可充电)
(2)二次电池(可充电)
(3)新型化学电池
碱性锌锰电池
铅蓄电池
燃料电池
普通锌锰电池
二、化学电源及分类
锂离子电池
三、燃料电池
燃料电池:是一种燃料(如氢气、甲烷、乙醇)和氧化剂(如O2)的化学能直接转化为电能的化学反应装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。
特点:清洁、安全、高效
P39
2、电极反应式:
1、总反应式:
正极:通氧气(氧化剂)
负极:通氢气(燃料)
氢氧燃料电池
2H2 + O2 = 2H2O
2H2 - 4e- +4OH- = 4H2O
O2 +4e- + 2H2O = 4OH-
碱性溶液 如:KOH溶液
酸性溶液 如:硫酸溶液
H2 - 2e- = 2H+
O2 + 4e- + 4H+ = 2H2O
负极:
正极:
负极:
正极:
O2
得电子
+H+
H2O
+H2O
OH-
思考:溶液的碱性 。(增大,不变,减弱)
酸性,反应式不会出现OH-,
碱性,反应式不会出现H+
