高中化学 人教版(2019)必修一 第二章 海水中的重要元素—氯和钠 单元梳理总结(23张课件)
文档属性
| 名称 | 高中化学 人教版(2019)必修一 第二章 海水中的重要元素—氯和钠 单元梳理总结(23张课件) |  | |
| 格式 | zip | ||
| 文件大小 | 35.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-28 18:00:29 | ||
图片预览




文档简介
(共23张PPT)
基于价类二维模型的
钠、氯及其化合物的研究
第二章 海水中的重要元素——钠和氯
一、来自大海的资源—NaCl
浩瀚的大海中化学资源丰富,日常生活离不开的食盐——NaCl就是自然提供的宝贵资源。NaCl除了食用,在工业上用途也很广,通过电解工艺可以为我们提供Na、Cl2、H2、NaOH等基础工业原料。而这些原料通过化学反应,又为我们提供了如洁厕灵(主要成分 HCl),漂白粉(主要成分 Ca(ClO)2)、Na2O2、小苏打、苏打等生活用品和工业用品,可以说化学是创造万物、开启丰富物质生活的钥匙。
一、来自大海的资源—NaCl
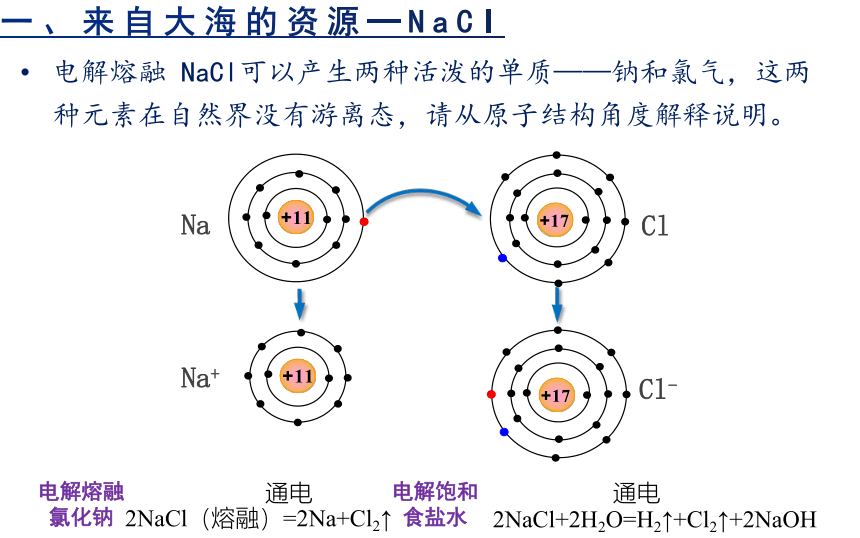
电解熔融 NaCl可以产生两种活泼的单质——钠和氯气,这两种元素在自然界没有游离态,请从原子结构角度解释说明。
Na
Cl
Na+
Cl-
2NaCl+2H2O=H2↑+Cl2↑+2NaOH
通电
2NaCl(熔融)=2Na+Cl2↑
通电
电解熔融氯化钠
电解饱和食盐水
二、钠及其化合物的转化及应用
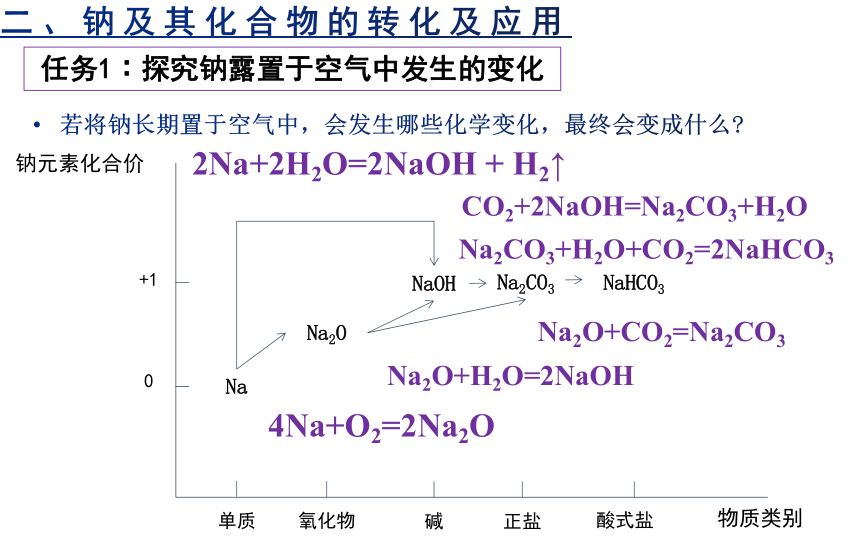
任务1∶探究钠露置于空气中发生的变化
若将钠长期置于空气中,会发生哪些化学变化,最终会变成什么
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
NaHCO3
4Na+O2=2Na2O
Na2O+H2O=2NaOH
CO2+2NaOH=Na2CO3+H2O
Na2CO3+H2O+CO2=2NaHCO3
Na2O+CO2=Na2CO3
2Na+2H2O=2NaOH + H2↑
二、钠及其化合物的转化及应用
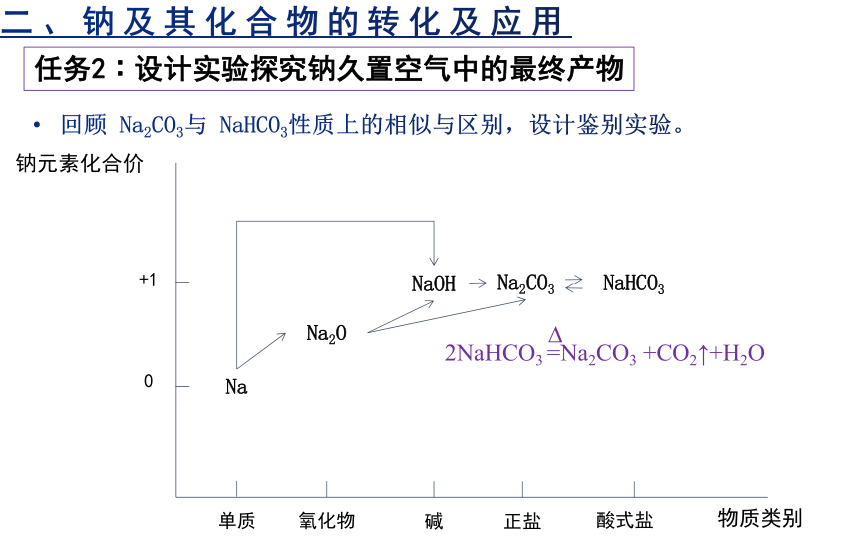
任务2∶设计实验探究钠久置空气中的最终产物
回顾 Na2CO3与 NaHCO3性质上的相似与区别,设计鉴别实验。
(1)利用热稳定性不同
(2)利用和酸反应生成气体的速率不同
(相同条件下)
(3)利用和BaCl2(或CaCl2)溶液反应时现象不同
(4)利用相同浓度溶液的酸碱性不同
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
NaHCO3
回顾 Na2CO3与 NaHCO3性质上的相似与区别,设计鉴别实验。
2NaHCO3 =Na2CO3 +CO2↑+H2O
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
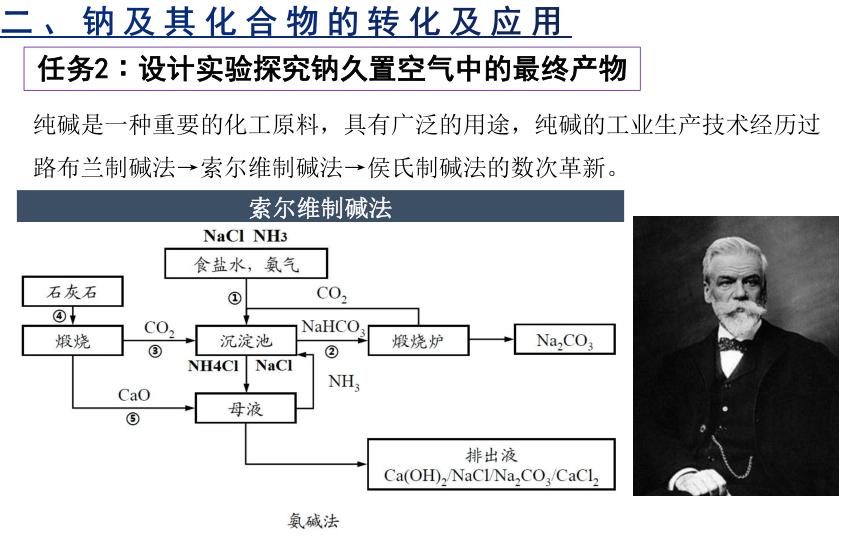
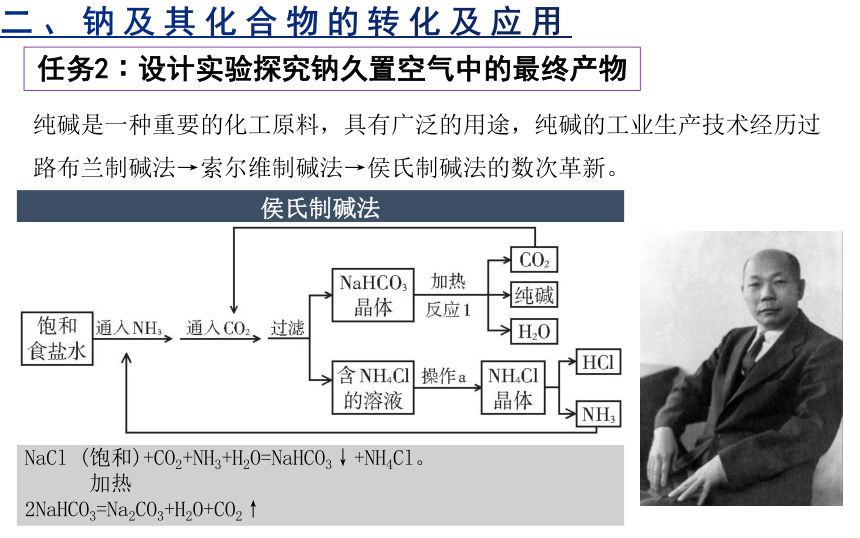
纯碱是一种重要的化工原料,具有广泛的用途,纯碱的工业生产技术经历过路布兰制碱法→索尔维制碱法→侯氏制碱法的数次革新。
路布兰制碱法
1791年法国医生路布兰首先取得专利,以食盐为原料,制得了纯碱,是为路布兰制碱法。原理与步骤此法分为三步:
加热
(1)2NaCl+H2SO4=Na2SO4+2HCl↑
高温
(2)Na2SO4+4C=Na2S+4CO↑
(3)Na2S+CaCO3=Na2CO3+CaS
主要生产过程在固相中进行,难以连续生产,又需硫酸作原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵,所以在投产50年后开始不知1867年发明的索尔维法(即氨碱法)的竞争,终于在20世纪20年代被淘汰。
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
纯碱是一种重要的化工原料,具有广泛的用途,纯碱的工业生产技术经历过路布兰制碱法→索尔维制碱法→侯氏制碱法的数次革新。
索尔维制碱法
1861年,比利时人索尔维以食盐、石灰石和氨为原料,制得了碳酸钠和氯化钙,是为氨碱法。反应步骤为:
(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O
高温
CaCO3=CaO+CO2↑,CaO+H2O=Ca(OH)2
高温
(2)2NaHCO3=Na2CO3+CO2↑+H2O
氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,成本低廉。缺点在于食盐中的氯和石灰中的钙结合生成了氯化钙,这个产物都没有利用上。
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
纯碱是一种重要的化工原料,具有广泛的用途,纯碱的工业生产技术经历过路布兰制碱法→索尔维制碱法→侯氏制碱法的数次革新。
侯氏制碱法
掌握索尔维制碱法的公司为了独享制碱技术成果,他们采取了严密的保密措施,使外人对此新技术一无所知。一些技术专家想探索此项技术秘密,大都以失败告终。不料这一秘密竟被一个中国人运用智慧摸索出来了,这个人就是侯德榜。
联合法制碱是以氯化钠、二氧化碳、氨和水为原料, 制取纯碱, 副产氯化铵的过程。氯化铵主要用作农肥, 但它的质量影响着纯碱工业的发展。“联合制碱法”也被称为“侯氏制碱法”。
其总反应方程式为:
NaCl (饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
加热
2NaHCO3=Na2CO3+H2O+CO2↑
二、钠及其化合物的转化及应用
任务4∶完成 Na 二维图中的相互转化关系图
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
NaHCO3
NaCl
NaCl (饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl
二、钠及其化合物的转化及应用
任务3∶新型"氧泡泡洗涤剂"成分探究
新型"氧泡泡洗涤剂",采用某碱性钠盐固体结合 H2O2分子作为去污试剂,可去除油污和"还原性"污渍。
Na2CO3
考虑去除油污与"还原性"污渍的主要特性,可以用哪种物质替代氧泡泡的主要成分。
你觉得该钠盐是什么
有强氧化性且能产生碱性环境的物质可能是 Na2O2。
二、钠及其化合物的转化及应用
任务4∶完成 Na 二维图中的相互转化关系图
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
Na2O2
NaHCO3
NaCl
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na+O2=Na2O2
2Na+Cl2=2NaCl
CuCl2+2Na+2H2O=Cu(OH)2↓+2NaCl+ H2↑
2NaCl(熔融)=2Na+Cl2↑
通电
2FeCl3+6Na+6H2O=2Fe(OH)3↓+6NaCl+ 3H2↑
三、氯及其化合物的转化及应用
将NaCl、盐酸、次氯酸、氯化钙(可做干燥剂、融雪盐)、FeCl3、漂白粉(有效成分Ca(ClO)2)、84消毒液(NaCIO)等含氯物质按照物质类别和氯元素的化合价填入"价态—类别"二维坐标图。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
NaClO、Ca(ClO)2是生产生活中常用的消毒剂和漂白剂,它们的消毒原理是什么 写出相应的化学方程式。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
CO2 + NaClO + H2O =HClO + NaHCO3
CO2 + Ca(ClO)2 + H2O =2HClO + CaCO3↓
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
曾报道有人将洁厕灵与漂白粉同时混合使用导致氯气中毒事件。请从氧化还原角度分析原因,写出离子方程式。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
H++Cl-+HClO=Cl2↑+H2O
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
工业上是如何制备漂白粉的 写出化学方程式。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
2Cl2 +2Ca(OH)2 =CaCl2+ Ca(ClO)2+2H2O
Cl2 +2NaOH =NaCl + NaClO+H2O
Cl2 + H2O =HCl + HClO
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
4.氯气与碱的反应放出热量,生产中发现若温度过高,所得漂白粉的漂白效果大大降低,原因是生成了更高价的含氯盐类。推测氯气与热的氢氧化钙发生反应的产物。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
Ca(ClO3)2
6Cl2+6Ca(OH)2=5CaCl2 +Ca(ClO3)2 +6H2O
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
84消毒液用过热水处理,杀菌消毒能力反而减弱,原因是其受热可进一步反应成常见的两种含氯盐类物质。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
Ca(ClO3)2
NaClO3
3NaClO=NaClO3+2NaCl
三、氯及其化合物的转化及应用
目前,有一种号称挂胸前就能杀菌的网红除菌卡非常流行。据研究,除菌卡的有效成分是ClO2,但其浓度非常低,在开放的空间并不能有效杀菌。
1.ClO2为什么有杀菌消毒的能力
2.如果你是氯碱工业工厂的工程师,请利用工厂现有资源(Cl2、NaOH、HCl、NaClO3),设计生产ClO2的方案。
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
ClO2
Cl2
Ca(ClO)2
CaCl2
FeCl3
NaClO3
Ca(ClO3)2
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
2Fe+3Cl2=2FeCl3
H2+Cl2=2HCl
点燃
2Na+Cl2=2NaCl
Cl2 +2NaOH =NaCl + NaClO+H2O
Cl2 +2NaBr =2NaCl + Br2
实验室中有一瓶0.1mol/L氢氧化钠溶液,某同学为制备Na2CO3溶液,计划向其中通入CO2气体,你认为他可以制得纯的碳酸钠溶液吗
向 NaOH溶液通CO2至过量的过程中溶液中的溶质可能有哪些
同学为探究通入CO2后的溶液溶质成分,计划在通入CO2的过程中,分次取出20mL溶液滴加稀盐酸,将产生的气体体积与加入盐酸的体积绘成坐标图。
四、以物质的量为中心的化学计算
NaHCO3
Na2CO3和NaHCO3
Na2CO3
如何制得纯的碳酸钠溶液吗
NaHCO3+NaOH=Na2CO3+H2O
四、以物质的量为中心的化学计算
例题∶某化学氯碱工业公司利用反应
①3Cl2+6NaOH=5NaCl+NaClO3+3H2O和反应
②2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O生产ClO2,现该公司想
生产135kg ClO2,
计算∶M(ClO2)=67.5g/mol
(1)反应②转移的电子数目是多少
(2)至少需要消耗6mol/L的盐酸多少升
(3)至少需要消耗标准状况下的氯气多少升
n
N
×NA
÷NA
×M
÷M
m
(质量)
(粒子数)
V
(体积)
÷Vm
×Vm
÷Vaq
×Vaq
cB
(物质的量浓度)
四、以物质的量为中心的化学计算
今日作业(智学网上传)
1.3D笔记96-98页(剩余部分);
2.教材62-66页
3.学案最后两道实验题例题
基于价类二维模型的
钠、氯及其化合物的研究
第二章 海水中的重要元素——钠和氯
一、来自大海的资源—NaCl
浩瀚的大海中化学资源丰富,日常生活离不开的食盐——NaCl就是自然提供的宝贵资源。NaCl除了食用,在工业上用途也很广,通过电解工艺可以为我们提供Na、Cl2、H2、NaOH等基础工业原料。而这些原料通过化学反应,又为我们提供了如洁厕灵(主要成分 HCl),漂白粉(主要成分 Ca(ClO)2)、Na2O2、小苏打、苏打等生活用品和工业用品,可以说化学是创造万物、开启丰富物质生活的钥匙。
一、来自大海的资源—NaCl
电解熔融 NaCl可以产生两种活泼的单质——钠和氯气,这两种元素在自然界没有游离态,请从原子结构角度解释说明。
Na
Cl
Na+
Cl-
2NaCl+2H2O=H2↑+Cl2↑+2NaOH
通电
2NaCl(熔融)=2Na+Cl2↑
通电
电解熔融氯化钠
电解饱和食盐水
二、钠及其化合物的转化及应用
任务1∶探究钠露置于空气中发生的变化
若将钠长期置于空气中,会发生哪些化学变化,最终会变成什么
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
NaHCO3
4Na+O2=2Na2O
Na2O+H2O=2NaOH
CO2+2NaOH=Na2CO3+H2O
Na2CO3+H2O+CO2=2NaHCO3
Na2O+CO2=Na2CO3
2Na+2H2O=2NaOH + H2↑
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
回顾 Na2CO3与 NaHCO3性质上的相似与区别,设计鉴别实验。
(1)利用热稳定性不同
(2)利用和酸反应生成气体的速率不同
(相同条件下)
(3)利用和BaCl2(或CaCl2)溶液反应时现象不同
(4)利用相同浓度溶液的酸碱性不同
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
NaHCO3
回顾 Na2CO3与 NaHCO3性质上的相似与区别,设计鉴别实验。
2NaHCO3 =Na2CO3 +CO2↑+H2O
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
纯碱是一种重要的化工原料,具有广泛的用途,纯碱的工业生产技术经历过路布兰制碱法→索尔维制碱法→侯氏制碱法的数次革新。
路布兰制碱法
1791年法国医生路布兰首先取得专利,以食盐为原料,制得了纯碱,是为路布兰制碱法。原理与步骤此法分为三步:
加热
(1)2NaCl+H2SO4=Na2SO4+2HCl↑
高温
(2)Na2SO4+4C=Na2S+4CO↑
(3)Na2S+CaCO3=Na2CO3+CaS
主要生产过程在固相中进行,难以连续生产,又需硫酸作原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵,所以在投产50年后开始不知1867年发明的索尔维法(即氨碱法)的竞争,终于在20世纪20年代被淘汰。
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
纯碱是一种重要的化工原料,具有广泛的用途,纯碱的工业生产技术经历过路布兰制碱法→索尔维制碱法→侯氏制碱法的数次革新。
索尔维制碱法
1861年,比利时人索尔维以食盐、石灰石和氨为原料,制得了碳酸钠和氯化钙,是为氨碱法。反应步骤为:
(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O
高温
CaCO3=CaO+CO2↑,CaO+H2O=Ca(OH)2
高温
(2)2NaHCO3=Na2CO3+CO2↑+H2O
氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,成本低廉。缺点在于食盐中的氯和石灰中的钙结合生成了氯化钙,这个产物都没有利用上。
二、钠及其化合物的转化及应用
任务2∶设计实验探究钠久置空气中的最终产物
纯碱是一种重要的化工原料,具有广泛的用途,纯碱的工业生产技术经历过路布兰制碱法→索尔维制碱法→侯氏制碱法的数次革新。
侯氏制碱法
掌握索尔维制碱法的公司为了独享制碱技术成果,他们采取了严密的保密措施,使外人对此新技术一无所知。一些技术专家想探索此项技术秘密,大都以失败告终。不料这一秘密竟被一个中国人运用智慧摸索出来了,这个人就是侯德榜。
联合法制碱是以氯化钠、二氧化碳、氨和水为原料, 制取纯碱, 副产氯化铵的过程。氯化铵主要用作农肥, 但它的质量影响着纯碱工业的发展。“联合制碱法”也被称为“侯氏制碱法”。
其总反应方程式为:
NaCl (饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
加热
2NaHCO3=Na2CO3+H2O+CO2↑
二、钠及其化合物的转化及应用
任务4∶完成 Na 二维图中的相互转化关系图
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
NaHCO3
NaCl
NaCl (饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl
二、钠及其化合物的转化及应用
任务3∶新型"氧泡泡洗涤剂"成分探究
新型"氧泡泡洗涤剂",采用某碱性钠盐固体结合 H2O2分子作为去污试剂,可去除油污和"还原性"污渍。
Na2CO3
考虑去除油污与"还原性"污渍的主要特性,可以用哪种物质替代氧泡泡的主要成分。
你觉得该钠盐是什么
有强氧化性且能产生碱性环境的物质可能是 Na2O2。
二、钠及其化合物的转化及应用
任务4∶完成 Na 二维图中的相互转化关系图
钠元素化合价
物质类别
单质
氧化物
碱
正盐
酸式盐
0
+1
Na
Na2O
NaOH
Na2CO3
Na2O2
NaHCO3
NaCl
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na+O2=Na2O2
2Na+Cl2=2NaCl
CuCl2+2Na+2H2O=Cu(OH)2↓+2NaCl+ H2↑
2NaCl(熔融)=2Na+Cl2↑
通电
2FeCl3+6Na+6H2O=2Fe(OH)3↓+6NaCl+ 3H2↑
三、氯及其化合物的转化及应用
将NaCl、盐酸、次氯酸、氯化钙(可做干燥剂、融雪盐)、FeCl3、漂白粉(有效成分Ca(ClO)2)、84消毒液(NaCIO)等含氯物质按照物质类别和氯元素的化合价填入"价态—类别"二维坐标图。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
NaClO、Ca(ClO)2是生产生活中常用的消毒剂和漂白剂,它们的消毒原理是什么 写出相应的化学方程式。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
CO2 + NaClO + H2O =HClO + NaHCO3
CO2 + Ca(ClO)2 + H2O =2HClO + CaCO3↓
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
曾报道有人将洁厕灵与漂白粉同时混合使用导致氯气中毒事件。请从氧化还原角度分析原因,写出离子方程式。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
H++Cl-+HClO=Cl2↑+H2O
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
工业上是如何制备漂白粉的 写出化学方程式。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
2Cl2 +2Ca(OH)2 =CaCl2+ Ca(ClO)2+2H2O
Cl2 +2NaOH =NaCl + NaClO+H2O
Cl2 + H2O =HCl + HClO
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
4.氯气与碱的反应放出热量,生产中发现若温度过高,所得漂白粉的漂白效果大大降低,原因是生成了更高价的含氯盐类。推测氯气与热的氢氧化钙发生反应的产物。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
Ca(ClO3)2
6Cl2+6Ca(OH)2=5CaCl2 +Ca(ClO3)2 +6H2O
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
84消毒液用过热水处理,杀菌消毒能力反而减弱,原因是其受热可进一步反应成常见的两种含氯盐类物质。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
Cl2
Ca(ClO)2
CaCl2
FeCl3
Ca(ClO3)2
NaClO3
3NaClO=NaClO3+2NaCl
三、氯及其化合物的转化及应用
目前,有一种号称挂胸前就能杀菌的网红除菌卡非常流行。据研究,除菌卡的有效成分是ClO2,但其浓度非常低,在开放的空间并不能有效杀菌。
1.ClO2为什么有杀菌消毒的能力
2.如果你是氯碱工业工厂的工程师,请利用工厂现有资源(Cl2、NaOH、HCl、NaClO3),设计生产ClO2的方案。
三、氯及其化合物的转化及应用
思考回答下列问题,同时寻找含氯物质间转化的规律。
氯元素化合价
物质类别
酸
氧化物
单质
盐
-1
0
+1
+4
+5
NaCl
NaClO
HCl
HClO
ClO2
Cl2
Ca(ClO)2
CaCl2
FeCl3
NaClO3
Ca(ClO3)2
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
2Fe+3Cl2=2FeCl3
H2+Cl2=2HCl
点燃
2Na+Cl2=2NaCl
Cl2 +2NaOH =NaCl + NaClO+H2O
Cl2 +2NaBr =2NaCl + Br2
实验室中有一瓶0.1mol/L氢氧化钠溶液,某同学为制备Na2CO3溶液,计划向其中通入CO2气体,你认为他可以制得纯的碳酸钠溶液吗
向 NaOH溶液通CO2至过量的过程中溶液中的溶质可能有哪些
同学为探究通入CO2后的溶液溶质成分,计划在通入CO2的过程中,分次取出20mL溶液滴加稀盐酸,将产生的气体体积与加入盐酸的体积绘成坐标图。
四、以物质的量为中心的化学计算
NaHCO3
Na2CO3和NaHCO3
Na2CO3
如何制得纯的碳酸钠溶液吗
NaHCO3+NaOH=Na2CO3+H2O
四、以物质的量为中心的化学计算
例题∶某化学氯碱工业公司利用反应
①3Cl2+6NaOH=5NaCl+NaClO3+3H2O和反应
②2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O生产ClO2,现该公司想
生产135kg ClO2,
计算∶M(ClO2)=67.5g/mol
(1)反应②转移的电子数目是多少
(2)至少需要消耗6mol/L的盐酸多少升
(3)至少需要消耗标准状况下的氯气多少升
n
N
×NA
÷NA
×M
÷M
m
(质量)
(粒子数)
V
(体积)
÷Vm
×Vm
÷Vaq
×Vaq
cB
(物质的量浓度)
四、以物质的量为中心的化学计算
今日作业(智学网上传)
1.3D笔记96-98页(剩余部分);
2.教材62-66页
3.学案最后两道实验题例题
