湖北省黄冈市重点中学2022-2023学年高三上学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 湖北省黄冈市重点中学2022-2023学年高三上学期期中考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 578.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-28 18:35:26 | ||
图片预览


文档简介
黄冈市重点中学2022-2023学年高三上学期期中考试
化学
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Na 23 S 32 Cl 35.5
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关,下列说法错误的是( )
A.可用作食品添加剂 B. NaHCO3可用作食品膨松剂
C.高纯二氧化硅可用于制作光感电池 D.漂粉精可用于游泳池的消毒
2. 2022年10月酱油食品添加剂“双标”事件备受关注,山梨酸是常用的食品防腐剂,其结构简式如图所示,下列有关山梨酸的叙述错误的是 ( )
A. 既能发生取代反应,又能发生加成反应 B. 分子中所有碳原子可能同一平面上
C. 与互为同分异构体 D. 1mol该物质与足量Na反应生成3gH2
3. 下列化学用语表示正确的是 ( )
A. 乙醇的结构简式:C2H6O B. 氯化氢的电子式:
C. CH4分子的球棍模型: D. HClO的结构式:H-O-Cl
4. 能正确表示下列反应的离子方程式为 ( )
A. 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O=2HClO+
B. NaHCO3的水解:HCO+H2O = CO+H3O+
C. 向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓
D. 将等物质的量浓度的Ba(OH)2和NH4HSO4溶液等体积混合:
Ba2++2OH-+H++NH+SO= BaSO4↓+H2O+NH3·H2O
5.今年十一假期的人文考古游成为热点,很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值,下列说法正确的是( )
A. 宣纸是合成高分子材料
B.兽首玛瑙杯主要成分为硅酸盐
C.三星堆青铜面具属于合金材料
D. 《梦溪笔谈》中记载:“方家以磁石磨针锋,则能指南。”磁石的主要成分是Fe2O3
6.下列操作与现象、结论均正确的是 ( )
选项 操作与现象 结论
A 向FeSO4溶液中加入少量的Na2O2粉末,产生红褐色沉淀 硫酸亚铁已变质
B 在乙醇中加入一小块钠,钠沉入底部并观察到气泡产生 钠的密度大于乙醇的密度,且生成的气体为氢气
C 向NaHCO3溶液中加入CaCl2溶液,产生白色沉淀 用CaCl2溶液可鉴别KHCO3溶液和(NH4)2CO3溶液
D 向Cu(NO3)2溶液中加入含淀粉的KI溶液,溶液变蓝色,并生成白色沉淀 白色沉淀是CuI2
7.短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子半径最小,W与Y同主族,X原子最外层电子数是其次外层电子数的3倍。火山喷口附近有Z的单质存在,四种元素形成的一种化合物Q的结构如图所示。下列说法错误的是( )
A.原子半径:
B.Z的最高价氧化物对应的水化物是强酸
C.W与Y形成的化合物属于离子化合物
D.Z的简单气态氢化物比X的简单气态氢化物稳定
8.与石墨结构相似的六方氮化硼(BN)晶体在高温高压下可以转化为立方氮化硼(BN),立方氮化硼的结构与金刚石相似,硬度与金刚石相当。下列关于该物质的分析中正确的是( )
A.六方氮化硼转化为立方氮化硼是物理变化
B.立方氮化硼(BN)结构中有配位键
C.和键相比,键的键长更长
D.六方氮化硼比晶体硅的熔点更高,硬度更大
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1.8g重水(D2O)中所含质子数为NA
B.分子中含有的键数目为
A.中含有0.1NA个阳离子
D.和于密闭容器中充分反应后,分子总数为
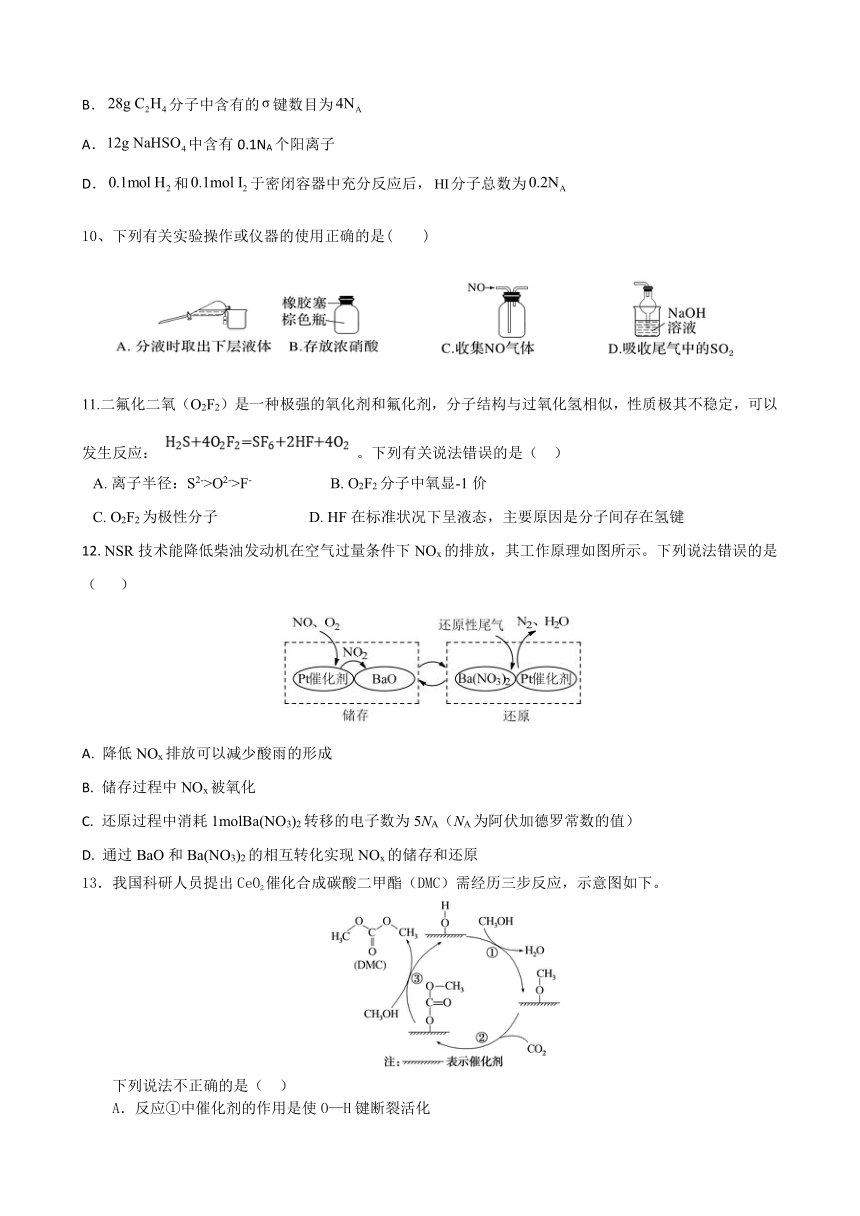
10、下列有关实验操作或仪器的使用正确的是( )
11.二氟化二氧(O2F2)是一种极强的氧化剂和氟化剂,分子结构与过氧化氢相似,性质极其不稳定,可以发生反应: 。下列有关说法错误的是( )
A. 离子半径:S2->O2->F- B. O2F2分子中氧显-1价
C. O2F2为极性分子 D. HF在标准状况下呈液态,主要原因是分子间存在氢键
12. NSR技术能降低柴油发动机在空气过量条件下NOx的排放,其工作原理如图所示。下列说法错误的是( )
A. 降低NOx排放可以减少酸雨的形成
B. 储存过程中NOx被氧化
C. 还原过程中消耗1molBa(NO3)2转移的电子数为5NA(NA为阿伏加德罗常数的值)
D. 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原
13.我国科研人员提出CeO2催化合成碳酸二甲酯(DMC)需经历三步反应,示意图如下。
下列说法不正确的是( )
A.反应①中催化剂的作用是使O—H键断裂活化
B.合成DMC的总反应为2CH3OH+CO2CH3OCOOCH3+H2O
C.①②③均为取代反应
D.1 mol DMC在碱性条件下完全水解,消耗2 mol NaOH
14. 一种微生物燃料电池如图所示,下列关于该电池说法正确的是 ( )
A. a电极正极,发生还原反应
B. H+由右室通过质子交换膜进入左室
C. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
D. b电极反应式为:2NO+10e-+12H+=N2↑+6H2O
15.向和的混合溶液中通入适量氯气,原溶液中各离子的物质的量变化知下图所示(和点横坐标为和)。下列说法正确的是( )
A.段表示物质的量的变化情况
B.原溶液中和的物质的量均为
C.段发生的离子反应为
D.反应不能发生
二、非选择题:本题共4小题,共55分。
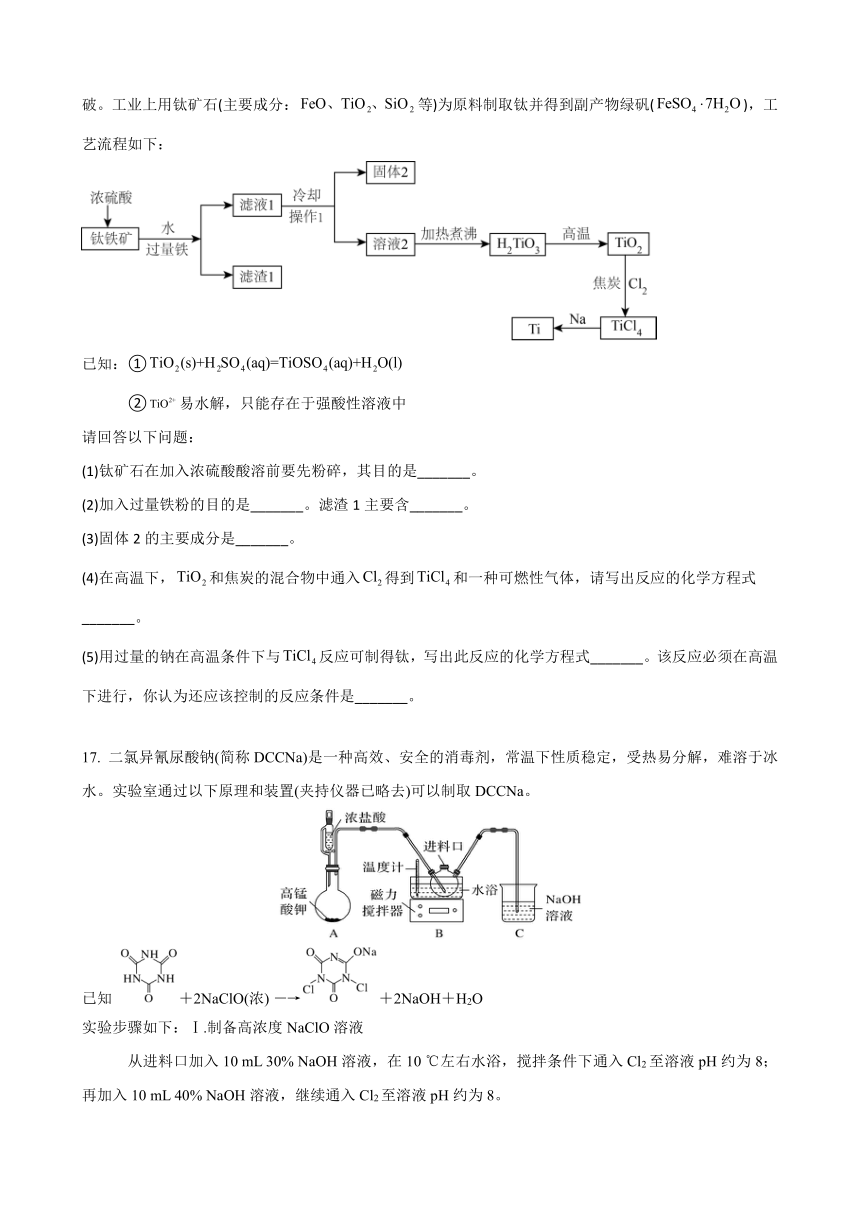
16.(13分)中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分:等)为原料制取钛并得到副产物绿矾(),工艺流程如下:
已知:①
②易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______。
(2)加入过量铁粉的目的是_______。滤渣1主要含_______。
(3)固体2的主要成分是_______。
(4)在高温下,和焦炭的混合物中通入得到和一种可燃性气体,请写出反应的化学方程式_______。
(5)用过量的钠在高温条件下与反应可制得钛,写出此反应的化学方程式_______。该反应必须在高温下进行,你认为还应该控制的反应条件是_______。
二氯异氰尿酸钠(简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冰水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。
已知 +2NaClO(浓) ―→+2NaOH+H2O
实验步骤如下:Ⅰ.制备高浓度NaClO溶液
从进料口加入10 mL 30% NaOH溶液,在10 ℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10 mL 40% NaOH溶液,继续通入Cl2至溶液pH约为8。
(1)用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是________(写名称)。
(2)装置A中发生反应的化学方程式为_________________。
(3)水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为___________。
(4)通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是________(写一种)。
Ⅱ.制备二氯异氰尿酸钠
待步骤Ⅰ结束后,从进料口加入氰尿酸,在搅拌状态下继续通入Cl2,在10 ℃左右下反应30 min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
(5)为了使晶体充分析出并分离,需要的操作为________、________洗涤、干燥。
(6)继续通入Cl2的目的是____________________________________。
Ⅲ.二氯异氰尿酸钠有效氯含量测定
称取0.100 0 g样品,用100 mL蒸馏水于碘量瓶中溶解后,依次加入20 mL 0.3 mol·L-1醋酸溶液和过量的KI溶液。用0.100 0 mol·L-1 Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00 mL。
(已知:+CH3COOH+2H2O―→+2HClO+CH3COONa,I2+2Na2S2O3===Na2S4O6+2NaI)
(7)滴定终点的现象为_____________________________________。
(8)样品有效氯=______。(样品有效氯=×100%)
18. 麻黄是一味常见的中草药,可治疗中风、伤寒头痛、温疟等。麻黄的有效成分麻黄碱(物质F),有多种合成方法,合成方法之一如图所示,请回答相关问题。
已知:同一个碳上接两个双键的分子不稳定
(1)麻黄碱中含氧官能团名称是_______, B的系统命名法为_______。
(2)D→E的反应类型是_______。
(3)C在加热条件下与足量NaOH醇溶液反应的化学方程式是_______。
(4)麻黄碱的同分异构体中满足下列条件的有_______种(不考虑立体异构)。
①苯环上有三个取代基,其中一个是;②遇到溶液显紫色。
其中核磁共振氢谱有6个峰且三个取代基均不处于相邻位置的结构简式是_______。
(5)设计由乙醇和制备苯甲酸的合成路线(无机试剂任选)_______。
19.(14分)Ⅰ、把转化为是降碳并生产化工原料的常用方法,有关反应如下:
①
②
③
(1)则 的 _______
Ⅱ、甲烷是一种绿色可再生能源,在高效催化剂的作用下,可与反应,消除NO2的污染,改善雾霾天气,发生的反应为:
(2)在恒温恒容条件下,下列不能说明该反应达到平衡状态的是_______(填序号)。
a.
b.混合气体的密度不再变化
c.混合气体的平均摩尔质量不再变化
d.单位时间内有健断裂的同时有键形成
e.混合气体的压强不变
(3)如表是相同时间内处理的量与温度的关系,的处理量先增大后减小的原因是___________________。
温度/℃ 100 200 300 400 500
的处理量/% 39.3 70.4 85.6 75.7 50.5
(4)一定条件下,向2L恒容密闭容器中通入、发生上述反应。测得反应过程中的体积分数在不同条件X下随着时间的变化如图1中曲线Ⅰ、曲线Ⅱ所示:
①若X表示温度,a、b、c三点对应的混合气体的平均相对分子质量的大小为_______(用a、b、c表示)
②条件下,曲线Ⅰ对应的反应的平衡常数_______,(用分数表示)
(5)欲研究在某催化剂作用下,上述反应的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图2所示,A、B两点对应温度下正反应速率变化的原因可能是_______。
Ⅲ、利用电池(工作原理如下图所示)能有效地将转化成化工原料草酸铝
已知:电池的正极反应式:(草酸根)正极反应过程中,起催化作用,催化过程可表示为:① ②……
(6)写出反应②的离子方程式___________________。
黄冈市重点中学2022-2023学年高三上学期期中考试
化学答案
一、选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C B D D C B D B C D B C C D D
二、非选择题
16(13分,未标明的每空2分) (1)增大接触面积,加速固体溶解
(2) 将全部还原为 SiO2 , Fe (3)
(4)
(5) 隔绝空气(或在惰性环境中进行) (1分)
17 (14分,未标明的每空2分)(1)容量瓶、泥三角 (1分)
(2)2KMnO4+16HCl(浓)2MnCl2+2KCl+5Cl2↑+8H2O
(3)3Cl2+6OH-===ClO+5Cl-+3H2O
(4)在装置A与B之间连接盛有饱和食盐水的洗气瓶(1分)
(5)冰水冷却 过滤 (各1分)
(6)与氢氧化钠反应,生成NaClO,使NaClO处于较高浓度
(7)溶液由蓝色褪为无色,且30 s不恢复 (8)56.8%
18.(14分,未标明的每空2分) (1) 羟基 (1分) 2-溴丙醛
(2)取代反应
(3)CH3CHBrCHBrOCH3 + 2NaOH CH3CCOCH3 + 2NaBr + 2H2O
(4) 40
(5)CH2CH2OHCH2=CH2CH3CH2Br (3分)
19.(14分,每空2分) (1)-31.4 (2)ace
(3)低于300℃时,反应未达到平衡状态,温度升高,反应速率加快,NO2的处理量逐渐增大,300℃时,反应达到平衡状态,高于300℃时,平衡逆向移动,NO2的处理量逐渐减小
(4) b(5)温度过高,影响了催化剂的活性
(6)
化学
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Na 23 S 32 Cl 35.5
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关,下列说法错误的是( )
A.可用作食品添加剂 B. NaHCO3可用作食品膨松剂
C.高纯二氧化硅可用于制作光感电池 D.漂粉精可用于游泳池的消毒
2. 2022年10月酱油食品添加剂“双标”事件备受关注,山梨酸是常用的食品防腐剂,其结构简式如图所示,下列有关山梨酸的叙述错误的是 ( )
A. 既能发生取代反应,又能发生加成反应 B. 分子中所有碳原子可能同一平面上
C. 与互为同分异构体 D. 1mol该物质与足量Na反应生成3gH2
3. 下列化学用语表示正确的是 ( )
A. 乙醇的结构简式:C2H6O B. 氯化氢的电子式:
C. CH4分子的球棍模型: D. HClO的结构式:H-O-Cl
4. 能正确表示下列反应的离子方程式为 ( )
A. 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O=2HClO+
B. NaHCO3的水解:HCO+H2O = CO+H3O+
C. 向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓
D. 将等物质的量浓度的Ba(OH)2和NH4HSO4溶液等体积混合:
Ba2++2OH-+H++NH+SO= BaSO4↓+H2O+NH3·H2O
5.今年十一假期的人文考古游成为热点,很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值,下列说法正确的是( )
A. 宣纸是合成高分子材料
B.兽首玛瑙杯主要成分为硅酸盐
C.三星堆青铜面具属于合金材料
D. 《梦溪笔谈》中记载:“方家以磁石磨针锋,则能指南。”磁石的主要成分是Fe2O3
6.下列操作与现象、结论均正确的是 ( )
选项 操作与现象 结论
A 向FeSO4溶液中加入少量的Na2O2粉末,产生红褐色沉淀 硫酸亚铁已变质
B 在乙醇中加入一小块钠,钠沉入底部并观察到气泡产生 钠的密度大于乙醇的密度,且生成的气体为氢气
C 向NaHCO3溶液中加入CaCl2溶液,产生白色沉淀 用CaCl2溶液可鉴别KHCO3溶液和(NH4)2CO3溶液
D 向Cu(NO3)2溶液中加入含淀粉的KI溶液,溶液变蓝色,并生成白色沉淀 白色沉淀是CuI2
7.短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子半径最小,W与Y同主族,X原子最外层电子数是其次外层电子数的3倍。火山喷口附近有Z的单质存在,四种元素形成的一种化合物Q的结构如图所示。下列说法错误的是( )
A.原子半径:
B.Z的最高价氧化物对应的水化物是强酸
C.W与Y形成的化合物属于离子化合物
D.Z的简单气态氢化物比X的简单气态氢化物稳定
8.与石墨结构相似的六方氮化硼(BN)晶体在高温高压下可以转化为立方氮化硼(BN),立方氮化硼的结构与金刚石相似,硬度与金刚石相当。下列关于该物质的分析中正确的是( )
A.六方氮化硼转化为立方氮化硼是物理变化
B.立方氮化硼(BN)结构中有配位键
C.和键相比,键的键长更长
D.六方氮化硼比晶体硅的熔点更高,硬度更大
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1.8g重水(D2O)中所含质子数为NA
B.分子中含有的键数目为
A.中含有0.1NA个阳离子
D.和于密闭容器中充分反应后,分子总数为
10、下列有关实验操作或仪器的使用正确的是( )
11.二氟化二氧(O2F2)是一种极强的氧化剂和氟化剂,分子结构与过氧化氢相似,性质极其不稳定,可以发生反应: 。下列有关说法错误的是( )
A. 离子半径:S2->O2->F- B. O2F2分子中氧显-1价
C. O2F2为极性分子 D. HF在标准状况下呈液态,主要原因是分子间存在氢键
12. NSR技术能降低柴油发动机在空气过量条件下NOx的排放,其工作原理如图所示。下列说法错误的是( )
A. 降低NOx排放可以减少酸雨的形成
B. 储存过程中NOx被氧化
C. 还原过程中消耗1molBa(NO3)2转移的电子数为5NA(NA为阿伏加德罗常数的值)
D. 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原
13.我国科研人员提出CeO2催化合成碳酸二甲酯(DMC)需经历三步反应,示意图如下。
下列说法不正确的是( )
A.反应①中催化剂的作用是使O—H键断裂活化
B.合成DMC的总反应为2CH3OH+CO2CH3OCOOCH3+H2O
C.①②③均为取代反应
D.1 mol DMC在碱性条件下完全水解,消耗2 mol NaOH
14. 一种微生物燃料电池如图所示,下列关于该电池说法正确的是 ( )
A. a电极正极,发生还原反应
B. H+由右室通过质子交换膜进入左室
C. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
D. b电极反应式为:2NO+10e-+12H+=N2↑+6H2O
15.向和的混合溶液中通入适量氯气,原溶液中各离子的物质的量变化知下图所示(和点横坐标为和)。下列说法正确的是( )
A.段表示物质的量的变化情况
B.原溶液中和的物质的量均为
C.段发生的离子反应为
D.反应不能发生
二、非选择题:本题共4小题,共55分。
16.(13分)中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分:等)为原料制取钛并得到副产物绿矾(),工艺流程如下:
已知:①
②易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______。
(2)加入过量铁粉的目的是_______。滤渣1主要含_______。
(3)固体2的主要成分是_______。
(4)在高温下,和焦炭的混合物中通入得到和一种可燃性气体,请写出反应的化学方程式_______。
(5)用过量的钠在高温条件下与反应可制得钛,写出此反应的化学方程式_______。该反应必须在高温下进行,你认为还应该控制的反应条件是_______。
二氯异氰尿酸钠(简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冰水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。
已知 +2NaClO(浓) ―→+2NaOH+H2O
实验步骤如下:Ⅰ.制备高浓度NaClO溶液
从进料口加入10 mL 30% NaOH溶液,在10 ℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10 mL 40% NaOH溶液,继续通入Cl2至溶液pH约为8。
(1)用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是________(写名称)。
(2)装置A中发生反应的化学方程式为_________________。
(3)水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为___________。
(4)通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是________(写一种)。
Ⅱ.制备二氯异氰尿酸钠
待步骤Ⅰ结束后,从进料口加入氰尿酸,在搅拌状态下继续通入Cl2,在10 ℃左右下反应30 min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
(5)为了使晶体充分析出并分离,需要的操作为________、________洗涤、干燥。
(6)继续通入Cl2的目的是____________________________________。
Ⅲ.二氯异氰尿酸钠有效氯含量测定
称取0.100 0 g样品,用100 mL蒸馏水于碘量瓶中溶解后,依次加入20 mL 0.3 mol·L-1醋酸溶液和过量的KI溶液。用0.100 0 mol·L-1 Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00 mL。
(已知:+CH3COOH+2H2O―→+2HClO+CH3COONa,I2+2Na2S2O3===Na2S4O6+2NaI)
(7)滴定终点的现象为_____________________________________。
(8)样品有效氯=______。(样品有效氯=×100%)
18. 麻黄是一味常见的中草药,可治疗中风、伤寒头痛、温疟等。麻黄的有效成分麻黄碱(物质F),有多种合成方法,合成方法之一如图所示,请回答相关问题。
已知:同一个碳上接两个双键的分子不稳定
(1)麻黄碱中含氧官能团名称是_______, B的系统命名法为_______。
(2)D→E的反应类型是_______。
(3)C在加热条件下与足量NaOH醇溶液反应的化学方程式是_______。
(4)麻黄碱的同分异构体中满足下列条件的有_______种(不考虑立体异构)。
①苯环上有三个取代基,其中一个是;②遇到溶液显紫色。
其中核磁共振氢谱有6个峰且三个取代基均不处于相邻位置的结构简式是_______。
(5)设计由乙醇和制备苯甲酸的合成路线(无机试剂任选)_______。
19.(14分)Ⅰ、把转化为是降碳并生产化工原料的常用方法,有关反应如下:
①
②
③
(1)则 的 _______
Ⅱ、甲烷是一种绿色可再生能源,在高效催化剂的作用下,可与反应,消除NO2的污染,改善雾霾天气,发生的反应为:
(2)在恒温恒容条件下,下列不能说明该反应达到平衡状态的是_______(填序号)。
a.
b.混合气体的密度不再变化
c.混合气体的平均摩尔质量不再变化
d.单位时间内有健断裂的同时有键形成
e.混合气体的压强不变
(3)如表是相同时间内处理的量与温度的关系,的处理量先增大后减小的原因是___________________。
温度/℃ 100 200 300 400 500
的处理量/% 39.3 70.4 85.6 75.7 50.5
(4)一定条件下,向2L恒容密闭容器中通入、发生上述反应。测得反应过程中的体积分数在不同条件X下随着时间的变化如图1中曲线Ⅰ、曲线Ⅱ所示:
①若X表示温度,a、b、c三点对应的混合气体的平均相对分子质量的大小为_______(用a、b、c表示)
②条件下,曲线Ⅰ对应的反应的平衡常数_______,(用分数表示)
(5)欲研究在某催化剂作用下,上述反应的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图2所示,A、B两点对应温度下正反应速率变化的原因可能是_______。
Ⅲ、利用电池(工作原理如下图所示)能有效地将转化成化工原料草酸铝
已知:电池的正极反应式:(草酸根)正极反应过程中,起催化作用,催化过程可表示为:① ②……
(6)写出反应②的离子方程式___________________。
黄冈市重点中学2022-2023学年高三上学期期中考试
化学答案
一、选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C B D D C B D B C D B C C D D
二、非选择题
16(13分,未标明的每空2分) (1)增大接触面积,加速固体溶解
(2) 将全部还原为 SiO2 , Fe (3)
(4)
(5) 隔绝空气(或在惰性环境中进行) (1分)
17 (14分,未标明的每空2分)(1)容量瓶、泥三角 (1分)
(2)2KMnO4+16HCl(浓)2MnCl2+2KCl+5Cl2↑+8H2O
(3)3Cl2+6OH-===ClO+5Cl-+3H2O
(4)在装置A与B之间连接盛有饱和食盐水的洗气瓶(1分)
(5)冰水冷却 过滤 (各1分)
(6)与氢氧化钠反应,生成NaClO,使NaClO处于较高浓度
(7)溶液由蓝色褪为无色,且30 s不恢复 (8)56.8%
18.(14分,未标明的每空2分) (1) 羟基 (1分) 2-溴丙醛
(2)取代反应
(3)CH3CHBrCHBrOCH3 + 2NaOH CH3CCOCH3 + 2NaBr + 2H2O
(4) 40
(5)CH2CH2OHCH2=CH2CH3CH2Br (3分)
19.(14分,每空2分) (1)-31.4 (2)ace
(3)低于300℃时,反应未达到平衡状态,温度升高,反应速率加快,NO2的处理量逐渐增大,300℃时,反应达到平衡状态,高于300℃时,平衡逆向移动,NO2的处理量逐渐减小
(4) b
(6)
同课章节目录
