物质的推断、鉴别、分离、提纯必备知识点
图片预览

文档简介
物质的推断、鉴别、分离、提纯必备知识点
一、物质的特征
(1)有色固体
黑色:黑色单质C、Fe粉、 黑色化合物CuO、Fe3O4、MnO2
红色:Cu(紫红色)、Fe2O3(红棕色)
蓝色沉淀:Cu(OH)2 ;红褐色沉淀:Fe(OH)3
KMnO4(暗紫色或紫黑色)、红磷(暗红色)
(2)有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)
(3)无色气体:N2、CO2、CO、O2、H2、CH4
(4)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
二、化学之最
地壳中含量最多的金属元素是铝;最常见的金属是铁;
密度最小的气体是氢气;相对分子质量最小的氧化物是水;
最常见的有机物是甲烷CH4…………
三、物质的用途
1、常用的调味品:NaCl; 2、发酵粉的主要成分:NaHCO3
1、用于人工降雨的物质:干冰。 2、调味用的食盐:氯化钠。
3、用做面食吃的纯碱:碳酸钠。 4、常用于金属除锈的物质:盐酸、稀硫酸。
5、改良酸性土壤的物质:熟石灰。 6、工业上常用于洗涤的盐:碳酸钠。
7、配制农药波耳多液:熟石灰和硫酸铜。 8、人体中的胃酸:盐酸。
9、“钡餐”透视用的盐:硫酸钡。
10、用做钻探机头:金刚石;用做铅笔芯:石墨。
四、物质的特殊性质
1、在空气中能自燃的固体是白磷;
2、能使带火星的木条复燃的是氧气;
3、溶于水显碱性;且能使湿润的红色石蕊试纸变蓝色的气体是氨气;
4、在氧气中剧烈燃烧,火星四射,生成黑色固体物质的是铁丝;
5、油状液体,具有吸水性并能使纸张、木材变成黑色物质的是浓硫酸。
6、能使人发生煤气中毒的气体是一氧化碳。
7、有刺激性气味的大气污染物之一是二氧化硫。
8、具有挥发性的酸:盐酸、硝酸。
9、使人食物中毒的盐:亚硝酸钠(误认作食盐);
10、能与黑色氧化铜反应生成红色铜的物质,是具有还原性的氢气、碳、一氧化碳。
11、能与碱反应,产生有刺激性气味且能使湿润的红色石蕊试纸变蓝的气体(氨气)的盐是铵盐。
12、在空气中放置质量增加并且会变质的物质有氢氧化钠、氢氧化钙,氧化钙。
13、在空气中放置质量增加但不会变质的物质有浓硫酸。
五、物质的热效应
1、能与水反应放热的物质:氧化钙;
2、溶于水放热的物质:浓硫酸、氢氧化钠;
3、溶于水吸热的物质:硝酸铵。
4、干冰的升华(人工降雨)
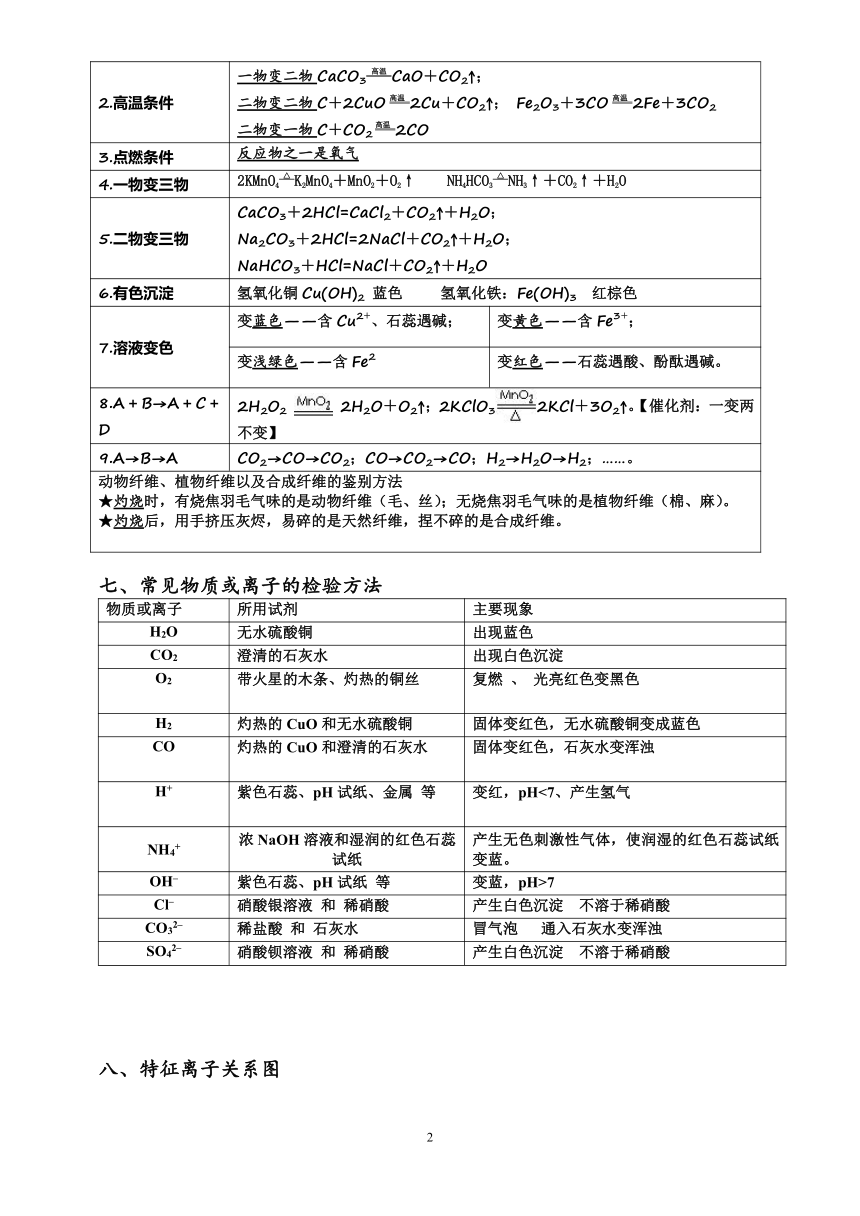
六、、推断题的题眼
1.通电条件 电解水【2H2O 通电 2H2↑+O2↑】
2.高温条件 一物变二物CaCO3 高温 CaO+CO2↑;二物变二物C+2CuO高温 2Cu+CO2↑; Fe2O3+3CO高温 2Fe+3CO2二物变一物C+CO2高温 2CO
3.点燃条件 反应物之一是氧气
4.一物变三物 2KMnO4 △ K2MnO4+MnO2+O2↑ NH4HCO3 △ NH3↑+CO2↑+H2O
5.二物变三物 CaCO3+2HCl=CaCl2+CO2↑+H2O; Na2CO3+2HCl=2NaCl+CO2↑+H2O;NaHCO3+HCl=NaCl+CO2↑+H2O
6.有色沉淀 氢氧化铜Cu(OH)2 蓝色 氢氧化铁:Fe(OH)3 红棕色
7.溶液变色 变蓝色——含Cu2+、石蕊遇碱; 变黄色——含Fe3+;
变浅绿色——含Fe2 变红色——石蕊遇酸、酚酞遇碱。
8.A+B→A+C+D 2H2O2 2H2O+O2↑;2KClO32KCl+3O2↑。【催化剂:一变两不变】
9.A→B→A CO2→CO→CO2;CO→CO2→CO;H2→H2O→H2;……。
动物纤维、植物纤维以及合成纤维的鉴别方法★灼烧时,有烧焦羽毛气味的是动物纤维(毛、丝);无烧焦羽毛气味的是植物纤维(棉、麻)。★灼烧后,用手挤压灰烬,易碎的是天然纤维,捏不碎的是合成纤维。
七、常见物质或离子的检验方法
物质或离子 所用试剂 主要现象
H2O 无水硫酸铜 出现蓝色
CO2 澄清的石灰水 出现白色沉淀
O2 带火星的木条、灼热的铜丝 复燃 、 光亮红色变黑色
H2 灼热的CuO和无水硫酸铜 固体变红色,无水硫酸铜变成蓝色
CO 灼热的CuO和澄清的石灰水 固体变红色,石灰水变浑浊
H+ 紫色石蕊、pH试纸、金属 等 变红,pH<7、产生氢气
NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生无色刺激性气体,使润湿的红色石蕊试纸变蓝。
OH– 紫色石蕊、pH试纸 等 变蓝,pH>7
Cl– 硝酸银溶液 和 稀硝酸 产生白色沉淀 不溶于稀硝酸
CO32– 稀盐酸 和 石灰水 冒气泡 通入石灰水变浑浊
SO42– 硝酸钡溶液 和 稀硝酸 产生白色沉淀 不溶于稀硝酸
八、特征离子关系图
九、离子共存问题
分析:混在一起会发生化学反应的离子不能共存。
归纳与小结:
(1)H+ 不能与 、 、 共存;(2)Cl- 不能与 共存;
(3)CO32-不能与 、 、 、 共存;
(4)OH--不能与 、 、 、 、 共存;
(5)Ba2+ 不能与 共存; (6) Ca2+不能与 共存;
(7) SO42-不能与 共存; (8)Ag +不能与 共存;
(10)Fe3+ 不能与 共存; (11)Cu2+不能与 共存;
溶液中离子颜色Cu2+ Fe3+ Fe2+ MnO4 -
注意题干暗示条件:pH >7 意为 性溶液,含有大量的
pH <7 意为 性溶液,含有大量的
十、气体净化的几种方法
⑴吸收法:用吸收剂将杂质气体吸收除去。如,除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。
常见气体吸收剂见下表:
吸收剂 吸收的气体杂质 吸收剂 吸收的气体杂质
水 可溶性气体:HCl、NH3等 NaOH固体 CO2、HCl、H20
无水CuSO4 H2O 碱石灰 CO2、HCl、H20
灼热的铜网 O2 NaOH溶液 CO2、HCl
灼热的CuO H2、CO 浓硫酸 H20
⑵转化法:通过化学反应,将杂质气体转化为所要得到的气体。如,除去CO2中的少量CO,可将混合气体通过足量的灼热CuO,CO + CuO Cu + CO2。
十一、气体的干燥
气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂状态决定。
⑴常见的干燥剂
干燥剂 可干燥气体 不可干燥气体 干燥装置
名称或化学式 酸碱性 状态
浓H2SO4 酸性 液态 H2、N2、O2、CO2、HCl、CH4、CO等 NH3 A
固体NaOH生石灰CaO 碱性 固态 H2、O2、N2、CH4、CO、NH3等 CO2、SO2、HCl B或C
无水CaCl2 中性 固态 除NH3外所有气体 NH3 B或C
⑵常用干燥装置如下:
注意:选择吸收装置时,要注意进、出气体导管的连接方法,若用“洗气瓶”,要注意“长进短出”,若用干燥管要注意“大进小出”。先除去气体中含有的其他杂质,干燥除去水蒸气的操作放在最后。
十二、物质的分离和提纯
分离和提纯的主要方法
方法 适用范围或原理 举例
物理方法 过滤法 ①固体与液体混合物的分离②可溶性固体与不溶性固体混合物的分离 粗盐的提纯
结晶法 蒸发 ①分离溶质与溶剂②除去易挥发的杂质 从含有HCl的NaCl溶液中分离出固体NaCl
降低温度 可溶性固体溶质溶解度受温度影响变化大小不同 分离NaCl与KNO3的混合物
化学方法 化气法 与杂质反应生成气体而除去 除Na2SO4中Na2CO3,可加适量稀H2SO4:Na2CO3+ H2SO4=Na2SO4+ CO2↑+ H2O
沉淀法 将杂质转化为沉淀过滤除去 除去NaCl中的Na2SO4,可加适量的BaCl2:Na2SO4+ BaCl2==BaSO4↓+2NaCl
置换法 将杂质通过置换反应而除去 除Fe SO4中的Cu SO4,可加过量的铁粉,再过滤:CuSO4+Fe==Cu+Fe SO4
溶解法 将杂质溶于某种试剂而除去 除C粉中的CuO粉,可加适量稀硫酸,再过滤:CuO+ H2SO4==CuSO4+ H2O
加热法 杂质受热易分解,通过加热将杂质除去 除CaO中的CaCO3可加热:CaCO3CaO+ CO2↑
转化法 将杂质通过化学反应转化为主要成分 除CO2中的CO,可将气体通过灼热的CuO:CO+CuOCu+CO2
PAGE
2
一、物质的特征
(1)有色固体
黑色:黑色单质C、Fe粉、 黑色化合物CuO、Fe3O4、MnO2
红色:Cu(紫红色)、Fe2O3(红棕色)
蓝色沉淀:Cu(OH)2 ;红褐色沉淀:Fe(OH)3
KMnO4(暗紫色或紫黑色)、红磷(暗红色)
(2)有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)
(3)无色气体:N2、CO2、CO、O2、H2、CH4
(4)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
二、化学之最
地壳中含量最多的金属元素是铝;最常见的金属是铁;
密度最小的气体是氢气;相对分子质量最小的氧化物是水;
最常见的有机物是甲烷CH4…………
三、物质的用途
1、常用的调味品:NaCl; 2、发酵粉的主要成分:NaHCO3
1、用于人工降雨的物质:干冰。 2、调味用的食盐:氯化钠。
3、用做面食吃的纯碱:碳酸钠。 4、常用于金属除锈的物质:盐酸、稀硫酸。
5、改良酸性土壤的物质:熟石灰。 6、工业上常用于洗涤的盐:碳酸钠。
7、配制农药波耳多液:熟石灰和硫酸铜。 8、人体中的胃酸:盐酸。
9、“钡餐”透视用的盐:硫酸钡。
10、用做钻探机头:金刚石;用做铅笔芯:石墨。
四、物质的特殊性质
1、在空气中能自燃的固体是白磷;
2、能使带火星的木条复燃的是氧气;
3、溶于水显碱性;且能使湿润的红色石蕊试纸变蓝色的气体是氨气;
4、在氧气中剧烈燃烧,火星四射,生成黑色固体物质的是铁丝;
5、油状液体,具有吸水性并能使纸张、木材变成黑色物质的是浓硫酸。
6、能使人发生煤气中毒的气体是一氧化碳。
7、有刺激性气味的大气污染物之一是二氧化硫。
8、具有挥发性的酸:盐酸、硝酸。
9、使人食物中毒的盐:亚硝酸钠(误认作食盐);
10、能与黑色氧化铜反应生成红色铜的物质,是具有还原性的氢气、碳、一氧化碳。
11、能与碱反应,产生有刺激性气味且能使湿润的红色石蕊试纸变蓝的气体(氨气)的盐是铵盐。
12、在空气中放置质量增加并且会变质的物质有氢氧化钠、氢氧化钙,氧化钙。
13、在空气中放置质量增加但不会变质的物质有浓硫酸。
五、物质的热效应
1、能与水反应放热的物质:氧化钙;
2、溶于水放热的物质:浓硫酸、氢氧化钠;
3、溶于水吸热的物质:硝酸铵。
4、干冰的升华(人工降雨)
六、、推断题的题眼
1.通电条件 电解水【2H2O 通电 2H2↑+O2↑】
2.高温条件 一物变二物CaCO3 高温 CaO+CO2↑;二物变二物C+2CuO高温 2Cu+CO2↑; Fe2O3+3CO高温 2Fe+3CO2二物变一物C+CO2高温 2CO
3.点燃条件 反应物之一是氧气
4.一物变三物 2KMnO4 △ K2MnO4+MnO2+O2↑ NH4HCO3 △ NH3↑+CO2↑+H2O
5.二物变三物 CaCO3+2HCl=CaCl2+CO2↑+H2O; Na2CO3+2HCl=2NaCl+CO2↑+H2O;NaHCO3+HCl=NaCl+CO2↑+H2O
6.有色沉淀 氢氧化铜Cu(OH)2 蓝色 氢氧化铁:Fe(OH)3 红棕色
7.溶液变色 变蓝色——含Cu2+、石蕊遇碱; 变黄色——含Fe3+;
变浅绿色——含Fe2 变红色——石蕊遇酸、酚酞遇碱。
8.A+B→A+C+D 2H2O2 2H2O+O2↑;2KClO32KCl+3O2↑。【催化剂:一变两不变】
9.A→B→A CO2→CO→CO2;CO→CO2→CO;H2→H2O→H2;……。
动物纤维、植物纤维以及合成纤维的鉴别方法★灼烧时,有烧焦羽毛气味的是动物纤维(毛、丝);无烧焦羽毛气味的是植物纤维(棉、麻)。★灼烧后,用手挤压灰烬,易碎的是天然纤维,捏不碎的是合成纤维。
七、常见物质或离子的检验方法
物质或离子 所用试剂 主要现象
H2O 无水硫酸铜 出现蓝色
CO2 澄清的石灰水 出现白色沉淀
O2 带火星的木条、灼热的铜丝 复燃 、 光亮红色变黑色
H2 灼热的CuO和无水硫酸铜 固体变红色,无水硫酸铜变成蓝色
CO 灼热的CuO和澄清的石灰水 固体变红色,石灰水变浑浊
H+ 紫色石蕊、pH试纸、金属 等 变红,pH<7、产生氢气
NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生无色刺激性气体,使润湿的红色石蕊试纸变蓝。
OH– 紫色石蕊、pH试纸 等 变蓝,pH>7
Cl– 硝酸银溶液 和 稀硝酸 产生白色沉淀 不溶于稀硝酸
CO32– 稀盐酸 和 石灰水 冒气泡 通入石灰水变浑浊
SO42– 硝酸钡溶液 和 稀硝酸 产生白色沉淀 不溶于稀硝酸
八、特征离子关系图
九、离子共存问题
分析:混在一起会发生化学反应的离子不能共存。
归纳与小结:
(1)H+ 不能与 、 、 共存;(2)Cl- 不能与 共存;
(3)CO32-不能与 、 、 、 共存;
(4)OH--不能与 、 、 、 、 共存;
(5)Ba2+ 不能与 共存; (6) Ca2+不能与 共存;
(7) SO42-不能与 共存; (8)Ag +不能与 共存;
(10)Fe3+ 不能与 共存; (11)Cu2+不能与 共存;
溶液中离子颜色Cu2+ Fe3+ Fe2+ MnO4 -
注意题干暗示条件:pH >7 意为 性溶液,含有大量的
pH <7 意为 性溶液,含有大量的
十、气体净化的几种方法
⑴吸收法:用吸收剂将杂质气体吸收除去。如,除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。
常见气体吸收剂见下表:
吸收剂 吸收的气体杂质 吸收剂 吸收的气体杂质
水 可溶性气体:HCl、NH3等 NaOH固体 CO2、HCl、H20
无水CuSO4 H2O 碱石灰 CO2、HCl、H20
灼热的铜网 O2 NaOH溶液 CO2、HCl
灼热的CuO H2、CO 浓硫酸 H20
⑵转化法:通过化学反应,将杂质气体转化为所要得到的气体。如,除去CO2中的少量CO,可将混合气体通过足量的灼热CuO,CO + CuO Cu + CO2。
十一、气体的干燥
气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂状态决定。
⑴常见的干燥剂
干燥剂 可干燥气体 不可干燥气体 干燥装置
名称或化学式 酸碱性 状态
浓H2SO4 酸性 液态 H2、N2、O2、CO2、HCl、CH4、CO等 NH3 A
固体NaOH生石灰CaO 碱性 固态 H2、O2、N2、CH4、CO、NH3等 CO2、SO2、HCl B或C
无水CaCl2 中性 固态 除NH3外所有气体 NH3 B或C
⑵常用干燥装置如下:
注意:选择吸收装置时,要注意进、出气体导管的连接方法,若用“洗气瓶”,要注意“长进短出”,若用干燥管要注意“大进小出”。先除去气体中含有的其他杂质,干燥除去水蒸气的操作放在最后。
十二、物质的分离和提纯
分离和提纯的主要方法
方法 适用范围或原理 举例
物理方法 过滤法 ①固体与液体混合物的分离②可溶性固体与不溶性固体混合物的分离 粗盐的提纯
结晶法 蒸发 ①分离溶质与溶剂②除去易挥发的杂质 从含有HCl的NaCl溶液中分离出固体NaCl
降低温度 可溶性固体溶质溶解度受温度影响变化大小不同 分离NaCl与KNO3的混合物
化学方法 化气法 与杂质反应生成气体而除去 除Na2SO4中Na2CO3,可加适量稀H2SO4:Na2CO3+ H2SO4=Na2SO4+ CO2↑+ H2O
沉淀法 将杂质转化为沉淀过滤除去 除去NaCl中的Na2SO4,可加适量的BaCl2:Na2SO4+ BaCl2==BaSO4↓+2NaCl
置换法 将杂质通过置换反应而除去 除Fe SO4中的Cu SO4,可加过量的铁粉,再过滤:CuSO4+Fe==Cu+Fe SO4
溶解法 将杂质溶于某种试剂而除去 除C粉中的CuO粉,可加适量稀硫酸,再过滤:CuO+ H2SO4==CuSO4+ H2O
加热法 杂质受热易分解,通过加热将杂质除去 除CaO中的CaCO3可加热:CaCO3CaO+ CO2↑
转化法 将杂质通过化学反应转化为主要成分 除CO2中的CO,可将气体通过灼热的CuO:CO+CuOCu+CO2
PAGE
2
