化学人教版(2019)必修第一册2.3.3物质的量浓度(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.3物质的量浓度(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-29 17:16:10 | ||
图片预览







文档简介
(共24张PPT)
第三节
物质的量
第二章 海水中的重要元素——钠和氯
第3课时 物质的量浓度
01 物质的量浓度
02 一定物质的量浓度
的溶液配制
03 自主练习
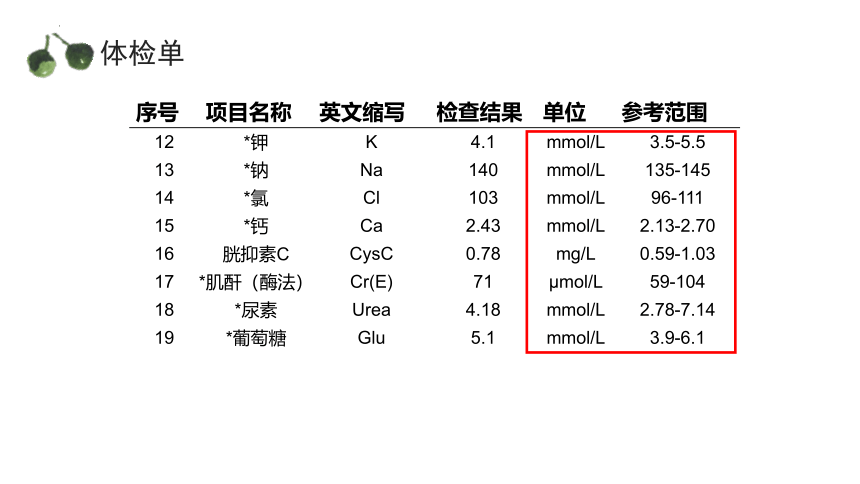
体检单
物质的量
序号 项目名称 英文缩写 检查结果 单位 参考范围
12 *钾 K 4.1 mmol/L 3.5-5.5
13 *钠 Na 140 mmol/L 135-145
14 *氯 Cl 103 mmol/L 96-111
15 *钙 Ca 2.43 mmol/L 2.13-2.70
16 胱抑素C CysC 0.78 mg/L 0.59-1.03
17 *肌酐(酶法) Cr(E) 71 μmol/L 59-104
18 *尿素 Urea 4.18 mmol/L 2.78-7.14
19 *葡萄糖 Glu 5.1 mmol/L 3.9-6.1
01
物质的量浓度
物质的量浓度
定义:单位体积的溶液里所含溶质B的物质的量称为溶质B的物质的量浓度,符号为cB。
表达式:
单位:mol/L(或mol·L-1)
意义:1 mol/L NaCl溶液表示1 L NaCl溶液中含有1 mol NaCl。
学以致用
(1)10 g NaCl溶于100 g水中,所得溶液的溶质质量分数为10%。 ( )
(2)1 mol Na2CO3溶于1 L水中,所得溶液的物质的量浓度为1 mol/L。 ( )
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。 ( )
(4)0.5 L 0.5 mol/L的NaCl溶液中溶质的物质的量为0.25 mol。 ( )
×
×
×
√
学以致用
(5)1 mol NaCl溶于1 L水所得溶液中溶质的物质的量浓度是1 mol·L-1 ( )
(6)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液中溶质的物质的量浓度为0.1 mol·L-1 ( )
(7)把1 mol NH3通入水中得到1 L溶液,所得溶液中溶质的物质的量浓度为1 mol·L-1 ( )
(8)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1 ( )
×
×
×
√
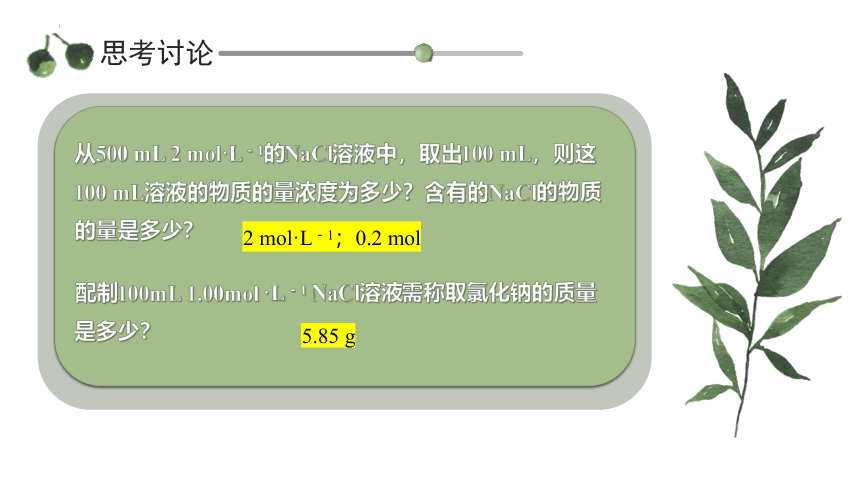
思考讨论
从500 mL 2 mol·L-1的NaCl溶液中,取出100 mL,则这100 mL溶液的物质的量浓度为多少?含有的NaCl的物质的量是多少?
2 mol·L-1;0.2 mol
配制100mL 1.00mol ·L-1 NaCl溶液需称取氯化钠的质量是多少?
5.85 g
02
配制一定物质的量浓度的溶液
1.设计方案
设计配制溶液的简单步骤
[方案一]称量5.85gNaCl固体,放入100mL烧杯,加蒸馏水到刻度线,充分搅拌。
[方案二]称量5.85gNaCl固体,加入100mL蒸馏水,充分搅拌。
1.仪器
一定物质的量浓度的溶液配制
托盘天平
量筒
烧杯 玻璃棒
容量瓶
胶头滴管
1.结构与规格
容量瓶
(1)结构:细颈、梨形、平底玻璃容器,带磨口玻璃塞
(2)标志:温度、容量和刻度线
(3)规格:100mL、250mL、1000mL等
(4)用途:配制一定物质的量浓度的溶液
2.容量瓶的选择与使用
容量瓶
①容量瓶是配制物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
②使用前要检验容量瓶是否漏水。检验程序:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
③使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
一定物质的量浓度的溶液配制
3.误差分析
一定物质的量浓度的溶液配制
根据可知,MB为定值(溶质的摩尔质量),实验过程中不规范的操作会导致mB或V的值发生变化,从而使所配制溶液的物质的量浓度产生误差。若实验操作导致mB偏大,则cB偏大;若实验操作导致V偏大,则cB偏小。
容量瓶定容时仰视、俯视对结果的影响
一定物质的量浓度的溶液配制
能引起误差的一些操作 m V c
托盘天平 天平的砝码沾有其他物质或已生锈 增大 不变 偏大
药品、砝码左右位置颠倒,且使用了游码 减小 不变 偏小
称量易潮解的物质(如NaOH)时间过长 减小 不变 偏小
量筒 用量筒量取液体时,仰视读数 增大 不变 偏大
用量筒量取液体时,俯视读数 减小 不变 偏小
烧杯和玻璃棒 搅拌时部分液体溅出 减小 不变 偏小
未洗烧杯和玻璃棒 减小 不变 偏小
容量瓶 未冷却到室温就注入容量瓶定容 不变 减小 偏大
向容量瓶转移溶液时有少量液体流出 减小 不变 偏小
定容时,水加多了,用滴管吸出 减小 不变 偏小
定容时,俯视读刻度数 不变 减小 偏大
定容时,仰视读刻度数 不变 增大 偏小
思考讨论
在实验室中不仅用固体物质来配制溶液,还经常要将浓溶液稀释成不同浓度的稀溶液。若将50mL 0.2 mol·L-1
Na2SO4溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为_____ mol·L-1,S的物质的量浓度为____ mol·L-1。
c(浓)·V(浓)=c(稀)·V(稀)
0.1
0.2
04
自主练习
1.下列溶液中溶质的物质的量浓度为1 mol·L-1的是( )
A.将20 g NaOH固体溶解在500 mL水中
B.将10 g NaOH固体溶解在水中配成250 mL溶液
C.将1 L 10 mol·L-1的浓盐酸与9 L水混合
D.将标准状况下22.4 L HCl气体溶于1 L水中配成溶液(已知HCl极易溶于水,0 ℃时,1体积水能溶解500体积的HCl)
B
2.下列溶液中氯离子浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是( )
A.150 mL 1 mol·L-1的NaCl溶液
B.75 mL 2 mol·L-1的NH4Cl溶液
C.150 mL 3 mol·L-1的KCl溶液
D.75 mL 2 mol·L-1的FeCl3溶液
C
3. 如图是某校化学实验室中硫酸试剂标签上的部分内容。据此下列说法错误的是( )
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.100 mL该硫酸的质量是184 g
C.硫酸的摩尔质量与磷酸(H3PO4)的摩尔质量相同
D.取该硫酸62.5 mL稀释至250 mL,得到稀硫酸的浓度为4.6 mol·L-1
A
4. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
A.称量 B.溶解 C.转移溶液 D.定容
B
5. 现需要配制500 mL 1 mol·L-1硫酸溶液,
(1)需用质量分数为98%、密度为1.84 g·cm-3的浓硫酸_____mL。
(2)容量瓶使用前检验漏水的方法是___________________________
_________________________________________________________
_________________________________________________________
____________________________。
(3)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响
27.2
好瓶塞,用左手食指顶住瓶塞,用右手的五指托住瓶底,把瓶倒
往容量瓶中加入适量的水,塞
立过来,如不漏水,将其放正,把瓶塞旋转180°后塞紧,再把瓶
倒立过来,若不漏水,才能使用
①稀释的硫酸转移到容量瓶中后未洗涤烧杯。
②趁热将溶液注入容量瓶中并定容。
③摇匀后发现液面低于刻度线于是又加水。
④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面。
偏小
偏小
偏大
偏大
不变
第三节
物质的量
第二章 海水中的重要元素——钠和氯
第3课时 物质的量浓度
01 物质的量浓度
02 一定物质的量浓度
的溶液配制
03 自主练习
体检单
物质的量
序号 项目名称 英文缩写 检查结果 单位 参考范围
12 *钾 K 4.1 mmol/L 3.5-5.5
13 *钠 Na 140 mmol/L 135-145
14 *氯 Cl 103 mmol/L 96-111
15 *钙 Ca 2.43 mmol/L 2.13-2.70
16 胱抑素C CysC 0.78 mg/L 0.59-1.03
17 *肌酐(酶法) Cr(E) 71 μmol/L 59-104
18 *尿素 Urea 4.18 mmol/L 2.78-7.14
19 *葡萄糖 Glu 5.1 mmol/L 3.9-6.1
01
物质的量浓度
物质的量浓度
定义:单位体积的溶液里所含溶质B的物质的量称为溶质B的物质的量浓度,符号为cB。
表达式:
单位:mol/L(或mol·L-1)
意义:1 mol/L NaCl溶液表示1 L NaCl溶液中含有1 mol NaCl。
学以致用
(1)10 g NaCl溶于100 g水中,所得溶液的溶质质量分数为10%。 ( )
(2)1 mol Na2CO3溶于1 L水中,所得溶液的物质的量浓度为1 mol/L。 ( )
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。 ( )
(4)0.5 L 0.5 mol/L的NaCl溶液中溶质的物质的量为0.25 mol。 ( )
×
×
×
√
学以致用
(5)1 mol NaCl溶于1 L水所得溶液中溶质的物质的量浓度是1 mol·L-1 ( )
(6)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液中溶质的物质的量浓度为0.1 mol·L-1 ( )
(7)把1 mol NH3通入水中得到1 L溶液,所得溶液中溶质的物质的量浓度为1 mol·L-1 ( )
(8)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1 ( )
×
×
×
√
思考讨论
从500 mL 2 mol·L-1的NaCl溶液中,取出100 mL,则这100 mL溶液的物质的量浓度为多少?含有的NaCl的物质的量是多少?
2 mol·L-1;0.2 mol
配制100mL 1.00mol ·L-1 NaCl溶液需称取氯化钠的质量是多少?
5.85 g
02
配制一定物质的量浓度的溶液
1.设计方案
设计配制溶液的简单步骤
[方案一]称量5.85gNaCl固体,放入100mL烧杯,加蒸馏水到刻度线,充分搅拌。
[方案二]称量5.85gNaCl固体,加入100mL蒸馏水,充分搅拌。
1.仪器
一定物质的量浓度的溶液配制
托盘天平
量筒
烧杯 玻璃棒
容量瓶
胶头滴管
1.结构与规格
容量瓶
(1)结构:细颈、梨形、平底玻璃容器,带磨口玻璃塞
(2)标志:温度、容量和刻度线
(3)规格:100mL、250mL、1000mL等
(4)用途:配制一定物质的量浓度的溶液
2.容量瓶的选择与使用
容量瓶
①容量瓶是配制物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
②使用前要检验容量瓶是否漏水。检验程序:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
③使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
一定物质的量浓度的溶液配制
3.误差分析
一定物质的量浓度的溶液配制
根据可知,MB为定值(溶质的摩尔质量),实验过程中不规范的操作会导致mB或V的值发生变化,从而使所配制溶液的物质的量浓度产生误差。若实验操作导致mB偏大,则cB偏大;若实验操作导致V偏大,则cB偏小。
容量瓶定容时仰视、俯视对结果的影响
一定物质的量浓度的溶液配制
能引起误差的一些操作 m V c
托盘天平 天平的砝码沾有其他物质或已生锈 增大 不变 偏大
药品、砝码左右位置颠倒,且使用了游码 减小 不变 偏小
称量易潮解的物质(如NaOH)时间过长 减小 不变 偏小
量筒 用量筒量取液体时,仰视读数 增大 不变 偏大
用量筒量取液体时,俯视读数 减小 不变 偏小
烧杯和玻璃棒 搅拌时部分液体溅出 减小 不变 偏小
未洗烧杯和玻璃棒 减小 不变 偏小
容量瓶 未冷却到室温就注入容量瓶定容 不变 减小 偏大
向容量瓶转移溶液时有少量液体流出 减小 不变 偏小
定容时,水加多了,用滴管吸出 减小 不变 偏小
定容时,俯视读刻度数 不变 减小 偏大
定容时,仰视读刻度数 不变 增大 偏小
思考讨论
在实验室中不仅用固体物质来配制溶液,还经常要将浓溶液稀释成不同浓度的稀溶液。若将50mL 0.2 mol·L-1
Na2SO4溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为_____ mol·L-1,S的物质的量浓度为____ mol·L-1。
c(浓)·V(浓)=c(稀)·V(稀)
0.1
0.2
04
自主练习
1.下列溶液中溶质的物质的量浓度为1 mol·L-1的是( )
A.将20 g NaOH固体溶解在500 mL水中
B.将10 g NaOH固体溶解在水中配成250 mL溶液
C.将1 L 10 mol·L-1的浓盐酸与9 L水混合
D.将标准状况下22.4 L HCl气体溶于1 L水中配成溶液(已知HCl极易溶于水,0 ℃时,1体积水能溶解500体积的HCl)
B
2.下列溶液中氯离子浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是( )
A.150 mL 1 mol·L-1的NaCl溶液
B.75 mL 2 mol·L-1的NH4Cl溶液
C.150 mL 3 mol·L-1的KCl溶液
D.75 mL 2 mol·L-1的FeCl3溶液
C
3. 如图是某校化学实验室中硫酸试剂标签上的部分内容。据此下列说法错误的是( )
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.100 mL该硫酸的质量是184 g
C.硫酸的摩尔质量与磷酸(H3PO4)的摩尔质量相同
D.取该硫酸62.5 mL稀释至250 mL,得到稀硫酸的浓度为4.6 mol·L-1
A
4. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
A.称量 B.溶解 C.转移溶液 D.定容
B
5. 现需要配制500 mL 1 mol·L-1硫酸溶液,
(1)需用质量分数为98%、密度为1.84 g·cm-3的浓硫酸_____mL。
(2)容量瓶使用前检验漏水的方法是___________________________
_________________________________________________________
_________________________________________________________
____________________________。
(3)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响
27.2
好瓶塞,用左手食指顶住瓶塞,用右手的五指托住瓶底,把瓶倒
往容量瓶中加入适量的水,塞
立过来,如不漏水,将其放正,把瓶塞旋转180°后塞紧,再把瓶
倒立过来,若不漏水,才能使用
①稀释的硫酸转移到容量瓶中后未洗涤烧杯。
②趁热将溶液注入容量瓶中并定容。
③摇匀后发现液面低于刻度线于是又加水。
④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面。
偏小
偏小
偏大
偏大
不变
