化学人教版(2019)必修第一册2.1.1 钠的性质 (共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1 钠的性质 (共25张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-29 17:17:49 | ||
图片预览








文档简介
(共25张PPT)
物理性质包括哪些呢?
色、态、味、密度、硬度、溶解度、熔沸点等。
在研究一种陌生物质的时候,我们通常先从它的哪种性质切入?
物理性质、化学性质、用途、制法
如何预测物质的性质
根据价态
根据物质的组成
5月30日12时56分,位于大东区建设南二路24号百隆生物有限公司厂房发生火灾。救援中一名消防战士受伤,无其他人员伤亡。200公斤金属钠遇雨爆炸燃烧 8个消防中队参与扑救
当日,沈阳市公安消防支队沈北大队接到报警后,沈阳市公安消防支队指挥中心立即调派8个中队、22台消防车、130名官兵到达现场参加扑救,经查勘,发现为已停产十个月的厂房内存放的200公斤金属钠遇雨水后爆炸燃烧。13时40分许,在爆炸现场记者看到,距离爆炸点数百米远处就能看到滚滚白烟,厂区门前的蒲裕路上聚集着数十辆消防救援车。
Na
预测金属钠的活泼性质
从价态看
与氧化剂反应
①与氧气反应
②与硫、氯气反应
从组成看
1、与酸反应
2、与盐反应
液体是煤油
金属钠比煤油重
钠保存在煤油中
取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,注意观察表面的颜色以及表面颜色的变化。
【实验探究1】
金属钠银白色
金属钠在空气中表面变暗,生成氧化膜
4Na + O2 2Na2O
(白色)
钠的物理性质
导热性
导电性
熔点
硬度
密度
状态
颜色
良好
良好
熔点低
质软 可用刀切割
小 ρ煤油<ρ钠(0.97g/cm3)<ρ水<ρCCl4
固态
银白色金属光泽
银白色,有金属光泽的固体.是热和电的良导体.质软,密度小,熔点低
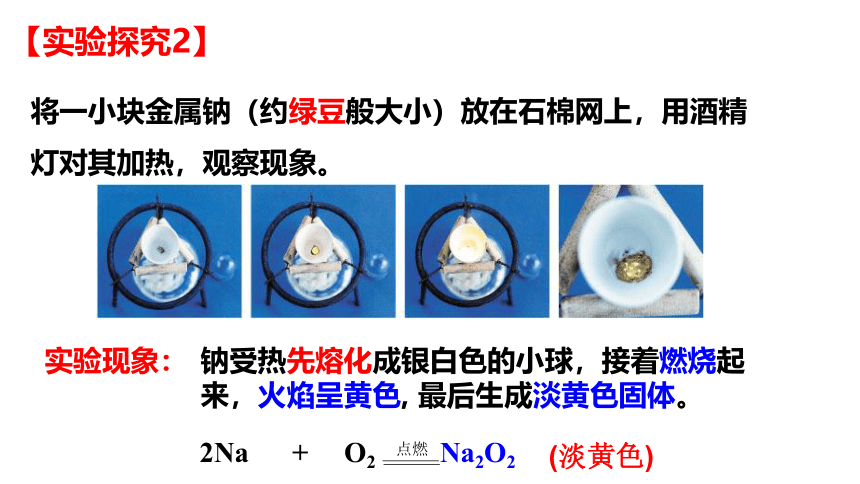
将一小块金属钠(约绿豆般大小)放在石棉网上,用酒精灯对其加热,观察现象。
钠受热先熔化成银白色的小球,接着燃烧起来,火焰呈黄色, 最后生成淡黄色固体。
实验现象:
2Na + O2 Na2O2
(淡黄色)
点燃
【实验探究2】
4Na + O2 2Na2O
2Na + O2 Na2O2
(2)钠在空气中燃烧
注意:反应物相同,反应条件不同,产物不同!
即:2Na2O +O2 == 2Na2O2
点燃
(1)空气中易被氧化
1、钠与氧气反应:
不稳定
稳定
(白色)
(淡黄色)
钠的化学性质
钠与其他非金属的反应
2 Na + S = Na2S(研磨易爆炸)
2 Na + Cl2 = 2 NaCl(产生大量白烟)
点燃
探究实验——当钠遇到水
[ 实验步骤 ]
1、用镊子取一小块钠置于滤纸上,吸干表面的煤油,用小刀切绿豆大的一粒,其余放回原瓶。
2、在烧杯中加一半水,在水中滴入几滴酚酞,将切下的钠粒投入烧杯中,盖上玻片,观察实验现象。
钠与水的反应
1
2
4
3
浮
熔
游
响
红
原 因
现 象
小于水的密度,0.97g/cm3
反应放热 ,熔点低,97.81℃
有气体产生
有气体产生且剧烈
有碱生成
①钠 浮 在水面上
②钠 熔 成一个闪亮的小球
③小球四处 游 动
④发出“嘶嘶”的 响 声
⑤加入酚酞,溶液变 红
浮
游
熔
响
红
实验现象:
预测生成的是何种碱和气体 预测的依据是什么
Na + H2O --- +
钠与水反应生成氢氧化钠和氢气
2Na + 2H2O ==2NaOH + H2↑
2Na + 2H2O ==2Na+ + 2OH- +H2↑
*化学方程式
* 离子方程式
实验证明:
钠是一种强还原剂,具有强还原性。
上述反应中钠元素化合价如何变化?钠在反应中体现什么性质?
【问题探究】
例:2Na + 2H2O == 2NaOH + H2
失2×e-
得2×e-
0
+1
0
+1
还原剂 氧化剂
考一考
1.钠为什么要保存在煤油中?能不能保存在汽油或者四氯化碳中?
2.为什么取用钠时要用镊子呢?
3.在取用钠时,多余的钠能否放回煤油中呢?
4、金属钠着火如何灭火?能不能用水?
汽油和四氯化碳都易挥发,容易使钠暴露在空气中
钠容易与手表面的水发生反应,放出大量的热,发生危险
可以
用沙子,不能用水
Na与酸的反应
2Na + 2HCl == 2NaCl + H2
思维拓展1:
离子方程式为:
2Na + 2H+ = 2Na+ + H2↑
小结:钠与水或酸反应的实质是与其电离出来的H+ 反应。
(比水更剧烈)
思考:钠与酸反应的现象如何?
我国在西汉时期,就掌握了湿法炼铜技术,其原理就是用铁与硫酸铜反应置换出铜。活泼金属能够把不活泼从它们的盐溶液中置换出来。
金属钠与硫酸铜溶液结果会如何呢?请你预测,并简要说明理由。
思维拓展2:
钠溶解放出 无色无味的气体,有蓝色沉淀生成
解释:
CuSO4溶液:因为硫酸铜溶液里的每个Cu2+都是被若干个水分子包围着的,钠在CuSO4溶液里面直接 接触到的微粒是水分子,这样钠先和水反应,生成的NaOH再和CuSO4反应。
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
蓝色絮状深沉
总反应式:
2Na + 2H2O + CuSO4 = Cu(OH)2↓ + Na2SO4 + H2↑
结论:
钠先与水反应,其生成物在与盐反应,因此不能置换出盐中的金属。
钠与水溶液反应的一般规律:
有酸酸为先,无酸水为先。
钠与FeCl3溶液反应生成什么?
练一练
2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe (OH)3↓+ 3NaCl
红褐色沉淀
6Na + 6H2O + 2FeCl3 = 2Fe (OH)3↓+ 6NaCl + 3H2↑
总反应式:
5.与熔融态盐的置换反应
钠是一种还原性强的金属,高温下可与某些盐发生置换反应、冶炼金属。
4Na+TiCl4===4NaCl+Ti
高温
C
将一小块钠投入盛饱和澄清石灰水的试管里,不可能观察到的现象是( )
A.熔成小球并在液面上游动
B.有气体生成
C.溶液底部有银白色物质生成
D.溶液变浑浊
小 结
一、钠的物理性质
二、钠的化学性质
1、与非金属反应
①与氧气反应
②与硫、氯气反应
2、与水反应
3、与酸反应
4、与盐反应
D
物理性质包括哪些呢?
色、态、味、密度、硬度、溶解度、熔沸点等。
在研究一种陌生物质的时候,我们通常先从它的哪种性质切入?
物理性质、化学性质、用途、制法
如何预测物质的性质
根据价态
根据物质的组成
5月30日12时56分,位于大东区建设南二路24号百隆生物有限公司厂房发生火灾。救援中一名消防战士受伤,无其他人员伤亡。200公斤金属钠遇雨爆炸燃烧 8个消防中队参与扑救
当日,沈阳市公安消防支队沈北大队接到报警后,沈阳市公安消防支队指挥中心立即调派8个中队、22台消防车、130名官兵到达现场参加扑救,经查勘,发现为已停产十个月的厂房内存放的200公斤金属钠遇雨水后爆炸燃烧。13时40分许,在爆炸现场记者看到,距离爆炸点数百米远处就能看到滚滚白烟,厂区门前的蒲裕路上聚集着数十辆消防救援车。
Na
预测金属钠的活泼性质
从价态看
与氧化剂反应
①与氧气反应
②与硫、氯气反应
从组成看
1、与酸反应
2、与盐反应
液体是煤油
金属钠比煤油重
钠保存在煤油中
取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,注意观察表面的颜色以及表面颜色的变化。
【实验探究1】
金属钠银白色
金属钠在空气中表面变暗,生成氧化膜
4Na + O2 2Na2O
(白色)
钠的物理性质
导热性
导电性
熔点
硬度
密度
状态
颜色
良好
良好
熔点低
质软 可用刀切割
小 ρ煤油<ρ钠(0.97g/cm3)<ρ水<ρCCl4
固态
银白色金属光泽
银白色,有金属光泽的固体.是热和电的良导体.质软,密度小,熔点低
将一小块金属钠(约绿豆般大小)放在石棉网上,用酒精灯对其加热,观察现象。
钠受热先熔化成银白色的小球,接着燃烧起来,火焰呈黄色, 最后生成淡黄色固体。
实验现象:
2Na + O2 Na2O2
(淡黄色)
点燃
【实验探究2】
4Na + O2 2Na2O
2Na + O2 Na2O2
(2)钠在空气中燃烧
注意:反应物相同,反应条件不同,产物不同!
即:2Na2O +O2 == 2Na2O2
点燃
(1)空气中易被氧化
1、钠与氧气反应:
不稳定
稳定
(白色)
(淡黄色)
钠的化学性质
钠与其他非金属的反应
2 Na + S = Na2S(研磨易爆炸)
2 Na + Cl2 = 2 NaCl(产生大量白烟)
点燃
探究实验——当钠遇到水
[ 实验步骤 ]
1、用镊子取一小块钠置于滤纸上,吸干表面的煤油,用小刀切绿豆大的一粒,其余放回原瓶。
2、在烧杯中加一半水,在水中滴入几滴酚酞,将切下的钠粒投入烧杯中,盖上玻片,观察实验现象。
钠与水的反应
1
2
4
3
浮
熔
游
响
红
原 因
现 象
小于水的密度,0.97g/cm3
反应放热 ,熔点低,97.81℃
有气体产生
有气体产生且剧烈
有碱生成
①钠 浮 在水面上
②钠 熔 成一个闪亮的小球
③小球四处 游 动
④发出“嘶嘶”的 响 声
⑤加入酚酞,溶液变 红
浮
游
熔
响
红
实验现象:
预测生成的是何种碱和气体 预测的依据是什么
Na + H2O --- +
钠与水反应生成氢氧化钠和氢气
2Na + 2H2O ==2NaOH + H2↑
2Na + 2H2O ==2Na+ + 2OH- +H2↑
*化学方程式
* 离子方程式
实验证明:
钠是一种强还原剂,具有强还原性。
上述反应中钠元素化合价如何变化?钠在反应中体现什么性质?
【问题探究】
例:2Na + 2H2O == 2NaOH + H2
失2×e-
得2×e-
0
+1
0
+1
还原剂 氧化剂
考一考
1.钠为什么要保存在煤油中?能不能保存在汽油或者四氯化碳中?
2.为什么取用钠时要用镊子呢?
3.在取用钠时,多余的钠能否放回煤油中呢?
4、金属钠着火如何灭火?能不能用水?
汽油和四氯化碳都易挥发,容易使钠暴露在空气中
钠容易与手表面的水发生反应,放出大量的热,发生危险
可以
用沙子,不能用水
Na与酸的反应
2Na + 2HCl == 2NaCl + H2
思维拓展1:
离子方程式为:
2Na + 2H+ = 2Na+ + H2↑
小结:钠与水或酸反应的实质是与其电离出来的H+ 反应。
(比水更剧烈)
思考:钠与酸反应的现象如何?
我国在西汉时期,就掌握了湿法炼铜技术,其原理就是用铁与硫酸铜反应置换出铜。活泼金属能够把不活泼从它们的盐溶液中置换出来。
金属钠与硫酸铜溶液结果会如何呢?请你预测,并简要说明理由。
思维拓展2:
钠溶解放出 无色无味的气体,有蓝色沉淀生成
解释:
CuSO4溶液:因为硫酸铜溶液里的每个Cu2+都是被若干个水分子包围着的,钠在CuSO4溶液里面直接 接触到的微粒是水分子,这样钠先和水反应,生成的NaOH再和CuSO4反应。
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
蓝色絮状深沉
总反应式:
2Na + 2H2O + CuSO4 = Cu(OH)2↓ + Na2SO4 + H2↑
结论:
钠先与水反应,其生成物在与盐反应,因此不能置换出盐中的金属。
钠与水溶液反应的一般规律:
有酸酸为先,无酸水为先。
钠与FeCl3溶液反应生成什么?
练一练
2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe (OH)3↓+ 3NaCl
红褐色沉淀
6Na + 6H2O + 2FeCl3 = 2Fe (OH)3↓+ 6NaCl + 3H2↑
总反应式:
5.与熔融态盐的置换反应
钠是一种还原性强的金属,高温下可与某些盐发生置换反应、冶炼金属。
4Na+TiCl4===4NaCl+Ti
高温
C
将一小块钠投入盛饱和澄清石灰水的试管里,不可能观察到的现象是( )
A.熔成小球并在液面上游动
B.有气体生成
C.溶液底部有银白色物质生成
D.溶液变浑浊
小 结
一、钠的物理性质
二、钠的化学性质
1、与非金属反应
①与氧气反应
②与硫、氯气反应
2、与水反应
3、与酸反应
4、与盐反应
D
