【中学教材全解】2013-2014学年高中化学必修一 专题4 第二单元 生产生活中的含氮化合物 同步练测 (苏教版,含答案解析)
文档属性
| 名称 | 【中学教材全解】2013-2014学年高中化学必修一 专题4 第二单元 生产生活中的含氮化合物 同步练测 (苏教版,含答案解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 70.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-11-21 21:45:04 | ||
图片预览

文档简介
专题4 第二单元 生产生活中的含氮化合物
建议用时
实际用时
满分
实际得分
45分钟
100分
一、选择题(每小题5分,共50分)
1.下列现象的产生与人为排放污染物——氮氧化物无关的是( )
A.闪电 B.光化学烟雾
C.酸雨 D.臭氧层空洞
2.下列关于氨的性质的叙述中,正确的是( )
A.氨气可用排水法收集
B.氨水呈碱性
C.氨气和酸相遇都能产生白烟
D.在反应NH3+H+NH中,氨失电子被氧化
3.下列关于铵盐的叙述中不正确的是( )
①铵盐中氮元素的化合价为-3
②铵盐都能溶于水,铵盐中只含有非金属元素而不可能含有金属元素
③铵盐都不稳定,受热分解都产生氨气
④铵盐都是离子化合物,都能与强碱反应
A.②③④ B.①②④
C.①②③ D.①③
4.将盛满NO2和O2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的一半,则剩余气体的成分是( )
A.NO或O2 B.NO
C.O2 D.NO2
5.在研究合成氨方法及其催化作用的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药的原料。下列说法正确的是( )
A.N2和H2在点燃或光照条件下可合成氨
B.氨是共价化合物,硝酸是离子化合物
C.氨气遇到浓硝酸会发生反应产生白烟
D.由氨制取硝酸过程中,氮元素被还原
6.实验室不需用棕色试剂瓶保存的试剂是( )
A.浓硝酸 B.硝酸银溶液
C.氯水 D.浓硫酸
7.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气
B.二氧化氮
C.二氧化氮和氧气
D.二氧化氮和一氧化氮
8.FeS2与HNO3反应后的氧化产物为Fe(NO3)3和H2SO4,若反应中FeS2与HNO3的物质的量之比为1∶8,则HNO3的还原产物为( )
A.NO2 B.NO C.N2O D.N2O3
9.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
10.铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL的NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
A.9.02 g B.8.51 g
C.8.26 g D.7.04 g
二、非选择题(共50分)
11.(18分)(1)氮元素有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成氮元素的含氧酸盐只有一种,则该含氧酸盐的化学式是________。写出该反应的化学方程式:______________________。
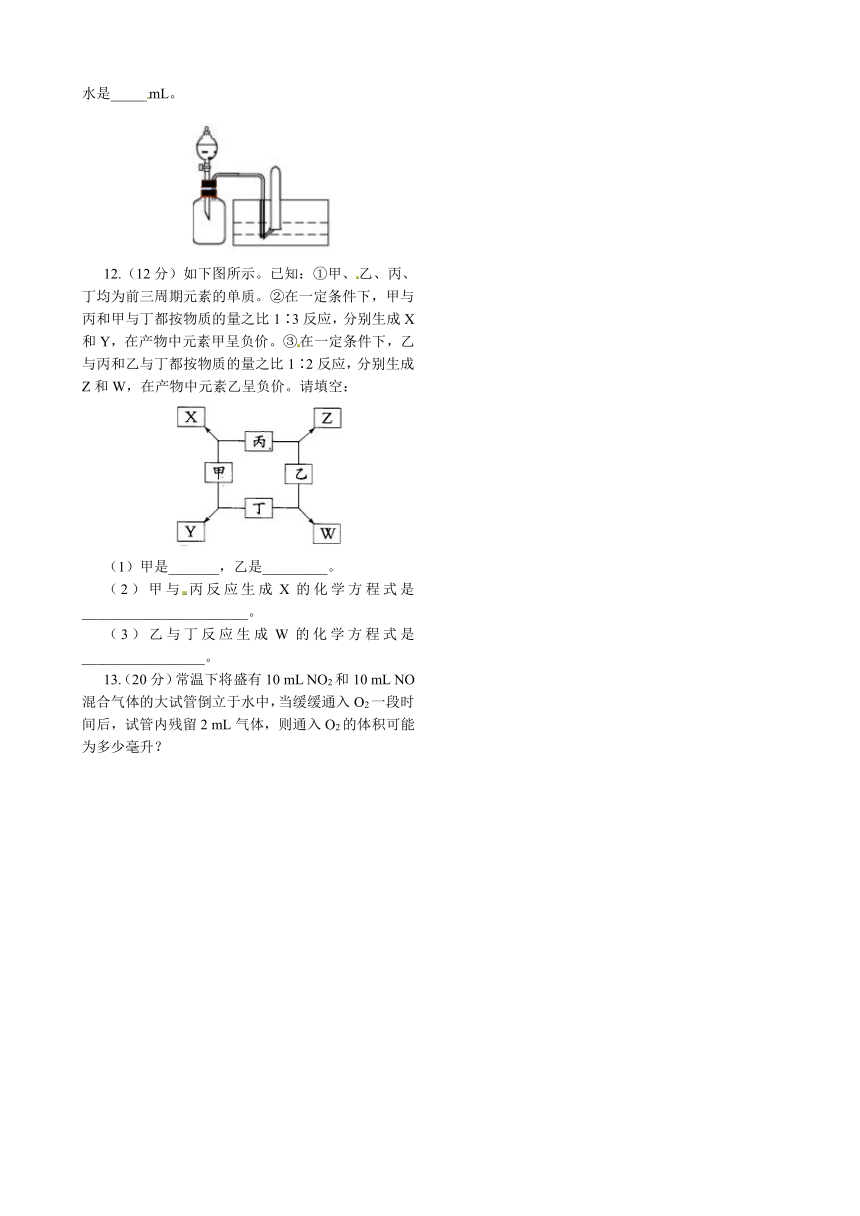
(2)在一只试剂瓶中盛满O2(如下图所示),试管中充满NO,现向试剂瓶内慢慢滴入水,试管中的物质充分反应。若滴入的水为35 mL时,试管先充满水而后又充满气体,则原试管中盛有的NO为____mL,若想使水充满试管,则应向试剂瓶中滴入的水是_____mL。
12.(12分)如下图所示。已知:①甲、乙、丙、丁均为前三周期元素的单质。②在一定条件下,甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价。③在一定条件下,乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。请填空:
(1)甲是_______,乙是_________。
(2)甲与丙反应生成X的化学方程式是_______________________。
(3)乙与丁反应生成W的化学方程式是_________________。
13.(20分)常温下将盛有10 mL NO2和10 mL NO 混合气体的大试管倒立于水中,当缓缓通入O2一段时间后,试管内残留2 mL气体,则通入O2的体积可能为多少毫升?
参考答案
1.A 2.B 3.C 解析: 在“NH”中氮元素显-3价,但若酸根部分也含有氮元素,则其化合价肯定不是-3,如NH4NO2、NH4NO3中NO、NO中的氮元素分别显+3价、+5价;铵盐都溶于水,大多数铵盐只含有非金属元素,但部分金属元素也能形成含氧酸进而形成铵盐,如(NH4)2Cr2O7等;铵盐都不稳定是对的,但受热分解并不都产生NH3,如NH4NO3N2O↑+2H2O;铵盐都是离子化合物,由NH和酸根阴离子构成,因而都能与强碱反应。
4.C 解析:设原混合气体体积为1 L,则剩余0.5 L气体。若剩余气体是NO,则反应后剩余1.5 L NO2,不正确;若剩余气体是O2,则V(NO2)=0.5 L×4/5=0.4 L,V(O2)=0.6 L,V(NO2)∶V(O2)=2∶3。
5.C 解析:HNO3是共价化合物,由NH3HNO3过程中氮元素被氧化。
6.D 7.C 8.B 解析:由FeS2+8HNO3Fe(NO3)3+H2SO4+…可知,1 mol FeS2失去(1+2×7)mol即15 mol e-,8 mol HNO3中有5 mol HNO3得到电子,那么每摩尔HNO3得到3 mol e-,还原产物为NO。
9.AC 解析:NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,A项错误;向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水分解出氨气,B项正确;加热固体制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,C项错误;对于D项,加热浓氨水制取NH3的方法和试剂都是正确的。
10.B 解析:此题如单纯用Cu、Mg分别与HNO3反应的结果求出合金的物质的量组成而求得沉淀的质量,那是相当繁琐的,如用整体思维,则沉淀的质量为金属Cu、Mg的质量加上OH-的质量,由电子守恒知:Cu、Mg的物质的量之和为n(Cu、Mg)×2=4.48 L÷22.4 L/mol+0.336 L÷22.4 L/mol×2,n(Cu、Mg)=0.115 mol,故沉淀的质量为4.6 g+(0.115 mol×2)×17 g/mol=8.51 g。
本题还可用平均值法计算。被还原的硝酸共0.23 mol(+5价N+4价N),4.6 g铜和镁的合金为0.115 mol,故合金的平均摩尔质量为4.6 g/0.115 mol=40 g/mol,氢氧化物的平均相对式量为40+17×2=74,故形成氢氧化物沉淀的质量为(4.6 g÷40 g/mol)×74 g/mol=8.51 g或0.115 mol×74 g/mol=8.51 g。
11.(1)NaNO2 4NO+O2+4NaOH4NaNO2+2H2O (2) 20 15
解析:(1)甲是NO,NO与O2按4∶1的物质的量之比恰好反应,1 mol O2得到4 mol e- ,则4 mol NO失去4 mol e- ,N元素的化合价升高1,含氧酸盐为NaNO2。(2)滴入的水为35 mL时,O2过量,且过量的O2与原NO的体积(即试管体积)相等。设原NO为x mL,则根据合并的方程式:4NO+3O2+2H2O4HNO3得,余下O2表示为35-3/4x=x,x=20,V(H2O)=3/4V(NO)=15 mL。
12.(1)N2 O2 (2)N2+3MgMg3N2(或N2+3H2 2NH3) (3)O2+2H22H2O(或O2+2Mg2MgO)
解析:甲、乙、丙、丁均为单质,由它们两两相互反应所得到的X、Y、Z、W都是二元化合物。条件②是解本题的突破口。甲和丁按1∶3物质的量之比反应生成Y,在Y中元素甲呈负价。由此可联想到所熟悉的合成氨的反应:N2+3H22NH3。可暂时先认为甲就是N2,丁是H2,甲和丙也按1∶3物质的量之比反应生成X,在X中元素甲呈负价,因此,可判断元素丙在X中呈正价,于是可以设想元素丙为金属元素。与N2按3∶1物质的量之比反应的金属,中学所学过的前三周期元素中,应当是金属镁。甲与丙反应生成X的化学方程式为N2+3MgMg3N2。由以上分析,可以认定甲是N2,丁是H2,丙是Mg;再考虑题给条件③,容易判断乙是O2。于是,乙与丁反应生成W的化学方程式是O2+2H22H2O。上述讨论中,若将丙和丁所代表的物质调换一下,仍可满足题意,故有两种可能正确的答案。
13.8.5 mL或12 mL
解析:残留的2 mL气体可能是NO也有可能是O2,应予以讨论。
(1)若残留气体是NO,则转化为HNO3的NO为10 mL-2 mL=8 mL,则:
4NO2 + O2+2H2O4HNO3
4 1
10 mL y
4/10 mL=1/y 解得∶y=2.5 mL
4NO+3O2+2H2O4HNO3
4 3
8 mL x
4/8 mL=3/x 解得:x=6 mL
共耗氧气V(O2)=2.5 mL+6 mL=8.5 mL。
(2)若残留的2 mL气体是O2,则:
4NO+3O2+2H2O4HNO3
4 3
10 mL z
4/10 mL=3/z,解得:z=7.5 mL
故V(O2)=2.5 mL+7.5 mL+2 mL=12 mL。
建议用时
实际用时
满分
实际得分
45分钟
100分
一、选择题(每小题5分,共50分)
1.下列现象的产生与人为排放污染物——氮氧化物无关的是( )
A.闪电 B.光化学烟雾
C.酸雨 D.臭氧层空洞
2.下列关于氨的性质的叙述中,正确的是( )
A.氨气可用排水法收集
B.氨水呈碱性
C.氨气和酸相遇都能产生白烟
D.在反应NH3+H+NH中,氨失电子被氧化
3.下列关于铵盐的叙述中不正确的是( )
①铵盐中氮元素的化合价为-3
②铵盐都能溶于水,铵盐中只含有非金属元素而不可能含有金属元素
③铵盐都不稳定,受热分解都产生氨气
④铵盐都是离子化合物,都能与强碱反应
A.②③④ B.①②④
C.①②③ D.①③
4.将盛满NO2和O2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体体积缩小为原体积的一半,则剩余气体的成分是( )
A.NO或O2 B.NO
C.O2 D.NO2
5.在研究合成氨方法及其催化作用的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药的原料。下列说法正确的是( )
A.N2和H2在点燃或光照条件下可合成氨
B.氨是共价化合物,硝酸是离子化合物
C.氨气遇到浓硝酸会发生反应产生白烟
D.由氨制取硝酸过程中,氮元素被还原
6.实验室不需用棕色试剂瓶保存的试剂是( )
A.浓硝酸 B.硝酸银溶液
C.氯水 D.浓硫酸
7.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气
B.二氧化氮
C.二氧化氮和氧气
D.二氧化氮和一氧化氮
8.FeS2与HNO3反应后的氧化产物为Fe(NO3)3和H2SO4,若反应中FeS2与HNO3的物质的量之比为1∶8,则HNO3的还原产物为( )
A.NO2 B.NO C.N2O D.N2O3
9.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
10.铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL的NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
A.9.02 g B.8.51 g
C.8.26 g D.7.04 g
二、非选择题(共50分)
11.(18分)(1)氮元素有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成氮元素的含氧酸盐只有一种,则该含氧酸盐的化学式是________。写出该反应的化学方程式:______________________。
(2)在一只试剂瓶中盛满O2(如下图所示),试管中充满NO,现向试剂瓶内慢慢滴入水,试管中的物质充分反应。若滴入的水为35 mL时,试管先充满水而后又充满气体,则原试管中盛有的NO为____mL,若想使水充满试管,则应向试剂瓶中滴入的水是_____mL。
12.(12分)如下图所示。已知:①甲、乙、丙、丁均为前三周期元素的单质。②在一定条件下,甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价。③在一定条件下,乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。请填空:
(1)甲是_______,乙是_________。
(2)甲与丙反应生成X的化学方程式是_______________________。
(3)乙与丁反应生成W的化学方程式是_________________。
13.(20分)常温下将盛有10 mL NO2和10 mL NO 混合气体的大试管倒立于水中,当缓缓通入O2一段时间后,试管内残留2 mL气体,则通入O2的体积可能为多少毫升?
参考答案
1.A 2.B 3.C 解析: 在“NH”中氮元素显-3价,但若酸根部分也含有氮元素,则其化合价肯定不是-3,如NH4NO2、NH4NO3中NO、NO中的氮元素分别显+3价、+5价;铵盐都溶于水,大多数铵盐只含有非金属元素,但部分金属元素也能形成含氧酸进而形成铵盐,如(NH4)2Cr2O7等;铵盐都不稳定是对的,但受热分解并不都产生NH3,如NH4NO3N2O↑+2H2O;铵盐都是离子化合物,由NH和酸根阴离子构成,因而都能与强碱反应。
4.C 解析:设原混合气体体积为1 L,则剩余0.5 L气体。若剩余气体是NO,则反应后剩余1.5 L NO2,不正确;若剩余气体是O2,则V(NO2)=0.5 L×4/5=0.4 L,V(O2)=0.6 L,V(NO2)∶V(O2)=2∶3。
5.C 解析:HNO3是共价化合物,由NH3HNO3过程中氮元素被氧化。
6.D 7.C 8.B 解析:由FeS2+8HNO3Fe(NO3)3+H2SO4+…可知,1 mol FeS2失去(1+2×7)mol即15 mol e-,8 mol HNO3中有5 mol HNO3得到电子,那么每摩尔HNO3得到3 mol e-,还原产物为NO。
9.AC 解析:NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,A项错误;向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水分解出氨气,B项正确;加热固体制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,C项错误;对于D项,加热浓氨水制取NH3的方法和试剂都是正确的。
10.B 解析:此题如单纯用Cu、Mg分别与HNO3反应的结果求出合金的物质的量组成而求得沉淀的质量,那是相当繁琐的,如用整体思维,则沉淀的质量为金属Cu、Mg的质量加上OH-的质量,由电子守恒知:Cu、Mg的物质的量之和为n(Cu、Mg)×2=4.48 L÷22.4 L/mol+0.336 L÷22.4 L/mol×2,n(Cu、Mg)=0.115 mol,故沉淀的质量为4.6 g+(0.115 mol×2)×17 g/mol=8.51 g。
本题还可用平均值法计算。被还原的硝酸共0.23 mol(+5价N+4价N),4.6 g铜和镁的合金为0.115 mol,故合金的平均摩尔质量为4.6 g/0.115 mol=40 g/mol,氢氧化物的平均相对式量为40+17×2=74,故形成氢氧化物沉淀的质量为(4.6 g÷40 g/mol)×74 g/mol=8.51 g或0.115 mol×74 g/mol=8.51 g。
11.(1)NaNO2 4NO+O2+4NaOH4NaNO2+2H2O (2) 20 15
解析:(1)甲是NO,NO与O2按4∶1的物质的量之比恰好反应,1 mol O2得到4 mol e- ,则4 mol NO失去4 mol e- ,N元素的化合价升高1,含氧酸盐为NaNO2。(2)滴入的水为35 mL时,O2过量,且过量的O2与原NO的体积(即试管体积)相等。设原NO为x mL,则根据合并的方程式:4NO+3O2+2H2O4HNO3得,余下O2表示为35-3/4x=x,x=20,V(H2O)=3/4V(NO)=15 mL。
12.(1)N2 O2 (2)N2+3MgMg3N2(或N2+3H2 2NH3) (3)O2+2H22H2O(或O2+2Mg2MgO)
解析:甲、乙、丙、丁均为单质,由它们两两相互反应所得到的X、Y、Z、W都是二元化合物。条件②是解本题的突破口。甲和丁按1∶3物质的量之比反应生成Y,在Y中元素甲呈负价。由此可联想到所熟悉的合成氨的反应:N2+3H22NH3。可暂时先认为甲就是N2,丁是H2,甲和丙也按1∶3物质的量之比反应生成X,在X中元素甲呈负价,因此,可判断元素丙在X中呈正价,于是可以设想元素丙为金属元素。与N2按3∶1物质的量之比反应的金属,中学所学过的前三周期元素中,应当是金属镁。甲与丙反应生成X的化学方程式为N2+3MgMg3N2。由以上分析,可以认定甲是N2,丁是H2,丙是Mg;再考虑题给条件③,容易判断乙是O2。于是,乙与丁反应生成W的化学方程式是O2+2H22H2O。上述讨论中,若将丙和丁所代表的物质调换一下,仍可满足题意,故有两种可能正确的答案。
13.8.5 mL或12 mL
解析:残留的2 mL气体可能是NO也有可能是O2,应予以讨论。
(1)若残留气体是NO,则转化为HNO3的NO为10 mL-2 mL=8 mL,则:
4NO2 + O2+2H2O4HNO3
4 1
10 mL y
4/10 mL=1/y 解得∶y=2.5 mL
4NO+3O2+2H2O4HNO3
4 3
8 mL x
4/8 mL=3/x 解得:x=6 mL
共耗氧气V(O2)=2.5 mL+6 mL=8.5 mL。
(2)若残留的2 mL气体是O2,则:
4NO+3O2+2H2O4HNO3
4 3
10 mL z
4/10 mL=3/z,解得:z=7.5 mL
故V(O2)=2.5 mL+7.5 mL+2 mL=12 mL。
