课题3利用化学方程式的简单计算
文档属性
| 名称 | 课题3利用化学方程式的简单计算 |  | |
| 格式 | zip | ||
| 文件大小 | 466.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-11-22 10:00:55 | ||
图片预览







文档简介
课件22张PPT。第五单元 化学方程式 课 题 3
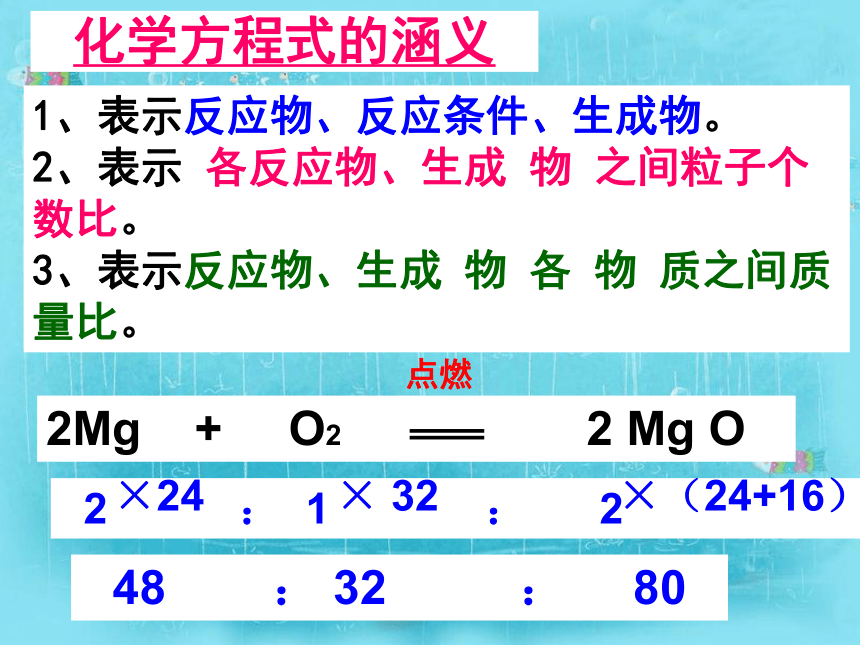
利用化学方程式的简单计算 2 : 1 : 2 48 : 32 : 801、表示反应物、反应条件、生成物。
2、表示 各反应物、生成 物 之间粒子个数比。
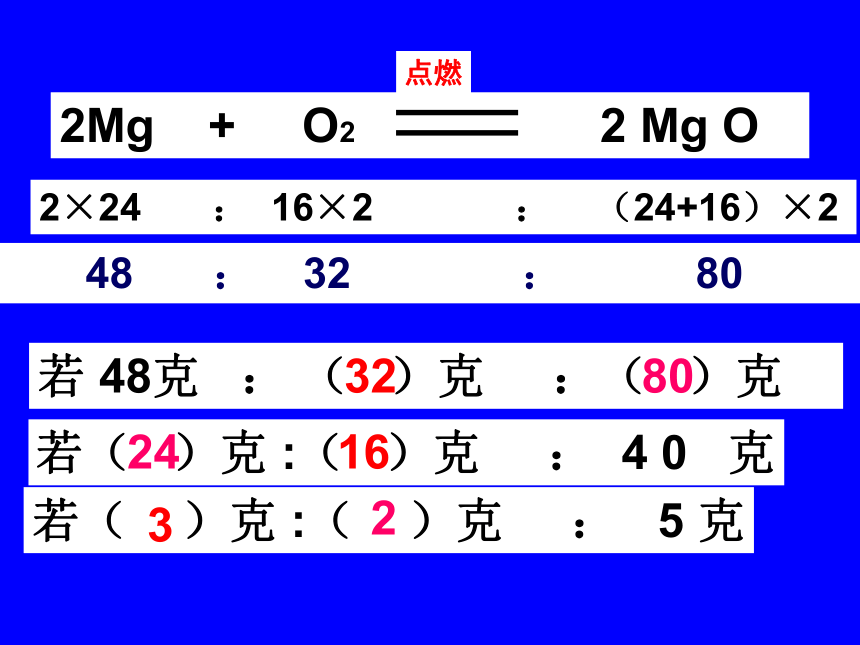
3、表示反应物、生成 物 各 物 质之间质量比。化学方程式的涵义×24 × 32 ×(24+16)化学方程式:2H2 + O2 2H2O点燃物质的质量比:2×2322×1843236::上述化学方程式表示:(1)质的含义:______________________________(2)微观的含义:____________________________(3)量的含义:______________________________在点燃的条件下,氢气和氧气反应生成水 每2个氢分子与1个氧分子反应生成2个水分子每4份质量的氢气与32份质量的氧气完全反应生成36份质量的水? : ? : 22复习:写出木炭在空气中燃烧的化学反应方程式及其物质质量比12 : 32 : 44若 3克 :( )克 :( )克 811 ??616说明:
在同一化学方程式中,反应物与生成物之间的质量比是固定不变的。相对质量之比等于实际质量之比!若 48克 : ( )克 :( )克若( )克 :( )克 : 4 0 克若( )克 :( )克 : 5 克32802416 3 2 研究物质的变化常常要涉及量的计算,根据化学方程式可以从量的方面研究物质的变化,例如一定量的原料可以生产出多少产品,制备一定量的产品需要多少原料等等通过这些计算,可以加强生产的计划性,并有利于合理的利用资源。应 用1.已知反应物的质量求生成物质量。
2.已知生成物的质量求反应物质量。应 用二、计算步骤和方法:[例题1]加热分解6.3g高锰酸钾,可以得到氧气的质量是多少? 32解:设可以得到氧气的质量是x。316326.3gx3166.3gxx32×6.3g3160.6g答:可以得到氧气的质量是0.6g。……………设……方……比……量……………………式………算…………答[例题2]工业上,煅烧石灰石(CaCO3)可制得生 石灰(CaO)和二氧化碳。如果要制取5.6t氧化钙,需要碳酸钙的质量是多少?解:设需要碳酸钙的质量是x。100565.6tx10056100×5.6t56xx5.6t10t答:需要碳酸钙10t。练 习氢气在氯气中燃烧生成氯化氢气体,写出该
反应的化学方程式,并计算燃烧100g氢气需
要氯气的质量是多少?生成氯化氢的质量是
多少?解:设需要氯气的质量是x,生成氯化氢的质量是y。 2 71 73100g x y2 : 71=100g : x , x=3550g 2 : 73=100g : y , y=3650g答:略 (3) 写出有关物质的相对分子质量
(不忘乘以前面的化学计量数)
已知量和未知量
(4) 列比例式,并求解1、根据化学方程式进行计算的步骤(1)设未知数 (不带单位) (2)写出化学方程式 (查化学式、查配平)(5) 简明的做答根据化学方程式计算的注意事项:
(1)设的时候应该用:
“设…的质量为x”,无单位
(2)化学方程式书写正确,一定要配平!!
(3)将已知量化成质量单位
(4)列比例式时,横比=横比
或竖比=竖比
[练习1]: 实验室用双氧水制氧气0.6克,
求需双氧水多少克?(1)解:设未知数 ……………....… 设(2)写出化学方程式 …...…. 写 (3) 算出有关的各物质的相对分子质量总和已知量和待求量 ········ 算 (6) 解比例式 …...….………. 解 (7) 简明地写出答案…….…….. 答 (4)标已知量和待求量 ·· ·· ···· 标 加热分解多少克高锰酸钾,可以得到6.4升的氧气?答:加热分解 31.6克 高锰酸钾,可以得到6.4升氧气。解: 设加热分解高锰酸钾质量为X,2x158 32
x 6.4升 XX=63.2克32316这是小A的作业题,你能找出哪些错误?××因为:质量=密度×体积,所以:
氧气的质量=1.429克/升×6.4升=9.15 克9.15 克90.31 克×90.31克 6.4升 9.15 克说明:
在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(反应物)的质量。练习:制取4.8克氧气,需要氯酸钾多少克?例1:把氯酸钾和二氧化锰的混合物16克加热至不再有气体放出,冷却后称得剩余固体质量为11.2克。 求:(1)反应所生成的气体的质量; (2)混合物中二氧化锰的质量。★解题关键:
运用质量守恒定律,正确理解:
1、反应前后固体质量为何变化?
2、其变量是多少?
3、变化量实际上就是哪种物质的质量?能力提升题解:⑴根据质量守恒定律可知:m(O2)=16g-11.2g=4.8g
⑵设氯酸钾的质量为x
245 96
x 4.8g
x=12.25g
二氧化锰的质量为:16g-12.25g=3.75g
答:生成氧气的质量为4.8g,二氧化锰的质量为3.75g例3:A+3B==2C+2D中,A与B的相对分子质量之比为9:11,已知1.8gA与一定量的B恰好完全反应生成5.1gD,
则此反应中B和C的质量比为_______2:1根据化学方程式的计算中,牢记两点:
1、实际质量与系数无关;
2、相对分子质量与系数有关。
因为:物质间的实际质量之比等于相对分子质量与其系数的乘积之比例4:有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?
提示:
解:设参加反应的锌的质量为x
65
x2
0.2g
答:锌的纯度为81%。×Good Bye!再见谢谢!
利用化学方程式的简单计算 2 : 1 : 2 48 : 32 : 801、表示反应物、反应条件、生成物。
2、表示 各反应物、生成 物 之间粒子个数比。
3、表示反应物、生成 物 各 物 质之间质量比。化学方程式的涵义×24 × 32 ×(24+16)化学方程式:2H2 + O2 2H2O点燃物质的质量比:2×2322×1843236::上述化学方程式表示:(1)质的含义:______________________________(2)微观的含义:____________________________(3)量的含义:______________________________在点燃的条件下,氢气和氧气反应生成水 每2个氢分子与1个氧分子反应生成2个水分子每4份质量的氢气与32份质量的氧气完全反应生成36份质量的水? : ? : 22复习:写出木炭在空气中燃烧的化学反应方程式及其物质质量比12 : 32 : 44若 3克 :( )克 :( )克 811 ??616说明:
在同一化学方程式中,反应物与生成物之间的质量比是固定不变的。相对质量之比等于实际质量之比!若 48克 : ( )克 :( )克若( )克 :( )克 : 4 0 克若( )克 :( )克 : 5 克32802416 3 2 研究物质的变化常常要涉及量的计算,根据化学方程式可以从量的方面研究物质的变化,例如一定量的原料可以生产出多少产品,制备一定量的产品需要多少原料等等通过这些计算,可以加强生产的计划性,并有利于合理的利用资源。应 用1.已知反应物的质量求生成物质量。
2.已知生成物的质量求反应物质量。应 用二、计算步骤和方法:[例题1]加热分解6.3g高锰酸钾,可以得到氧气的质量是多少? 32解:设可以得到氧气的质量是x。316326.3gx3166.3gxx32×6.3g3160.6g答:可以得到氧气的质量是0.6g。……………设……方……比……量……………………式………算…………答[例题2]工业上,煅烧石灰石(CaCO3)可制得生 石灰(CaO)和二氧化碳。如果要制取5.6t氧化钙,需要碳酸钙的质量是多少?解:设需要碳酸钙的质量是x。100565.6tx10056100×5.6t56xx5.6t10t答:需要碳酸钙10t。练 习氢气在氯气中燃烧生成氯化氢气体,写出该
反应的化学方程式,并计算燃烧100g氢气需
要氯气的质量是多少?生成氯化氢的质量是
多少?解:设需要氯气的质量是x,生成氯化氢的质量是y。 2 71 73100g x y2 : 71=100g : x , x=3550g 2 : 73=100g : y , y=3650g答:略 (3) 写出有关物质的相对分子质量
(不忘乘以前面的化学计量数)
已知量和未知量
(4) 列比例式,并求解1、根据化学方程式进行计算的步骤(1)设未知数 (不带单位) (2)写出化学方程式 (查化学式、查配平)(5) 简明的做答根据化学方程式计算的注意事项:
(1)设的时候应该用:
“设…的质量为x”,无单位
(2)化学方程式书写正确,一定要配平!!
(3)将已知量化成质量单位
(4)列比例式时,横比=横比
或竖比=竖比
[练习1]: 实验室用双氧水制氧气0.6克,
求需双氧水多少克?(1)解:设未知数 ……………....… 设(2)写出化学方程式 …...…. 写 (3) 算出有关的各物质的相对分子质量总和已知量和待求量 ········ 算 (6) 解比例式 …...….………. 解 (7) 简明地写出答案…….…….. 答 (4)标已知量和待求量 ·· ·· ···· 标 加热分解多少克高锰酸钾,可以得到6.4升的氧气?答:加热分解 31.6克 高锰酸钾,可以得到6.4升氧气。解: 设加热分解高锰酸钾质量为X,2x158 32
x 6.4升 XX=63.2克32316这是小A的作业题,你能找出哪些错误?××因为:质量=密度×体积,所以:
氧气的质量=1.429克/升×6.4升=9.15 克9.15 克90.31 克×90.31克 6.4升 9.15 克说明:
在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(反应物)的质量。练习:制取4.8克氧气,需要氯酸钾多少克?例1:把氯酸钾和二氧化锰的混合物16克加热至不再有气体放出,冷却后称得剩余固体质量为11.2克。 求:(1)反应所生成的气体的质量; (2)混合物中二氧化锰的质量。★解题关键:
运用质量守恒定律,正确理解:
1、反应前后固体质量为何变化?
2、其变量是多少?
3、变化量实际上就是哪种物质的质量?能力提升题解:⑴根据质量守恒定律可知:m(O2)=16g-11.2g=4.8g
⑵设氯酸钾的质量为x
245 96
x 4.8g
x=12.25g
二氧化锰的质量为:16g-12.25g=3.75g
答:生成氧气的质量为4.8g,二氧化锰的质量为3.75g例3:A+3B==2C+2D中,A与B的相对分子质量之比为9:11,已知1.8gA与一定量的B恰好完全反应生成5.1gD,
则此反应中B和C的质量比为_______2:1根据化学方程式的计算中,牢记两点:
1、实际质量与系数无关;
2、相对分子质量与系数有关。
因为:物质间的实际质量之比等于相对分子质量与其系数的乘积之比例4:有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?
提示:
解:设参加反应的锌的质量为x
65
x2
0.2g
答:锌的纯度为81%。×Good Bye!再见谢谢!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
