化学人教版(2019)选择性必修3 2.2.1 乙烯(共80张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.1 乙烯(共80张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-30 23:43:42 | ||
图片预览








文档简介
(共80张PPT)
乙烯
www.themegallery.com
Company Logo
乙烯是植物生长调节剂、催熟剂。
神奇的乙烯!
乙烯是重要的有机化工原料,乙烯的产量是衡量一个国家石油工业发展水平的标志
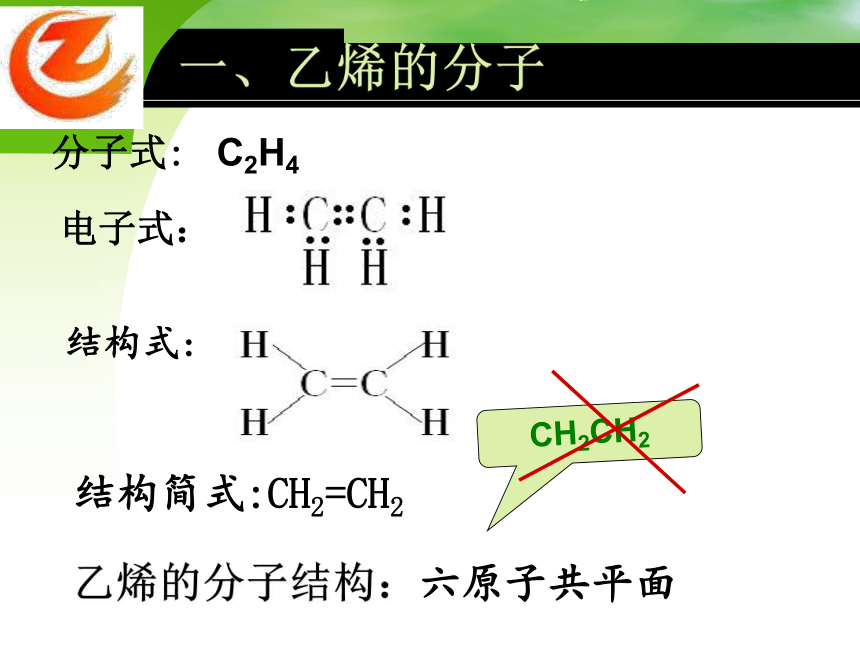
一、乙烯的分子
结构式:
分子式:
结构简式:CH2=CH2
C2H4
电子式:
CH2CH2
乙烯的分子结构:六原子共平面
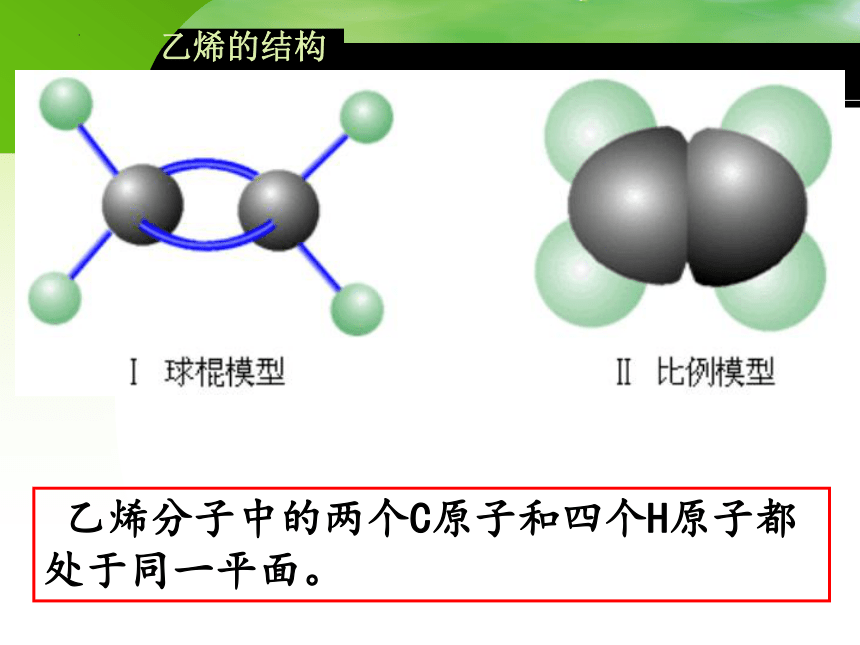
乙烯的结构
乙烯分子中的两个C原子和四个H原子都处于同一平面。
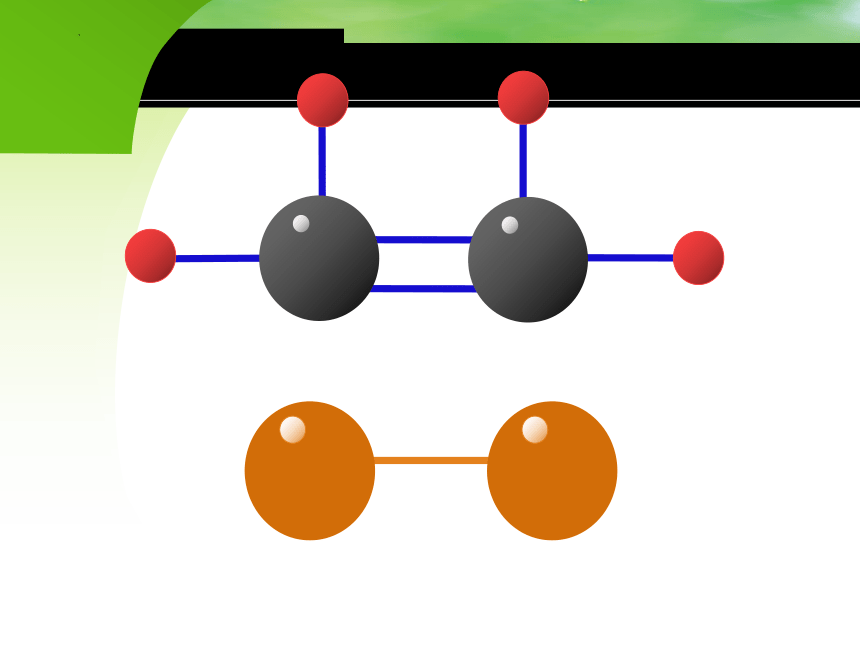
乙烯与乙烷结构的对比:
分子式 C2H6 C2H4
键的类别
键角
键能(KJ/mol)
空间各原子 的位子
C-C
109 28ˊ
348
2C和6H不在同一平面上
C C
120
615
2C和4H在同一平面上
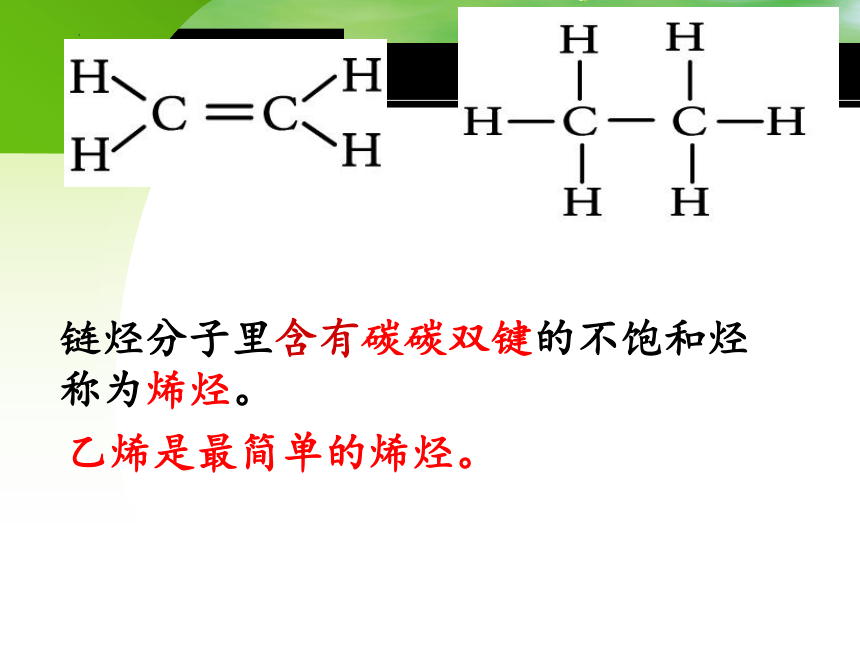
链烃分子里含有碳碳双键的不饱和烃称为烯烃。
乙烯是最简单的烯烃。
乙烯是一种无色、稍有臭味的气体,难溶于水。
二、乙烯的物理性质
乙烯
密度比空气略小
如何收集乙烯?
排水法
Company Logo
1、氧化反应
(1)可燃性
明亮的火焰,产生黑烟
三、乙烯的化学性质
因为乙烯含碳量高,燃烧不充分
乙烯
甲烷
实验2:把乙烯气体通溴的四氯化碳溶液中。
溴的红棕色很快褪去
实验现象
CH2=CH2
+Br2
2、加成反应
使溴水/溴的四氯化碳溶液褪色
1,2-二溴乙烷
有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应。
注意: CCl4作溶剂,不参与反应
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳碳单键键能(348KJ/mol)的二倍,其中有一条碳碳键键能小,容易断裂。
加成反应(特征反应)
此外,乙烯还可跟H2、HX 、H—OH等加成。
CH2 = CH2 + H2 CH3 - CH3
催化剂
乙烯跟HCl加成:
乙烯跟H2加成:
CH2 = CH2 + H2O CH3– CH2–OH
催化剂
加热 加压
乙烯跟H2O加成 :(乙烯水化制乙醇)
CH2 = CH2 + HCl CH3 – CH2Cl
催化剂
对比:
加成反应:
取代反应:
只发生在不饱和碳原子上,
“只上不下” ,加而成之
“有上有下” ,取而代之
加成反应与取代反应各有什么特点呢?
要获得CH3CH2Cl有两种方法,
方法一:CH3CH3和Cl2取代,
CH3CH3+Cl2 CH3CH2Cl+HCl
方法二:CH2=CH2和HCl加成,
CH2=CH2+HCl CH3CH2Cl
讨论哪种方法好?为什么?
光
催化剂
方法二好
取代反应有连续性,会生成杂质
3、加聚反应
聚合反应:分子量小的化合物分子(单体)互相结合成分子量大的化合物(高分子化合物)
加聚反应:加成聚合反应
CH2=CH2 + CH2=CH2 + CH2=CH2 +……
-CH2-CH2-CH2-CH2-CH2-CH2-……
写出丙烯的结构简式,并写出丙烯加聚反应的方程式。
Company Logo
(1)有机化工原料乙烯还可以制塑料、橡胶和纤维。
国际上衡量一个国家的石油化学工业水平的高低就是用“乙烯的年产量”来衡量。
(2)植物生长调节剂,催熟剂
乙烯的用途
比较乙烷与乙烯的性质
乙烷 乙烯
结构式
燃烧反应
取代反应
加成反应
与KMnO4(H+)反应
有
有
有
无
无
有
无
有
乙烷:能氧化、能取代
乙烯:易氧化、易加成
在乙烷气体中混有乙烯,要除去乙烯,最好的试剂是( )
A、H2 B、酸性高锰酸钾溶液
C、溴水 D、溴的四氯化碳溶液
C
思考:鉴别甲烷、乙烯,可采用哪些方法?
燃烧
酸性高锰酸钾溶液
溴水或溴的四氯化碳溶液
1、氧化反应:
a、燃烧
b、被酸性KMnO4溶液氧化。
乙烯的化学性质
2、加成反应(与H2、Br2、HX、H2O等)
CH2=CH2 + Br2 →
CH2=CH2+3O2 2CO2+2H2O
点燃
产生CO2
CH2=CH2 + HCl
催化剂
CH3CH2Cl
CH2=CH2 + H-OH
催化剂
CH3CH2-OH
3、加聚反应
四、乙烯的实验室制法
1、药品:酒精、浓硫酸
(体积比 1:3)
2、反应原理:
H H
H―C―C―H CH2=CH2 + H2O
H OH
浓硫酸
170 ℃
分子内脱水
液+液→气体(乙烯)
3、装置类型:
仪器: 圆底烧瓶、 温度计、
酒精灯 、铁架台
5、气体收集:
排水集气法
4、净化:
[小结]注意事项:
1、催化剂、脱水剂。 浓硫酸与乙醇的体积比为3:1
使用过量的浓硫酸,可提高乙醇的利用率,增加乙烯产量
2、加碎瓷片:避免混合液在受热沸腾时剧烈跳动(暴沸)
3、温度要迅速升高到1700C减少副反应,提高产物纯度
浓硫酸
140 ℃
2 CH3CH2OH
C2H5OC2H5 + H2O
分子间脱水
浓硫酸
C2H5OH 2C+3H2O
温度过高乙醇炭化:
4、温度计水银球插入液面以下,以准确测定反应混合液
温度。但水银球不能接触烧瓶底部,否则引起局部温度过高。
5、产生的乙烯气体中含有SO2、CO2等酸性杂质
6、实验结束时先撤导管,在撤酒精灯。
[思考]在实验室里制备的乙烯中常含有SO2,试设
计一个实验,检验SO2的存在并验证乙烯的还原性。
[思考]
乙烯能使溴水褪色,甲同学认为发生了取代反应,另一同学认为发生了加成反应,哪一位同学正确呢?试设计实验验证。
CH2=CH2
CH2=CH-CH3
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
CH2=C-CH3
CH3
烯烃
结构特点:
通式:
(1)有1个C=C
(2)链状
CnH2n ( n≥2 )
乙烯
丙烯
1-丁烯
2-丁烯
2-甲基丙烯
烯烃
结构特点:
组成特点:
碳碳双键
只有碳、氢两种元素
(烯)
(烃)
不饱和烃:
特点:有 C=C或C≡C, 烃
分子中所含的H原子数小于相同碳原子数的烷烃中的H原子数
1、概念:分子里含碳碳双键的不饱和链烃。
2、烯烃的通式:CnH2n (n≥2)
思考:下列物质属于乙烯的同系物的有
碳原子数不相同
A、CH3-CH=CH-CH3
B、CH3CH3
E 、CH2=CHCH=CH2
C、CH≡C-CH3
CH3
D.CH3CHCH=CH2
结构相似:含且只含一个C=C双键,成链状
组成
通式:CnH2n(n ≥ 2)
组成:差若干个CH2
烯烃同系物:
思考:写出C4H8属于烯烃的所有同分异构体。
3、烯烃的物理性质
(1)不溶于水,密度小于水
(2)随着随碳原子数增多,密度逐渐增大,熔沸点逐渐升高。
4、化学性质
加成反应
(H2 HX H2O)
烯烃能使溴水褪色
氧化反应
(1)燃烧
(2)与酸性KMnO4溶液反应
加聚反应
试着写出丙烯与Br2、HBr和水反应的反应方程式。
烯烃的不对称加成(马氏规则)
烯烃的不对称加成:
丙烯的加成
H2C=CH-CH3+HBr
H2C-CH-CH3
| |
H Br
H2C-CH-CH3
| |
Br H
马氏规则
反马氏规则
思考:2-丁烯与HBr发生加成反应能得到几种产物
(H2O2等作用)
马氏规则:不对称烯烃发生加成反应时,氢原子加到含氢多的不饱和碳原子上。
主要产物
练习:写出丙烯分别与溴、溴化氢、水反应的方程式。
练习:下列烯烃和H2O发生加成反应所得的产物有同分异构体的是( )
A. CH2=CH2 B. CH3CH=CH2
C. CH3CH=CHCH3 D. CH3CH2CH=CH2
BD
思考:能写出1,3-丁二烯的结构简式吗?它和溴水加成产物有几种?
H2C=CH-CH=CH2
共轭二烯烃:双键和单键相互交替排列的烯烃分子。
①1,2 加成
② 1,4 加成
3,4-二溴-1-丁烯
CH2=CH-CH=CH2+Br2
CH2-CH-CH=CH2
Br
Br
-80℃
1,4-二溴-2-丁烯
CH2-CH=CH-CH2
Br
Br
CH2=CH-CH=CH2+Br2
80℃
低温
高温
思考:1mol1,3-丁二烯与Br2加成最多消耗Br2多少?
加聚反应
聚丙烯
练一练:分别写出丙烯、CH3-CH=CH-CH3、
1,3-丁二烯发生加聚反应的化学方程式
1.单体
2.链节
3.聚合度
4.聚合物
nCH2=CH2 [ CH2─CH2 ] n
CH2=CH2
─ CH2─CH2 ─
n
以乙烯和丙烯混合物为单体,发生加聚反应,不可能得到的是 ( )
试一试
一、组成和结构
分子式:
电子式:
结构式:
结构简式:
C2H2
H∶C C∶H
H—C C—H
HC CH
乙炔的空间结构是直线型
乙 炔
特点:碳碳叁键
推测乙炔能发生哪些反应?
二、物理性质
无色、无味气体。密度是1.16克/升,比空气稍轻。微溶于水,易溶有机溶剂。
2C2H2 + 5O2 4CO2 + 2H2O
点燃
三、化学性质
1. 氧化反应
(1) 燃烧
(2)使酸性KMnO4溶液褪色
氧炔焰温度高达3000,切割焊接金属
伴有浓黑烟
2.加成反应
CH2=CH2
CH CH + H2
催化剂
CH2=CH2 + H2
催化剂
CH3 CH3
使溴水褪色
3.加聚反应
(特征反应)(1:2)
nCH CH
加温、加压
催化剂
CH=CH
n
加聚反应:导电塑料——聚乙炔
不宜使用聚氯乙烯制品
直接盛装食物。
聚氯乙烯
CH2=CHCl
CH CH + HCl
催化剂
氯乙烯
(二)乙炔的实验室制法
3、发生装置:
1、药品:
水或饱和食盐水
碳化钙(CaC2、俗名:电石)
2、反应原理:
CaC2+ 2H2O
Ca(OH)2+C2H2
微溶
固+液 气
(1)仪器:平底烧瓶(锥形瓶或广口瓶)+分液漏斗
(2)与制H2,CO2,NO,NO2的装置相同
5、收集方法:
排水集气法
不用排气法收集乙炔,因乙炔易燃,混入空气点燃易发生爆炸。
4、净化:
[注意〕
1、用块状CaC2而不用粉末状;用饱和食盐水代替水(降低水的含量),以得到平稳的乙炔气流。
2、不能用启普发生器制乙炔
原因:(1)反应剧烈,难以控制反应速率
(2)反应放出大量热,易使启普发生器发生炸裂
(3)生成物Ca(OH)2微溶于水,易形成糊状泡沫堵塞导气管和球形漏斗。
3、在广口瓶内导管口放置一团棉花其作用:
避免生成的Ca(OH)2糊状物泡沫堵塞导管。
涉及到“棉花团”的化学实验有哪些?
4、电石和水反应生成乙炔的同时,生成H2S、PH3等有臭味的气体,除杂试剂:CuSO4溶液、NaOH溶液
炔烃
CH≡CH
CH≡C-CH3
CH≡C-CH2-CH3
CH3-C≡C-CH3
1、结构特点:
2、通式:
(1)有1个C≡C
(2)链状
CnH2n-2 ( n≥2 )
乙炔
丙炔
1-丁炔
2-丁炔
乙烷、乙烯和乙炔的比较
乙烷 乙烯 乙炔
分子式 C2H6 C2H4 C2H2
结构式 H-C C-H
空间结构 四面体 平面结构 直线型
与酸性高锰酸钾溶液 不反应 氧化反应 氧化反应
与溴水 不反应 加成反应 加成反应
与卤素单质 (取代)反应 不反应 不反应
烷烃 烯烃 炔烃
定义 碳原子之间都以 C-C单键 结合的链状烃
通式 CnH2n+2
类别 饱和烃
分子中含有 碳碳双键的链烃
分子中含有碳碳叁键的链烃
CnH2n (n ≥ 2)
(含一个双键)
CnH2n-2 (n ≥ 2)
(含一个叁键)
不饱和烃
不饱和烃
烯烃和炔烃的命名
1、将含有双键或叁键的最长碳链作为主链,称为“某烯”或“某炔”。
2、从距离双键或叁键最近的一端给主链上的碳原子依次编号。
3、用阿拉伯数字标明双键或叁键的位置(只需标明双键或叁键碳原子编号较小的数字)。用“二”“三”等表示双键或叁键的个数。
CH2=CH-CH2-CH3
丁烯
CH3-C≡C-CH2-CH3
2-戊炔
H3C=C-CH-CH=CH-CH3
CH2CH3
2-乙基-2,4-己二烯
1
2
3
4
5
6
1-
与烷烃类似
H2C≡C-CH2-CH-CH3
CH3
戊炔
1-
4-甲基-
练一练
2,4-二甲基-2-戊烯
CH2=CH-CH=CH2
1,3-丁二烯
4-甲基-3-乙基-2-戊烯
类 别 结 构 特 点 主 要 性 质
烷烃 单键 (C-C) 链状
烯烃 双键 (C=C)
炔烃 叁键 (C C)
小结:结构和性质
1.稳定:通常情况下不与强 酸、强碱、强氧
化剂反应 2.取代反应(卤代)3.氧化反应
(燃烧) 4.加热分解
1.加成反应(加H2、X2 、HX 、 H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化)
3.加聚反应
1.加成反应(加H2、X2、HX、H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化
3.加聚反应
(2)写出其与Br2按1:1加成的化学方程式。
1,3-丁二烯的结构简式为:CH2=CH-CH=CH2,
思考:(1) 1,3-丁二烯能否使酸性KMnO4溶液和溴水褪色。
2、1mol某链烃最多能和2molHCl发生加成反应,生成1mol氯代烷,1mol该氯代烷能和6molCl2发生取代反应,生成只含有碳元素和氯元素的氯代烃,该烃可能是( )
A.CH3CH=CH2 B. CH3C≡CH
C.CH3CH2C≡CH D. CH2=CHCH=CH2
试一试
1、定义:不含有苯环的烃
一、脂肪烃:
脂肪烃
饱和烃:不含不饱和链
烷烃
烯烃
炔烃
环烷烃
环烯烃
-----
CH4
CH2=CH2
CH≡CH
CnH2n+2
CnH2n
CnH2n-2
CnH2n
CnH2n-2
二、脂肪烃的物理性质
2、都属分子晶体,熔沸点较低。碳原子数越多,相对分子质量越大,密度越大,熔沸点逐渐升高。
4、常温常压下,C4以下的脂肪烃为气态, C5-C16之间的一般为液态, C17以上的一般是固体。
1、难溶于水,易溶于有机溶剂,密度都比水小。
3、碳原子数相同,支链越多,其熔沸点越低。
(一)氧化反应
2、 不能使酸性高锰酸钾溶液褪色,
能使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液鉴别 和 。
除杂:CH4(C2H4)或 CH4(C2H2)
烷烃
饱和烃
烯烃、炔烃
溴水
三、脂肪烃的化学性质
不饱和烃
CxHy+(x+ )O2 xCO2+ H2O
1 、燃烧
[注意]点燃前要验纯
含碳量越高,燃烧越不充分,黑烟越浓,火焰越明亮
乙炔氧焰温度可达3000℃ 以上,可用焰焊接和切割金属。
(二)特征反应
取代反应
烷烃
四、脂肪烃的化学性质
1、定义:有机物分子中某些原子或原子团被其它原子或原子团所代替的反应。
2、条件:纯净的卤素,光照
【活动与探究】写出C5H12与氯气的第一步反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
CH3CH3+Br2
光
CH3CH2Br +HBr
讨论:此反应是否适合制氯乙烷?
1mol乙烷完全取代需氯气多少?
(二)特征反应
四、脂肪烃的化学性质
烯烃、炔烃
加成反应
定义:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
(与H2、Br2、HX、H2O等)
CH2==CH2+Br2 CH2BrCH2Br
使溴水褪色
CH2==CH2+H2O CH3CH2OH
催化剂
加压、加热
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
CH≡CH+2H2→CH3CH3
催化
烯烃、炔烃
加聚反应
加聚反应:通过加成反应聚合成高分子化合物的反应。
导电塑料——聚乙炔
(二)特征反应
四、脂肪烃的化学性质
单体
链节
聚合度
混合物
聚乙烯
1、写出下列物质的加聚反应方程式
(1)nCH3CH=CHCH2CH3
催化剂
(2)以乙烯和丙烯为原料1:1加聚合成塑料
[ CH2-CH ]
n
C6H5
|
[ CH2-CH=C-CH2 ]
n
Cl
|
[ CH2-CH2-CH-CH2 ]
n
CH3
|
2、找出下列高聚物的单体
热分解
CH4 C +2H2
1000℃以上
生产工业原料焦炭、氢气
C16H34 C8H18 +C8H16
Δ
裂化:生产轻质油
C4H10 C2H4+C2H6
△
C4H10 CH4+C3H6
△
裂解:得到短链的不饱和烃
四、脂肪烃的化学性质
类 别 结 构 特 点 主 要 性 质
烷烃 单键 (C-C) 链状
烯烃 双键 (C=C)
炔烃 叁键 (C C)
小结:结构和性质
1.稳定:通常情况下不与强 酸、强碱、强氧
化剂反应 2.取代反应(卤代)3.氧化反应
(燃烧) 4.加热分解
1.加成反应(加H2、X2 、HX 、 H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化)
3.加聚反应
1.加成反应(加H2、X2、HX、H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化
3.加聚反应
练习1、1 mol丙烷在光照下,最多可与多少摩尔Cl2发生取代
A、2 mol B、4 mol
C、8 mol D、10 mol
C
2、 下列关于乙烯和乙烷相比较的各说法中,不正确的是
A.乙烯是不饱和烃,乙烷是饱和烃
B.乙烯能使高锰酸钾酸性溶液和溴水褪色,乙烷则不能
C.乙烯分子中碳碳双键的键能是乙烷分子中碳碳单
键的键能的两倍,因此乙烯比乙烷稳定
D.乙烯分子为平面形结构,乙烷分子为立体结构
C
3、关于甲烷、乙烯、乙炔三种有机物的说法正确的是
A 燃烧时都有浓烟生成
B 燃烧都生成水和二氧化碳
C 都可发生加成反应
D 都是无色无味的气体
B
4、某气态烃1mol能与2mol HCl氯化氢完全加成,加成产物分子上的氢原子又可被6mol Cl2取代,则气态烃可能是
A、CH ≡CH B、CH2=CH2
C、CH≡C—CH3 D、CH2=C(CH3)CH3
C
1、物质的量相同的烃(CxHy)完全燃烧时,
物质的量相同的下列烃完全燃烧时耗氧量最多的是( )
A、C5H12 B、C6H14
C、C7H8 D、C8H8
D
一、有机物燃烧时耗氧量大小的比较:
耗氧量的大小决定于
2、相同质量的烃燃烧时
下列质量相同的烃完全燃烧时消耗氧气的量由多到少的顺序是 。
① ④ ③ ②
含氢质量分数越大,耗氧量越大。
C + O2 === CO2
4H + O2 === 2H2O
12g
32g
4g
32g
①CH4
③C2H4
②C2H2
④C2H6
各分子式改写成CHx形式
CH4
CH
CH2
CH3
12g
96g
两种烃组成的的混合物,其平均组成为C1.6H2.8,从C平均个数分析,有一种烃的C原子数必定是___个,故可以确定该烃应该是______,再由H平均个数分析,另外一种烃的H原子数必定是____个,则另外一种烃应该是_______,前后两种烃的物质的量比为_____。
1
CH4
2
C2H2
2:3
CH4
1
C2H2
2
1.6
0.6
0.4
C
2:3
C1.1H3.8
9:1
乙烷和乙烯的混合气体3L完全燃烧需相同状况下的O210L,求乙烷和乙烯的体积比______
乙烷C2H6
3.5aL
乙烯C2H4
3bL
aL
bL
a+b=3
3.5a+3b=10
a=2
b=1
2:1
O2
乙烷C2H6
10.5L
乙烯C2H4
9L
3L
3L
O2
10
0.5
1
十字交叉法
2:1
两种气态烃的混合气体共1L,在空气中燃烧生成1.5LCO2气体和2L水蒸气(气体体积均在相同状况下测定),关于该混合气体的说法正确的是
A、一定含有乙烯
B、一定含有甲烷,不一定含乙烷
C、一定含有乙烷,
D、一定含有甲烷,一定不含有乙烷
D
在120℃时,以任意质量比混合的烃的混合物和过量的O2在一密闭容器中完全反应,测得反应前后体系内的压强没有变化,则该混合烃可能是( )
A.CH4和C2H4 B.CH4和C2H6
C.C2H4和C2H6 D.C2H2和C3H6
二、有机物分子式的计算
1、相对分子质量(摩尔质量)的计算
(1)
(2)
M=ρ×Vm
(3)
M1=M2×相对密度
2、分子式的计算
(1)C、H等元素的质量、质量比、质量分数
(2)燃烧产物(CO2、H2O)
1.某气态烃含C 85.7%,含H 14.3%,在标准状况下的密度是2.5g/L。该烃能使酸性高锰酸钾溶液或溴水褪色。求该烃的分子式,并写出它的各种同分异构体的结构简式。
M=ρ×Vm
=2.5g/L×22.4L/mol
=56g/mol
设该烃分子式为CxHy
12x
56
=85.7%
x=4
y
56
=14.3%
y=8
分子式为C4H8
练习3.标准状况下某气态烃0.56L,经充分燃烧后,将生成的气体通过盛有足量浓H2SO4的洗瓶,浓H2SO4质量增重1.8g,然后再通过碱石灰,气体被完全吸收,碱石灰质量增加3.3g,求该烃的分子式。
C3H8
练习2.某烃中碳、氢元素的质量比是24:5,该烃相对于氢气的密度为29,则该烃的最简式是 ,摩尔质量是 ,分子式为 。
C2H5
58 g/mol
C4H10
乙烯
www.themegallery.com
Company Logo
乙烯是植物生长调节剂、催熟剂。
神奇的乙烯!
乙烯是重要的有机化工原料,乙烯的产量是衡量一个国家石油工业发展水平的标志
一、乙烯的分子
结构式:
分子式:
结构简式:CH2=CH2
C2H4
电子式:
CH2CH2
乙烯的分子结构:六原子共平面
乙烯的结构
乙烯分子中的两个C原子和四个H原子都处于同一平面。
乙烯与乙烷结构的对比:
分子式 C2H6 C2H4
键的类别
键角
键能(KJ/mol)
空间各原子 的位子
C-C
109 28ˊ
348
2C和6H不在同一平面上
C C
120
615
2C和4H在同一平面上
链烃分子里含有碳碳双键的不饱和烃称为烯烃。
乙烯是最简单的烯烃。
乙烯是一种无色、稍有臭味的气体,难溶于水。
二、乙烯的物理性质
乙烯
密度比空气略小
如何收集乙烯?
排水法
Company Logo
1、氧化反应
(1)可燃性
明亮的火焰,产生黑烟
三、乙烯的化学性质
因为乙烯含碳量高,燃烧不充分
乙烯
甲烷
实验2:把乙烯气体通溴的四氯化碳溶液中。
溴的红棕色很快褪去
实验现象
CH2=CH2
+Br2
2、加成反应
使溴水/溴的四氯化碳溶液褪色
1,2-二溴乙烷
有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应。
注意: CCl4作溶剂,不参与反应
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳碳单键键能(348KJ/mol)的二倍,其中有一条碳碳键键能小,容易断裂。
加成反应(特征反应)
此外,乙烯还可跟H2、HX 、H—OH等加成。
CH2 = CH2 + H2 CH3 - CH3
催化剂
乙烯跟HCl加成:
乙烯跟H2加成:
CH2 = CH2 + H2O CH3– CH2–OH
催化剂
加热 加压
乙烯跟H2O加成 :(乙烯水化制乙醇)
CH2 = CH2 + HCl CH3 – CH2Cl
催化剂
对比:
加成反应:
取代反应:
只发生在不饱和碳原子上,
“只上不下” ,加而成之
“有上有下” ,取而代之
加成反应与取代反应各有什么特点呢?
要获得CH3CH2Cl有两种方法,
方法一:CH3CH3和Cl2取代,
CH3CH3+Cl2 CH3CH2Cl+HCl
方法二:CH2=CH2和HCl加成,
CH2=CH2+HCl CH3CH2Cl
讨论哪种方法好?为什么?
光
催化剂
方法二好
取代反应有连续性,会生成杂质
3、加聚反应
聚合反应:分子量小的化合物分子(单体)互相结合成分子量大的化合物(高分子化合物)
加聚反应:加成聚合反应
CH2=CH2 + CH2=CH2 + CH2=CH2 +……
-CH2-CH2-CH2-CH2-CH2-CH2-……
写出丙烯的结构简式,并写出丙烯加聚反应的方程式。
Company Logo
(1)有机化工原料乙烯还可以制塑料、橡胶和纤维。
国际上衡量一个国家的石油化学工业水平的高低就是用“乙烯的年产量”来衡量。
(2)植物生长调节剂,催熟剂
乙烯的用途
比较乙烷与乙烯的性质
乙烷 乙烯
结构式
燃烧反应
取代反应
加成反应
与KMnO4(H+)反应
有
有
有
无
无
有
无
有
乙烷:能氧化、能取代
乙烯:易氧化、易加成
在乙烷气体中混有乙烯,要除去乙烯,最好的试剂是( )
A、H2 B、酸性高锰酸钾溶液
C、溴水 D、溴的四氯化碳溶液
C
思考:鉴别甲烷、乙烯,可采用哪些方法?
燃烧
酸性高锰酸钾溶液
溴水或溴的四氯化碳溶液
1、氧化反应:
a、燃烧
b、被酸性KMnO4溶液氧化。
乙烯的化学性质
2、加成反应(与H2、Br2、HX、H2O等)
CH2=CH2 + Br2 →
CH2=CH2+3O2 2CO2+2H2O
点燃
产生CO2
CH2=CH2 + HCl
催化剂
CH3CH2Cl
CH2=CH2 + H-OH
催化剂
CH3CH2-OH
3、加聚反应
四、乙烯的实验室制法
1、药品:酒精、浓硫酸
(体积比 1:3)
2、反应原理:
H H
H―C―C―H CH2=CH2 + H2O
H OH
浓硫酸
170 ℃
分子内脱水
液+液→气体(乙烯)
3、装置类型:
仪器: 圆底烧瓶、 温度计、
酒精灯 、铁架台
5、气体收集:
排水集气法
4、净化:
[小结]注意事项:
1、催化剂、脱水剂。 浓硫酸与乙醇的体积比为3:1
使用过量的浓硫酸,可提高乙醇的利用率,增加乙烯产量
2、加碎瓷片:避免混合液在受热沸腾时剧烈跳动(暴沸)
3、温度要迅速升高到1700C减少副反应,提高产物纯度
浓硫酸
140 ℃
2 CH3CH2OH
C2H5OC2H5 + H2O
分子间脱水
浓硫酸
C2H5OH 2C+3H2O
温度过高乙醇炭化:
4、温度计水银球插入液面以下,以准确测定反应混合液
温度。但水银球不能接触烧瓶底部,否则引起局部温度过高。
5、产生的乙烯气体中含有SO2、CO2等酸性杂质
6、实验结束时先撤导管,在撤酒精灯。
[思考]在实验室里制备的乙烯中常含有SO2,试设
计一个实验,检验SO2的存在并验证乙烯的还原性。
[思考]
乙烯能使溴水褪色,甲同学认为发生了取代反应,另一同学认为发生了加成反应,哪一位同学正确呢?试设计实验验证。
CH2=CH2
CH2=CH-CH3
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
CH2=C-CH3
CH3
烯烃
结构特点:
通式:
(1)有1个C=C
(2)链状
CnH2n ( n≥2 )
乙烯
丙烯
1-丁烯
2-丁烯
2-甲基丙烯
烯烃
结构特点:
组成特点:
碳碳双键
只有碳、氢两种元素
(烯)
(烃)
不饱和烃:
特点:有 C=C或C≡C, 烃
分子中所含的H原子数小于相同碳原子数的烷烃中的H原子数
1、概念:分子里含碳碳双键的不饱和链烃。
2、烯烃的通式:CnH2n (n≥2)
思考:下列物质属于乙烯的同系物的有
碳原子数不相同
A、CH3-CH=CH-CH3
B、CH3CH3
E 、CH2=CHCH=CH2
C、CH≡C-CH3
CH3
D.CH3CHCH=CH2
结构相似:含且只含一个C=C双键,成链状
组成
通式:CnH2n(n ≥ 2)
组成:差若干个CH2
烯烃同系物:
思考:写出C4H8属于烯烃的所有同分异构体。
3、烯烃的物理性质
(1)不溶于水,密度小于水
(2)随着随碳原子数增多,密度逐渐增大,熔沸点逐渐升高。
4、化学性质
加成反应
(H2 HX H2O)
烯烃能使溴水褪色
氧化反应
(1)燃烧
(2)与酸性KMnO4溶液反应
加聚反应
试着写出丙烯与Br2、HBr和水反应的反应方程式。
烯烃的不对称加成(马氏规则)
烯烃的不对称加成:
丙烯的加成
H2C=CH-CH3+HBr
H2C-CH-CH3
| |
H Br
H2C-CH-CH3
| |
Br H
马氏规则
反马氏规则
思考:2-丁烯与HBr发生加成反应能得到几种产物
(H2O2等作用)
马氏规则:不对称烯烃发生加成反应时,氢原子加到含氢多的不饱和碳原子上。
主要产物
练习:写出丙烯分别与溴、溴化氢、水反应的方程式。
练习:下列烯烃和H2O发生加成反应所得的产物有同分异构体的是( )
A. CH2=CH2 B. CH3CH=CH2
C. CH3CH=CHCH3 D. CH3CH2CH=CH2
BD
思考:能写出1,3-丁二烯的结构简式吗?它和溴水加成产物有几种?
H2C=CH-CH=CH2
共轭二烯烃:双键和单键相互交替排列的烯烃分子。
①1,2 加成
② 1,4 加成
3,4-二溴-1-丁烯
CH2=CH-CH=CH2+Br2
CH2-CH-CH=CH2
Br
Br
-80℃
1,4-二溴-2-丁烯
CH2-CH=CH-CH2
Br
Br
CH2=CH-CH=CH2+Br2
80℃
低温
高温
思考:1mol1,3-丁二烯与Br2加成最多消耗Br2多少?
加聚反应
聚丙烯
练一练:分别写出丙烯、CH3-CH=CH-CH3、
1,3-丁二烯发生加聚反应的化学方程式
1.单体
2.链节
3.聚合度
4.聚合物
nCH2=CH2 [ CH2─CH2 ] n
CH2=CH2
─ CH2─CH2 ─
n
以乙烯和丙烯混合物为单体,发生加聚反应,不可能得到的是 ( )
试一试
一、组成和结构
分子式:
电子式:
结构式:
结构简式:
C2H2
H∶C C∶H
H—C C—H
HC CH
乙炔的空间结构是直线型
乙 炔
特点:碳碳叁键
推测乙炔能发生哪些反应?
二、物理性质
无色、无味气体。密度是1.16克/升,比空气稍轻。微溶于水,易溶有机溶剂。
2C2H2 + 5O2 4CO2 + 2H2O
点燃
三、化学性质
1. 氧化反应
(1) 燃烧
(2)使酸性KMnO4溶液褪色
氧炔焰温度高达3000,切割焊接金属
伴有浓黑烟
2.加成反应
CH2=CH2
CH CH + H2
催化剂
CH2=CH2 + H2
催化剂
CH3 CH3
使溴水褪色
3.加聚反应
(特征反应)(1:2)
nCH CH
加温、加压
催化剂
CH=CH
n
加聚反应:导电塑料——聚乙炔
不宜使用聚氯乙烯制品
直接盛装食物。
聚氯乙烯
CH2=CHCl
CH CH + HCl
催化剂
氯乙烯
(二)乙炔的实验室制法
3、发生装置:
1、药品:
水或饱和食盐水
碳化钙(CaC2、俗名:电石)
2、反应原理:
CaC2+ 2H2O
Ca(OH)2+C2H2
微溶
固+液 气
(1)仪器:平底烧瓶(锥形瓶或广口瓶)+分液漏斗
(2)与制H2,CO2,NO,NO2的装置相同
5、收集方法:
排水集气法
不用排气法收集乙炔,因乙炔易燃,混入空气点燃易发生爆炸。
4、净化:
[注意〕
1、用块状CaC2而不用粉末状;用饱和食盐水代替水(降低水的含量),以得到平稳的乙炔气流。
2、不能用启普发生器制乙炔
原因:(1)反应剧烈,难以控制反应速率
(2)反应放出大量热,易使启普发生器发生炸裂
(3)生成物Ca(OH)2微溶于水,易形成糊状泡沫堵塞导气管和球形漏斗。
3、在广口瓶内导管口放置一团棉花其作用:
避免生成的Ca(OH)2糊状物泡沫堵塞导管。
涉及到“棉花团”的化学实验有哪些?
4、电石和水反应生成乙炔的同时,生成H2S、PH3等有臭味的气体,除杂试剂:CuSO4溶液、NaOH溶液
炔烃
CH≡CH
CH≡C-CH3
CH≡C-CH2-CH3
CH3-C≡C-CH3
1、结构特点:
2、通式:
(1)有1个C≡C
(2)链状
CnH2n-2 ( n≥2 )
乙炔
丙炔
1-丁炔
2-丁炔
乙烷、乙烯和乙炔的比较
乙烷 乙烯 乙炔
分子式 C2H6 C2H4 C2H2
结构式 H-C C-H
空间结构 四面体 平面结构 直线型
与酸性高锰酸钾溶液 不反应 氧化反应 氧化反应
与溴水 不反应 加成反应 加成反应
与卤素单质 (取代)反应 不反应 不反应
烷烃 烯烃 炔烃
定义 碳原子之间都以 C-C单键 结合的链状烃
通式 CnH2n+2
类别 饱和烃
分子中含有 碳碳双键的链烃
分子中含有碳碳叁键的链烃
CnH2n (n ≥ 2)
(含一个双键)
CnH2n-2 (n ≥ 2)
(含一个叁键)
不饱和烃
不饱和烃
烯烃和炔烃的命名
1、将含有双键或叁键的最长碳链作为主链,称为“某烯”或“某炔”。
2、从距离双键或叁键最近的一端给主链上的碳原子依次编号。
3、用阿拉伯数字标明双键或叁键的位置(只需标明双键或叁键碳原子编号较小的数字)。用“二”“三”等表示双键或叁键的个数。
CH2=CH-CH2-CH3
丁烯
CH3-C≡C-CH2-CH3
2-戊炔
H3C=C-CH-CH=CH-CH3
CH2CH3
2-乙基-2,4-己二烯
1
2
3
4
5
6
1-
与烷烃类似
H2C≡C-CH2-CH-CH3
CH3
戊炔
1-
4-甲基-
练一练
2,4-二甲基-2-戊烯
CH2=CH-CH=CH2
1,3-丁二烯
4-甲基-3-乙基-2-戊烯
类 别 结 构 特 点 主 要 性 质
烷烃 单键 (C-C) 链状
烯烃 双键 (C=C)
炔烃 叁键 (C C)
小结:结构和性质
1.稳定:通常情况下不与强 酸、强碱、强氧
化剂反应 2.取代反应(卤代)3.氧化反应
(燃烧) 4.加热分解
1.加成反应(加H2、X2 、HX 、 H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化)
3.加聚反应
1.加成反应(加H2、X2、HX、H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化
3.加聚反应
(2)写出其与Br2按1:1加成的化学方程式。
1,3-丁二烯的结构简式为:CH2=CH-CH=CH2,
思考:(1) 1,3-丁二烯能否使酸性KMnO4溶液和溴水褪色。
2、1mol某链烃最多能和2molHCl发生加成反应,生成1mol氯代烷,1mol该氯代烷能和6molCl2发生取代反应,生成只含有碳元素和氯元素的氯代烃,该烃可能是( )
A.CH3CH=CH2 B. CH3C≡CH
C.CH3CH2C≡CH D. CH2=CHCH=CH2
试一试
1、定义:不含有苯环的烃
一、脂肪烃:
脂肪烃
饱和烃:不含不饱和链
烷烃
烯烃
炔烃
环烷烃
环烯烃
-----
CH4
CH2=CH2
CH≡CH
CnH2n+2
CnH2n
CnH2n-2
CnH2n
CnH2n-2
二、脂肪烃的物理性质
2、都属分子晶体,熔沸点较低。碳原子数越多,相对分子质量越大,密度越大,熔沸点逐渐升高。
4、常温常压下,C4以下的脂肪烃为气态, C5-C16之间的一般为液态, C17以上的一般是固体。
1、难溶于水,易溶于有机溶剂,密度都比水小。
3、碳原子数相同,支链越多,其熔沸点越低。
(一)氧化反应
2、 不能使酸性高锰酸钾溶液褪色,
能使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液鉴别 和 。
除杂:CH4(C2H4)或 CH4(C2H2)
烷烃
饱和烃
烯烃、炔烃
溴水
三、脂肪烃的化学性质
不饱和烃
CxHy+(x+ )O2 xCO2+ H2O
1 、燃烧
[注意]点燃前要验纯
含碳量越高,燃烧越不充分,黑烟越浓,火焰越明亮
乙炔氧焰温度可达3000℃ 以上,可用焰焊接和切割金属。
(二)特征反应
取代反应
烷烃
四、脂肪烃的化学性质
1、定义:有机物分子中某些原子或原子团被其它原子或原子团所代替的反应。
2、条件:纯净的卤素,光照
【活动与探究】写出C5H12与氯气的第一步反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
CH3CH3+Br2
光
CH3CH2Br +HBr
讨论:此反应是否适合制氯乙烷?
1mol乙烷完全取代需氯气多少?
(二)特征反应
四、脂肪烃的化学性质
烯烃、炔烃
加成反应
定义:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
(与H2、Br2、HX、H2O等)
CH2==CH2+Br2 CH2BrCH2Br
使溴水褪色
CH2==CH2+H2O CH3CH2OH
催化剂
加压、加热
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
CH≡CH+2H2→CH3CH3
催化
烯烃、炔烃
加聚反应
加聚反应:通过加成反应聚合成高分子化合物的反应。
导电塑料——聚乙炔
(二)特征反应
四、脂肪烃的化学性质
单体
链节
聚合度
混合物
聚乙烯
1、写出下列物质的加聚反应方程式
(1)nCH3CH=CHCH2CH3
催化剂
(2)以乙烯和丙烯为原料1:1加聚合成塑料
[ CH2-CH ]
n
C6H5
|
[ CH2-CH=C-CH2 ]
n
Cl
|
[ CH2-CH2-CH-CH2 ]
n
CH3
|
2、找出下列高聚物的单体
热分解
CH4 C +2H2
1000℃以上
生产工业原料焦炭、氢气
C16H34 C8H18 +C8H16
Δ
裂化:生产轻质油
C4H10 C2H4+C2H6
△
C4H10 CH4+C3H6
△
裂解:得到短链的不饱和烃
四、脂肪烃的化学性质
类 别 结 构 特 点 主 要 性 质
烷烃 单键 (C-C) 链状
烯烃 双键 (C=C)
炔烃 叁键 (C C)
小结:结构和性质
1.稳定:通常情况下不与强 酸、强碱、强氧
化剂反应 2.取代反应(卤代)3.氧化反应
(燃烧) 4.加热分解
1.加成反应(加H2、X2 、HX 、 H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化)
3.加聚反应
1.加成反应(加H2、X2、HX、H2O)
2.氧化反应(燃烧;被KMnO4[H+]氧化
3.加聚反应
练习1、1 mol丙烷在光照下,最多可与多少摩尔Cl2发生取代
A、2 mol B、4 mol
C、8 mol D、10 mol
C
2、 下列关于乙烯和乙烷相比较的各说法中,不正确的是
A.乙烯是不饱和烃,乙烷是饱和烃
B.乙烯能使高锰酸钾酸性溶液和溴水褪色,乙烷则不能
C.乙烯分子中碳碳双键的键能是乙烷分子中碳碳单
键的键能的两倍,因此乙烯比乙烷稳定
D.乙烯分子为平面形结构,乙烷分子为立体结构
C
3、关于甲烷、乙烯、乙炔三种有机物的说法正确的是
A 燃烧时都有浓烟生成
B 燃烧都生成水和二氧化碳
C 都可发生加成反应
D 都是无色无味的气体
B
4、某气态烃1mol能与2mol HCl氯化氢完全加成,加成产物分子上的氢原子又可被6mol Cl2取代,则气态烃可能是
A、CH ≡CH B、CH2=CH2
C、CH≡C—CH3 D、CH2=C(CH3)CH3
C
1、物质的量相同的烃(CxHy)完全燃烧时,
物质的量相同的下列烃完全燃烧时耗氧量最多的是( )
A、C5H12 B、C6H14
C、C7H8 D、C8H8
D
一、有机物燃烧时耗氧量大小的比较:
耗氧量的大小决定于
2、相同质量的烃燃烧时
下列质量相同的烃完全燃烧时消耗氧气的量由多到少的顺序是 。
① ④ ③ ②
含氢质量分数越大,耗氧量越大。
C + O2 === CO2
4H + O2 === 2H2O
12g
32g
4g
32g
①CH4
③C2H4
②C2H2
④C2H6
各分子式改写成CHx形式
CH4
CH
CH2
CH3
12g
96g
两种烃组成的的混合物,其平均组成为C1.6H2.8,从C平均个数分析,有一种烃的C原子数必定是___个,故可以确定该烃应该是______,再由H平均个数分析,另外一种烃的H原子数必定是____个,则另外一种烃应该是_______,前后两种烃的物质的量比为_____。
1
CH4
2
C2H2
2:3
CH4
1
C2H2
2
1.6
0.6
0.4
C
2:3
C1.1H3.8
9:1
乙烷和乙烯的混合气体3L完全燃烧需相同状况下的O210L,求乙烷和乙烯的体积比______
乙烷C2H6
3.5aL
乙烯C2H4
3bL
aL
bL
a+b=3
3.5a+3b=10
a=2
b=1
2:1
O2
乙烷C2H6
10.5L
乙烯C2H4
9L
3L
3L
O2
10
0.5
1
十字交叉法
2:1
两种气态烃的混合气体共1L,在空气中燃烧生成1.5LCO2气体和2L水蒸气(气体体积均在相同状况下测定),关于该混合气体的说法正确的是
A、一定含有乙烯
B、一定含有甲烷,不一定含乙烷
C、一定含有乙烷,
D、一定含有甲烷,一定不含有乙烷
D
在120℃时,以任意质量比混合的烃的混合物和过量的O2在一密闭容器中完全反应,测得反应前后体系内的压强没有变化,则该混合烃可能是( )
A.CH4和C2H4 B.CH4和C2H6
C.C2H4和C2H6 D.C2H2和C3H6
二、有机物分子式的计算
1、相对分子质量(摩尔质量)的计算
(1)
(2)
M=ρ×Vm
(3)
M1=M2×相对密度
2、分子式的计算
(1)C、H等元素的质量、质量比、质量分数
(2)燃烧产物(CO2、H2O)
1.某气态烃含C 85.7%,含H 14.3%,在标准状况下的密度是2.5g/L。该烃能使酸性高锰酸钾溶液或溴水褪色。求该烃的分子式,并写出它的各种同分异构体的结构简式。
M=ρ×Vm
=2.5g/L×22.4L/mol
=56g/mol
设该烃分子式为CxHy
12x
56
=85.7%
x=4
y
56
=14.3%
y=8
分子式为C4H8
练习3.标准状况下某气态烃0.56L,经充分燃烧后,将生成的气体通过盛有足量浓H2SO4的洗瓶,浓H2SO4质量增重1.8g,然后再通过碱石灰,气体被完全吸收,碱石灰质量增加3.3g,求该烃的分子式。
C3H8
练习2.某烃中碳、氢元素的质量比是24:5,该烃相对于氢气的密度为29,则该烃的最简式是 ,摩尔质量是 ,分子式为 。
C2H5
58 g/mol
C4H10
