第六单元课题3二氧化碳和一氧化碳(2课时)课件 -2022-2023学年九年级化学人教版上册(共42张PPT)
文档属性
| 名称 | 第六单元课题3二氧化碳和一氧化碳(2课时)课件 -2022-2023学年九年级化学人教版上册(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-01 22:19:25 | ||
图片预览








文档简介
(共42张PPT)
导入新知
有一种物质,农民说它是“植物的粮食”;消防官兵赞美它是“灭火先锋”;环境学家却指责它是造成全球变暖的“罪魁祸首” 。
同学们,我们先来猜一个谜语,好不好
谜底:
二氧化碳(CO2)
第六单元 碳和碳的氧化物
课题3 二氧化碳和一氧化碳
(第一课时)
实验一
现象
分析
塑料瓶变瘪了。
二氧化碳能溶于水。
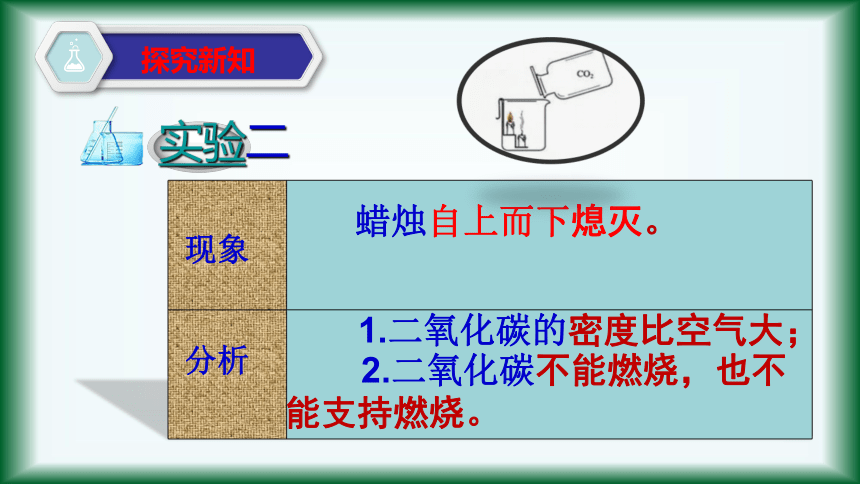
实验二
现象
分析
蜡烛自上而下熄灭。
1.二氧化碳的密度比空气大;
2.二氧化碳不能燃烧,也不能支持燃烧。
探究新知
颜色 气味 状态 密度(与空气比较) 溶解性 固态
二氧化碳
能溶于水
比空气的密度大
气体
无味
无色
一、二氧化碳的物理性质
干冰
向小花上喷稀醋酸
紫色的石蕊花变为红色
酸可以使紫色石蕊变为红色
稀醋酸溶液呈酸性
现象:
结论:
解释:
紫色石蕊溶液,遇酸性溶液变成红色。
石蕊溶液
将二氧化碳气体通入紫色石蕊溶液
紫色的石蕊花变为红色
现象:
紫色石蕊试液
提出问题:
是什么物质使紫色石蕊试液变红?
是什么物质使紫色石蕊变红?
猜 想 实验方法 实验现象 分 析
1.水使石蕊变红
2.二氧化碳使石蕊变红
3.二氧化碳和水反应后的生成物使石蕊变红
二氧化碳和水反应后的生成物使石蕊溶液变红
水不能使石蕊溶液变红
二氧化碳不能使石蕊溶液变红
小花不
变色
小花不 变色
小花变为红色
CO2+H2O= H2CO3
实验:将第四朵小花烘干
红色的小花又变成紫色。
现象:
分析:
碳酸不稳定,容易分解。
H2CO3 =H2O +CO2↑
或
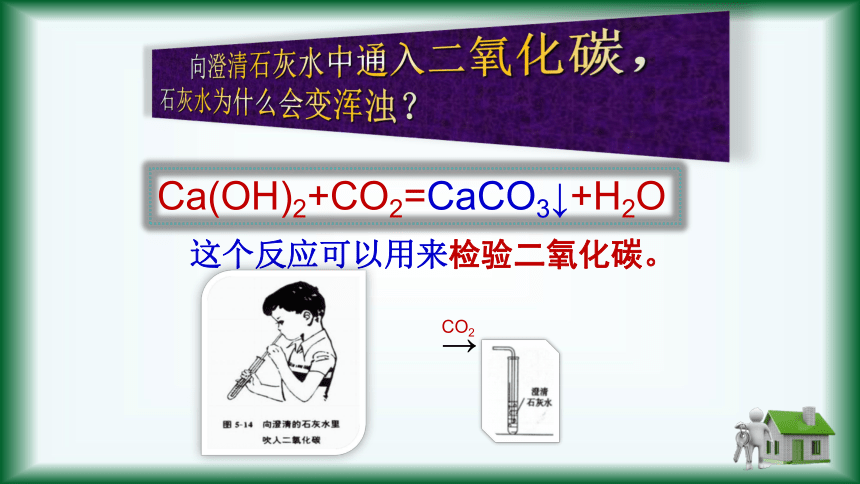
Ca(OH)2+CO2=CaCO3↓+H2O
向澄清石灰水中通入二氧化碳,石灰水为什么会变浑浊?
这个反应可以用来检验二氧化碳。
CO2
→
二氧化碳与氢氧化钠的反应
CO2 + 2NaOH = Na2CO3 + H2O
该反应用于吸收(除去)二氧化碳。
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
请试着写出二氧化碳和氢氧化钠的反应方程式
美国某地质勘探队,有一次在勘探油矿时,他们用钻探机往地下打孔,忽然从地下喷出一大堆像雪花一样的固体。好奇的队员上前滚雪球,结果手被冻伤。
【阅读材料】
二氧化碳在一定条件下可以变成固体,固体二氧化碳叫干冰,干冰升华会吸收大量的热。
干冰
人工降雨
舞台云雾
干冰的用途
食品的冷藏盒保鲜
血液制品的储存和运输
光合作用
气体肥料
化工原料
灭火
CO2的用途
1.如图:将一支盛有CO2 的试管倒立在一个装满水的烧杯中
看到 ,
原因是 。
2.如果将水换成石蕊试液,可以
看到 ,
原因 。
3.如果将水换成澄清的石灰水可以
看到 ,
原因 。
试管内液面上升
CO2 能溶于水,且能与水发生反应
试管内液面上升,同时上升的石蕊试液变红
CO2与水反应生成H2CO3
试管内液面上升,同时上升的石灰水变浑浊
CO2与石灰水反应生成不溶于水的CaCO3
【练习】
二氧化碳对人体健康的影响
空气中二氧化碳的体积分数/% 对人体健康的影响
1 使人感到气闷、头昏、心悸
4~5 使人感到气喘、头痛、眩晕
10 使人神志不清、呼吸停止,以致死亡
根据《健康报》1999年2月报道,河南省正阳县有位50多岁的农妇,到自家地窖中拿红薯时不幸身亡。在进入久未开启的菜窖或干涸的深井前,如何检验这些场所中二氧化碳的含量是否会对人的生命构成威胁?
进入久未开启的菜窖或干涸的深井前,先做灯火实验,一定要证明菜窖安全方可进入!
1.能产生“温室效应”的气体除了二氧化碳,还有那些?
大气中的二氧化碳就像温室的玻璃或塑料薄膜一样,既能让太阳光透过,又能使地面吸收的太阳光的热量不易向外散失,起到了对地球保温的作用,这种现象叫做温室效应。
能产生温室效应的气体除二氧化碳外,还有臭氧(O3)、甲烷(CH4)、氟氯代烷(商品名为氟利昂)等。
温室效应
a.改善燃料结构:减少用煤、石油、天然气等化石燃料,更多使用清洁能源,如太阳能、核能、风能和潮汐能等。
b.增强大自然的自净能力,如大力植树造林,禁止乱砍滥伐等。
c.提倡“低碳”生活。
3.如何防止温室效应进一步增强?
危害:
2.危害:全球变暖可能导致两极的冰川融化,使海平面上升,淹没部分沿海地区。也会导致土地沙漠化、沙城暴、农业减产等。
讨论
在日常生活中怎样做才算是“低碳”呢?将你的想法与同学交流,并努力去做。
答:双面使用纸张、减少使用一次性木筷、购物使用环保袋、以步代车、节约用电等。
1.某学生用下图装置制取二氧化碳,并试验它的性质,请回答下列问题
( 1 ) 装置B中出现的实验现象是:
紫色的石蕊试液变成红色
(2) 烧杯C中放有高低不同的燃着的蜡烛,实验中观察到的现象是_____的蜡烛先熄灭,说明二氧化碳具有______________和_______________________的性质。
低处
比空气的密度大
不能燃烧也不支持燃烧的性质
巩固提升
课堂小结
1.二氧化碳不燃烧,也不支持燃烧;二氧化碳能与水反应。
2.二氧化碳能使澄清石灰水变浑浊,这个反应可以用来氧化碳。
3. 二氧化碳是一种温室气体。人类应采取积极措施,防止温室效应进一步增强。
第六单元 碳和碳的氧化物
课题3 二氧化碳和一氧化碳
(第二课时)
碳元素有+2和+4价,所以碳的氧化物有一氧化碳和二氧化碳两种。1个CO2分子比1个CO分子多1个氧原子,这种分子结构的不同会给它们的性质带来哪些差异呢?
颜色 气味 状态 密度(与空气比较) 溶解性
二氧化碳
一氧化碳(CO)的物理性质
无色
无味
气体
比空气略小(与空气非常接近)
难溶于水
可用排水集气法
CO不能用向下排气法收集,尽管CO的密度比空气小,但其密度与空气相近,无色,无法知道气体是否集满,而且一氧化碳有毒,长时间收集会使实验者中毒。
注意:
根据一氧化碳的物理性质,我们在实验室应怎样收集它呢?
2CO + O2 = 2CO2
【视频】一氧化碳燃烧
现象:
点燃
(一)一氧化碳具有可燃性
一氧化碳(CO)的化学性质
燃烧时放出大量的热,火焰呈蓝色,烧杯内壁附着的澄清石灰水变浑浊。
一氧化碳是许多气体燃料如水煤气的主要成分。
用途:
注意:点燃CO之前一定要验纯。
C + O2 = CO2
CO2 + C = 2CO
2CO + O2 = 2CO2
点燃
高温
点燃
炭火中一氧化碳燃烧
煤炉中一氧化碳燃烧
2003年1月3日晚,仪陇县凤仪乡五台村四组村民张成全家里发生严重煤气中毒事故,造成6人中毒,其中二名儿童丧生。
一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧。当一氧化碳在空气中占到总体积的0.02%时,人在2 h~3h后就会出现中毒症状。
煤气中毒的生理过程:
(二)一氧化碳的毒性
冬天用煤火取暖时,怎样 才能防止煤气中毒?
1.装烟囱;
2.注意室内通风。
不对,因为一氧化碳难溶于水,也不与水发生化学反应。
【讨论】有人说在煤炉上放一壶水就能防止一氧化碳中毒,这种说法对吗?为什么?
【讨论】煤气厂为什么常在家用煤气(含有一氧化碳)中掺入微量具有难闻气味的气体 如发生煤气泄漏应当怎么办
因为一氧化碳无色无味,煤气泄露不易被察觉,所以煤气厂常在家用煤气中掺入微量具有难闻气味的气体。如果发生煤气泄漏,应立即关闭煤气阀门,然后开窗通风。此时千万不能开灯检查泄漏源和在室内打电话报警,因为开灯和打电话时会产生电火花引爆煤气。
(三)一氧化碳(CO)的还原性
【视频1】一氧化碳(CO)还原氧化铜(CuO)
实 验 步 骤 1. 防止CO不纯,点燃或加热后发生爆炸
2.先通入CO一段时间,然后点燃酒精灯,预热后,对装有CuO位置的玻璃管加热(实验前点燃最右端的酒精灯) 排出玻璃管中的 ,避免CO与空气混合,加热时发生爆炸
3.反应结束后,先停止加热,继续通入CO至玻璃管 防止
检查CO气体的纯度
冷却
被还原的铜再次被氧化成氧化铜
空气
CO“早出晚归”,酒精灯“迟到早退”
前者颠倒会爆炸,后者颠倒会氧化
【思考】
B装置作用为 ;
说明:利用CO还原金属氧化物的实验中,一定要进行尾气处理,否则会造成环境污染,处理方法:a.将多余CO点燃使其燃烧;b将多余CO收集再利用。
C装置为 。
尾气处理装置
检验生成的气体是二氧化碳
实验 现象 a.黑色粉末变成 b.产生的气体能使澄清石灰水 CuO失去氧变成红色的 ,具有 性;
CO 氧,变成CO2,
具有 性。
结论 CO具有 化学方程式为: 能夺得氧,使其他物质失去氧的性质为
【视频】一氧化碳(CO)还原氧化铜(CuO)
CO +CuO === Cu + CO2
变浑浊
Cu
氧化
还原
得到
红色
还原性
还原性
该反应不是置换反应
CO的用途
请写出CO还原氧化铁的化学方程式
CO+
Fe2O3 ====
Fe +
CO2
3
2
3
高温
还原性
冶炼金属(如炼铁)
决定
反映
【思考】你能不能将一氧化碳(CO)还原氧化铜(CuO)的实验装置稍作改进,一方面能避免CO 对环境的污染,另一方面能充分利用能源。
一氧化碳和二氧化碳化学性质的相似性
可燃性 有可燃性:
还原性
与水反应
与澄清石灰水反应
有无毒性
有还原性:
2CO + O2 = 2CO2
点燃
没有还原性
一般情况下既不燃烧,也不支持燃烧
CO +CuO === Cu + CO2
不能与水反应
与水反应CO2+H2O= H2CO3
不能与澄清
石灰水反应
能与澄清石灰水反应
有毒
无毒
Ca(OH)2+CO2=CaCO3↓+H2O
一氧化碳和二氧化碳涉及到的除杂专题
物质 杂质 方法
CO CO2
CO2 CO
CO2 H2O
CO2 HCl
将气体通入过量的氢氧化钠溶液
将气体通过灼热的氧化铜
通过浓硫酸
依次通过饱和的碳酸氢钠溶液,
浓硫酸
一氧化碳和二氧化碳涉及到的除杂专题
物质 杂质 方法
CuO C
N2 O2
O2 H2O
CaO CaCO3
加热
通过灼热的铜网
通过浓硫酸
高温煅烧
导入新知
有一种物质,农民说它是“植物的粮食”;消防官兵赞美它是“灭火先锋”;环境学家却指责它是造成全球变暖的“罪魁祸首” 。
同学们,我们先来猜一个谜语,好不好
谜底:
二氧化碳(CO2)
第六单元 碳和碳的氧化物
课题3 二氧化碳和一氧化碳
(第一课时)
实验一
现象
分析
塑料瓶变瘪了。
二氧化碳能溶于水。
实验二
现象
分析
蜡烛自上而下熄灭。
1.二氧化碳的密度比空气大;
2.二氧化碳不能燃烧,也不能支持燃烧。
探究新知
颜色 气味 状态 密度(与空气比较) 溶解性 固态
二氧化碳
能溶于水
比空气的密度大
气体
无味
无色
一、二氧化碳的物理性质
干冰
向小花上喷稀醋酸
紫色的石蕊花变为红色
酸可以使紫色石蕊变为红色
稀醋酸溶液呈酸性
现象:
结论:
解释:
紫色石蕊溶液,遇酸性溶液变成红色。
石蕊溶液
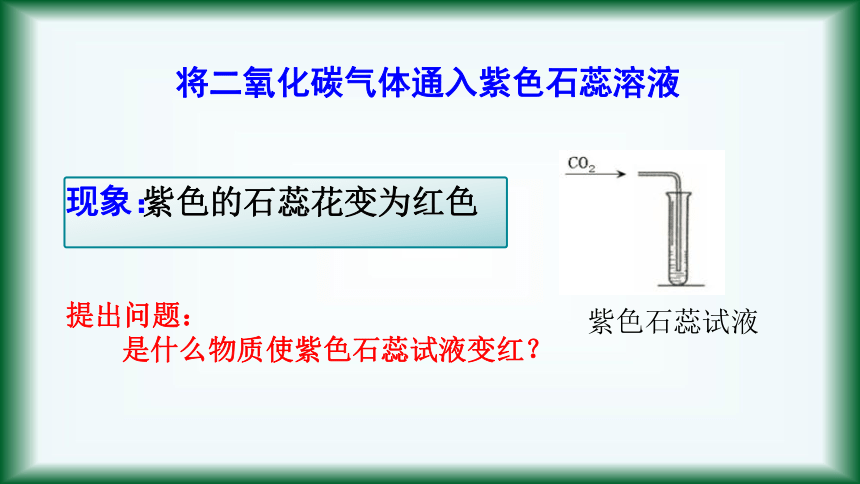
将二氧化碳气体通入紫色石蕊溶液
紫色的石蕊花变为红色
现象:
紫色石蕊试液
提出问题:
是什么物质使紫色石蕊试液变红?
是什么物质使紫色石蕊变红?
猜 想 实验方法 实验现象 分 析
1.水使石蕊变红
2.二氧化碳使石蕊变红
3.二氧化碳和水反应后的生成物使石蕊变红
二氧化碳和水反应后的生成物使石蕊溶液变红
水不能使石蕊溶液变红
二氧化碳不能使石蕊溶液变红
小花不
变色
小花不 变色
小花变为红色
CO2+H2O= H2CO3
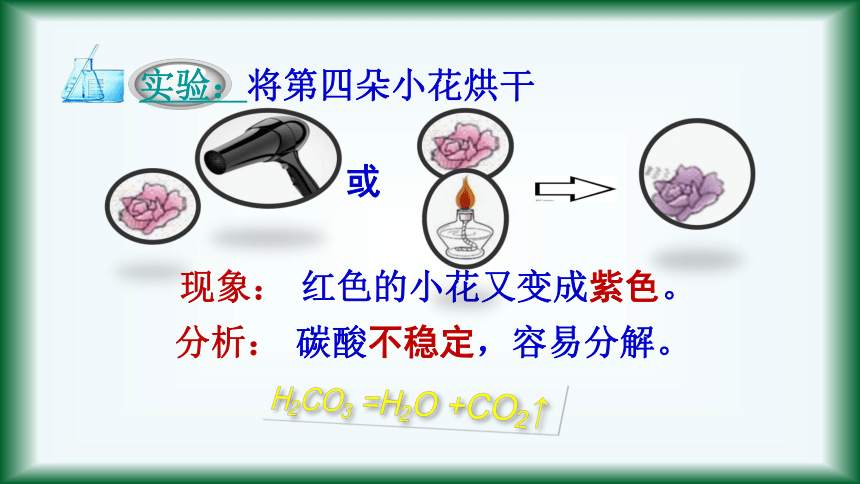
实验:将第四朵小花烘干
红色的小花又变成紫色。
现象:
分析:
碳酸不稳定,容易分解。
H2CO3 =H2O +CO2↑
或
Ca(OH)2+CO2=CaCO3↓+H2O
向澄清石灰水中通入二氧化碳,石灰水为什么会变浑浊?
这个反应可以用来检验二氧化碳。
CO2
→
二氧化碳与氢氧化钠的反应
CO2 + 2NaOH = Na2CO3 + H2O
该反应用于吸收(除去)二氧化碳。
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
请试着写出二氧化碳和氢氧化钠的反应方程式
美国某地质勘探队,有一次在勘探油矿时,他们用钻探机往地下打孔,忽然从地下喷出一大堆像雪花一样的固体。好奇的队员上前滚雪球,结果手被冻伤。
【阅读材料】
二氧化碳在一定条件下可以变成固体,固体二氧化碳叫干冰,干冰升华会吸收大量的热。
干冰
人工降雨
舞台云雾
干冰的用途
食品的冷藏盒保鲜
血液制品的储存和运输
光合作用
气体肥料
化工原料
灭火
CO2的用途
1.如图:将一支盛有CO2 的试管倒立在一个装满水的烧杯中
看到 ,
原因是 。
2.如果将水换成石蕊试液,可以
看到 ,
原因 。
3.如果将水换成澄清的石灰水可以
看到 ,
原因 。
试管内液面上升
CO2 能溶于水,且能与水发生反应
试管内液面上升,同时上升的石蕊试液变红
CO2与水反应生成H2CO3
试管内液面上升,同时上升的石灰水变浑浊
CO2与石灰水反应生成不溶于水的CaCO3
【练习】
二氧化碳对人体健康的影响
空气中二氧化碳的体积分数/% 对人体健康的影响
1 使人感到气闷、头昏、心悸
4~5 使人感到气喘、头痛、眩晕
10 使人神志不清、呼吸停止,以致死亡
根据《健康报》1999年2月报道,河南省正阳县有位50多岁的农妇,到自家地窖中拿红薯时不幸身亡。在进入久未开启的菜窖或干涸的深井前,如何检验这些场所中二氧化碳的含量是否会对人的生命构成威胁?
进入久未开启的菜窖或干涸的深井前,先做灯火实验,一定要证明菜窖安全方可进入!
1.能产生“温室效应”的气体除了二氧化碳,还有那些?
大气中的二氧化碳就像温室的玻璃或塑料薄膜一样,既能让太阳光透过,又能使地面吸收的太阳光的热量不易向外散失,起到了对地球保温的作用,这种现象叫做温室效应。
能产生温室效应的气体除二氧化碳外,还有臭氧(O3)、甲烷(CH4)、氟氯代烷(商品名为氟利昂)等。
温室效应
a.改善燃料结构:减少用煤、石油、天然气等化石燃料,更多使用清洁能源,如太阳能、核能、风能和潮汐能等。
b.增强大自然的自净能力,如大力植树造林,禁止乱砍滥伐等。
c.提倡“低碳”生活。
3.如何防止温室效应进一步增强?
危害:
2.危害:全球变暖可能导致两极的冰川融化,使海平面上升,淹没部分沿海地区。也会导致土地沙漠化、沙城暴、农业减产等。
讨论
在日常生活中怎样做才算是“低碳”呢?将你的想法与同学交流,并努力去做。
答:双面使用纸张、减少使用一次性木筷、购物使用环保袋、以步代车、节约用电等。
1.某学生用下图装置制取二氧化碳,并试验它的性质,请回答下列问题
( 1 ) 装置B中出现的实验现象是:
紫色的石蕊试液变成红色
(2) 烧杯C中放有高低不同的燃着的蜡烛,实验中观察到的现象是_____的蜡烛先熄灭,说明二氧化碳具有______________和_______________________的性质。
低处
比空气的密度大
不能燃烧也不支持燃烧的性质
巩固提升
课堂小结
1.二氧化碳不燃烧,也不支持燃烧;二氧化碳能与水反应。
2.二氧化碳能使澄清石灰水变浑浊,这个反应可以用来氧化碳。
3. 二氧化碳是一种温室气体。人类应采取积极措施,防止温室效应进一步增强。
第六单元 碳和碳的氧化物
课题3 二氧化碳和一氧化碳
(第二课时)
碳元素有+2和+4价,所以碳的氧化物有一氧化碳和二氧化碳两种。1个CO2分子比1个CO分子多1个氧原子,这种分子结构的不同会给它们的性质带来哪些差异呢?
颜色 气味 状态 密度(与空气比较) 溶解性
二氧化碳
一氧化碳(CO)的物理性质
无色
无味
气体
比空气略小(与空气非常接近)
难溶于水
可用排水集气法
CO不能用向下排气法收集,尽管CO的密度比空气小,但其密度与空气相近,无色,无法知道气体是否集满,而且一氧化碳有毒,长时间收集会使实验者中毒。
注意:
根据一氧化碳的物理性质,我们在实验室应怎样收集它呢?
2CO + O2 = 2CO2
【视频】一氧化碳燃烧
现象:
点燃
(一)一氧化碳具有可燃性
一氧化碳(CO)的化学性质
燃烧时放出大量的热,火焰呈蓝色,烧杯内壁附着的澄清石灰水变浑浊。
一氧化碳是许多气体燃料如水煤气的主要成分。
用途:
注意:点燃CO之前一定要验纯。
C + O2 = CO2
CO2 + C = 2CO
2CO + O2 = 2CO2
点燃
高温
点燃
炭火中一氧化碳燃烧
煤炉中一氧化碳燃烧
2003年1月3日晚,仪陇县凤仪乡五台村四组村民张成全家里发生严重煤气中毒事故,造成6人中毒,其中二名儿童丧生。
一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧。当一氧化碳在空气中占到总体积的0.02%时,人在2 h~3h后就会出现中毒症状。
煤气中毒的生理过程:
(二)一氧化碳的毒性
冬天用煤火取暖时,怎样 才能防止煤气中毒?
1.装烟囱;
2.注意室内通风。
不对,因为一氧化碳难溶于水,也不与水发生化学反应。
【讨论】有人说在煤炉上放一壶水就能防止一氧化碳中毒,这种说法对吗?为什么?
【讨论】煤气厂为什么常在家用煤气(含有一氧化碳)中掺入微量具有难闻气味的气体 如发生煤气泄漏应当怎么办
因为一氧化碳无色无味,煤气泄露不易被察觉,所以煤气厂常在家用煤气中掺入微量具有难闻气味的气体。如果发生煤气泄漏,应立即关闭煤气阀门,然后开窗通风。此时千万不能开灯检查泄漏源和在室内打电话报警,因为开灯和打电话时会产生电火花引爆煤气。
(三)一氧化碳(CO)的还原性
【视频1】一氧化碳(CO)还原氧化铜(CuO)
实 验 步 骤 1. 防止CO不纯,点燃或加热后发生爆炸
2.先通入CO一段时间,然后点燃酒精灯,预热后,对装有CuO位置的玻璃管加热(实验前点燃最右端的酒精灯) 排出玻璃管中的 ,避免CO与空气混合,加热时发生爆炸
3.反应结束后,先停止加热,继续通入CO至玻璃管 防止
检查CO气体的纯度
冷却
被还原的铜再次被氧化成氧化铜
空气
CO“早出晚归”,酒精灯“迟到早退”
前者颠倒会爆炸,后者颠倒会氧化
【思考】
B装置作用为 ;
说明:利用CO还原金属氧化物的实验中,一定要进行尾气处理,否则会造成环境污染,处理方法:a.将多余CO点燃使其燃烧;b将多余CO收集再利用。
C装置为 。
尾气处理装置
检验生成的气体是二氧化碳
实验 现象 a.黑色粉末变成 b.产生的气体能使澄清石灰水 CuO失去氧变成红色的 ,具有 性;
CO 氧,变成CO2,
具有 性。
结论 CO具有 化学方程式为: 能夺得氧,使其他物质失去氧的性质为
【视频】一氧化碳(CO)还原氧化铜(CuO)
CO +CuO === Cu + CO2
变浑浊
Cu
氧化
还原
得到
红色
还原性
还原性
该反应不是置换反应
CO的用途
请写出CO还原氧化铁的化学方程式
CO+
Fe2O3 ====
Fe +
CO2
3
2
3
高温
还原性
冶炼金属(如炼铁)
决定
反映
【思考】你能不能将一氧化碳(CO)还原氧化铜(CuO)的实验装置稍作改进,一方面能避免CO 对环境的污染,另一方面能充分利用能源。
一氧化碳和二氧化碳化学性质的相似性
可燃性 有可燃性:
还原性
与水反应
与澄清石灰水反应
有无毒性
有还原性:
2CO + O2 = 2CO2
点燃
没有还原性
一般情况下既不燃烧,也不支持燃烧
CO +CuO === Cu + CO2
不能与水反应
与水反应CO2+H2O= H2CO3
不能与澄清
石灰水反应
能与澄清石灰水反应
有毒
无毒
Ca(OH)2+CO2=CaCO3↓+H2O
一氧化碳和二氧化碳涉及到的除杂专题
物质 杂质 方法
CO CO2
CO2 CO
CO2 H2O
CO2 HCl
将气体通入过量的氢氧化钠溶液
将气体通过灼热的氧化铜
通过浓硫酸
依次通过饱和的碳酸氢钠溶液,
浓硫酸
一氧化碳和二氧化碳涉及到的除杂专题
物质 杂质 方法
CuO C
N2 O2
O2 H2O
CaO CaCO3
加热
通过灼热的铜网
通过浓硫酸
高温煅烧
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
