第六单元课题2二氧化碳制取的研究 课件 -2022-2023学年九年级化学人教版上册(共16张PPT)
文档属性
| 名称 | 第六单元课题2二氧化碳制取的研究 课件 -2022-2023学年九年级化学人教版上册(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 388.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-01 22:28:53 | ||
图片预览



文档简介
(共16张PPT)
二氧化碳制取的研究
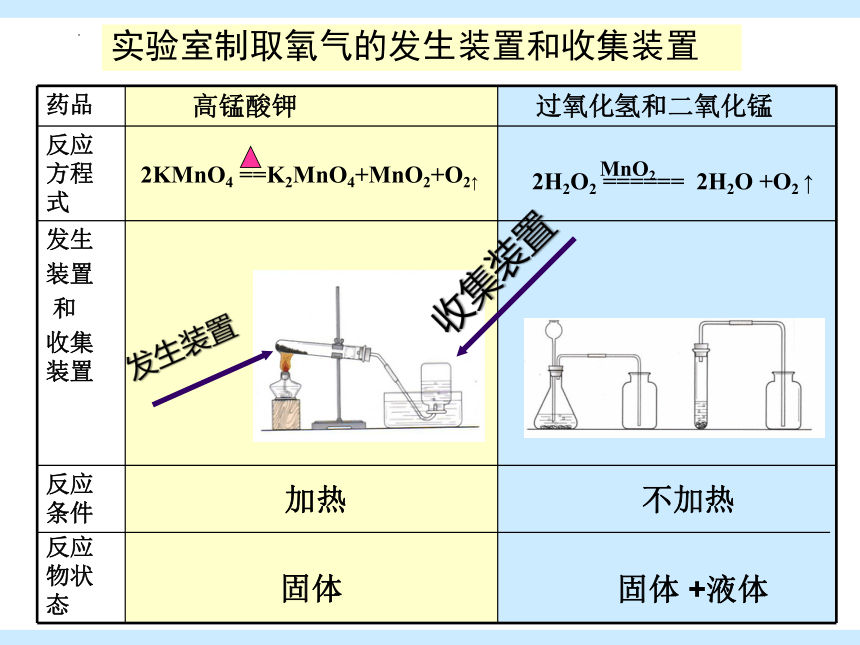
实验室制取氧气的发生装置和收集装置
药品 高锰酸钾 过氧化氢和二氧化锰
反应方程式
发生 装置 和 收集装置
反应条件 反应物状态 加热 固体 不加热
固体 +液体
2KMnO4 ==K2MnO4+MnO2+O2↑
2H2O2 ====== 2H2O +O2 ↑
MnO2
发生装置
收集装置
1、实验室制取气体的装置由两部分装置:
一、发生装置
二、收集装置
发生装置
收集装置
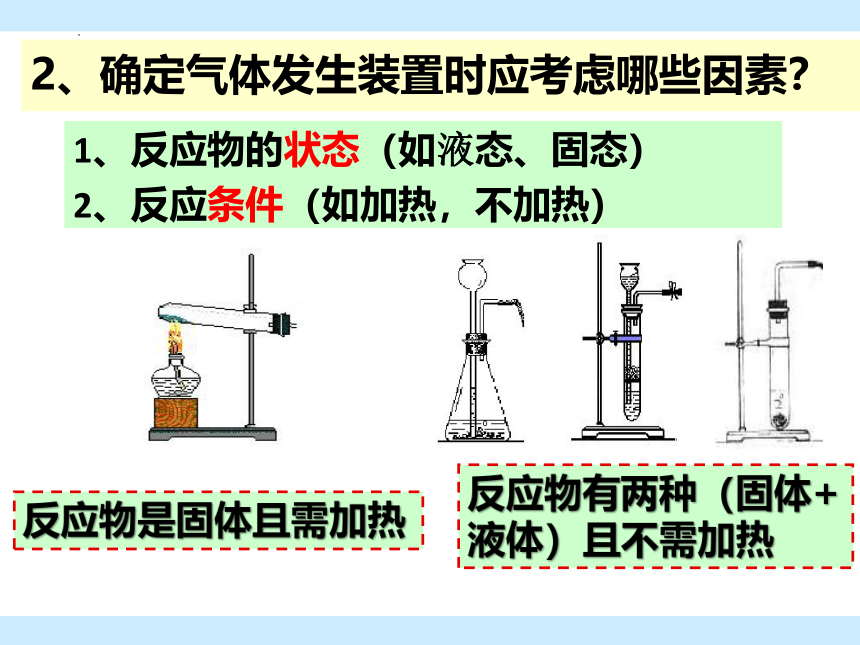
2、确定气体发生装置时应考虑哪些因素?
1、反应物的状态(如液态、固态)
2、反应条件(如加热,不加热)
反应物是固体且需加热
反应物有两种(固体+液体)且不需加热
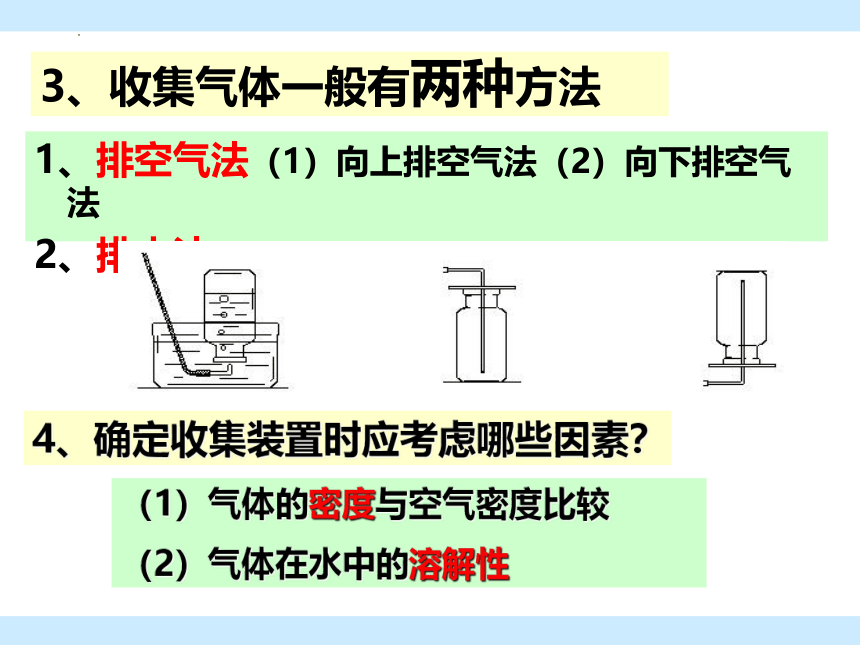
3、收集气体一般有两种方法
1、排空气法(1)向上排空气法(2)向下排空气法
2、排水法
4、确定收集装置时应考虑哪些因素?
(1)气体的密度与空气密度比较
(2)气体在水中的溶解性
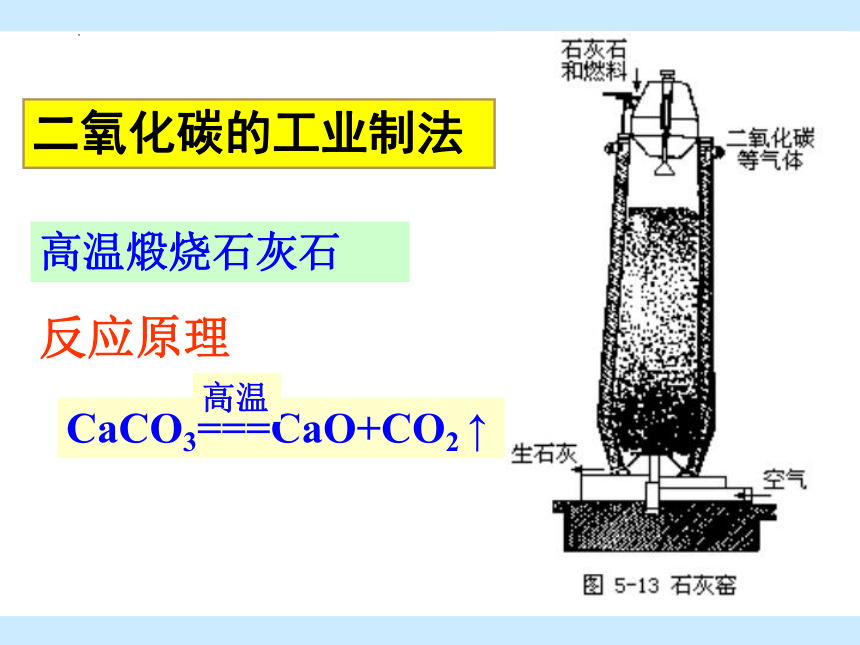
高温煅烧石灰石
CaCO3===CaO+CO2 ↑
高温
反应原理
二氧化碳的工业制法
实验室制取CO2的反应原理:
实验编号 实验药品 实验现象
1 碳酸钠和 稀盐酸
2 大理石和 稀硫酸
3 大理石和 稀盐酸
冒出大量气泡、反应速率非常快
冒出少量气泡、反应速率慢、且反应一会儿就结束。
冒出大量气泡、反应速率适中
药品:碳酸钠( Na2CO3 )、大理石( CaCO3 )
稀盐酸(HCl)、稀硫酸(H2SO4)
问题与讨论:
讨论:1、为什么硫酸与大理石反应难于进行?
2、能否用浓盐酸代替稀盐酸?
3、为什么不用粉末状的碳酸钙或碳酸钠?
生成的硫酸钙微溶于水,会覆盖在大理石表面,阻止反应进行。
浓盐酸易挥发,使制得气体不纯。
反应速率太快,不便于控制。
CaCO3+ H2SO4 === CaSO4 +H2O+CO2↑
总反应:
CaCO3+2HCl==CaCl2 + H2O + CO2
二氧化碳的实验室制法
1、药品:
石灰石或大理石(主要成份为CaCO3)
2、反应原理:
CaCO3+2HCl== H2CO3+CaCl2
H2CO3== H2O+CO2
稀盐酸
A
B
C
D
E
F
实验探究二:实验室制取CO2装置的确定
1、发生装置的确定
2、收集装置的确定
信息提示:CO2的密度大于空气且能溶于水
验满:将燃烧的细木条放在集气瓶口,木条熄灭说明CO2集满。
检验:将气体通入澄清石灰水,或往气体中滴加澄清石灰水,振荡后石灰水变浑浊,说明该气体是CO2。
检验方法
澄清石灰水
变浑浊
验满方法
1、 明确了反应原理,如何选择装置?
2、具体的实验操作步骤?
3、如何检验和验满制得的二氧化碳?
根据O2的实验室制法,思考讨论以下问题:
2、实验室制取二氧化碳一般有五个步骤:①检验装置的气密性,②按要求装好仪器,③向长颈漏斗注入酸液,④向广口瓶中放入大理石小块,⑤收集气体.下列正确操作顺序是( )
A.①②③④⑤ B.②①④③⑤
C.①④②③⑤ D.②③④①⑤
B
1、下列关于实验室制取二氧化碳的说法中,不正确的是( )
A、实验室制取H2与CO2,的发生装置相同,因为都是固体,液体反应且不要加热
B、不能用排水法收集CO2,因为它能溶于水
C、不能选用石灰石与稀硫酸作原料,因为二者不反应
D、不选用Na2CO3粉末与稀盐酸反应,因为二者反应速率太快
C
3、下图是某同学制取二氧化碳的装置图,请说出其中的错误:
1、________________________;
2、 ________________________;
3、 ________________________;
4、实验室制取氧气和二氧化碳都必须用到的仪器是:
A .酒精灯 B. 锥形瓶 C. 铁架台 D. 导气管
长颈漏斗下端没有插入液面以下
锥形瓶中的导管插入到了液面以下
应该用向上排空气法收集气体
√
A
1 实验室制取氧气的发生装置应选择______,收集装置应选择______。
2 实验室制取氢气的发生装置应选择______,收集装置应选择______。
3 实验室制取二氧化碳的发生装置应选择______,收集装置应选择______。
B
D
E
C
F
A
D E
B C
E F
B C
D
5、选择恰当的填
二、CO2气体的检验与验满:
1、检验:将生成的气体通入澄清的石灰水,若石灰水变浑浊,证明该气体是二氧化碳。
2、验满:用燃着的木条靠近集气瓶口,若木条熄灭,说明二氧化碳已经收集满了。
三、气体实验室制法的设计思路
一、实验室制取CO2的装置:
1、制取装置:
2、收集方法:常用向上排空气法
不加热
固+液
总结
二氧化碳制取的研究
实验室制取氧气的发生装置和收集装置
药品 高锰酸钾 过氧化氢和二氧化锰
反应方程式
发生 装置 和 收集装置
反应条件 反应物状态 加热 固体 不加热
固体 +液体
2KMnO4 ==K2MnO4+MnO2+O2↑
2H2O2 ====== 2H2O +O2 ↑
MnO2
发生装置
收集装置
1、实验室制取气体的装置由两部分装置:
一、发生装置
二、收集装置
发生装置
收集装置
2、确定气体发生装置时应考虑哪些因素?
1、反应物的状态(如液态、固态)
2、反应条件(如加热,不加热)
反应物是固体且需加热
反应物有两种(固体+液体)且不需加热
3、收集气体一般有两种方法
1、排空气法(1)向上排空气法(2)向下排空气法
2、排水法
4、确定收集装置时应考虑哪些因素?
(1)气体的密度与空气密度比较
(2)气体在水中的溶解性
高温煅烧石灰石
CaCO3===CaO+CO2 ↑
高温
反应原理
二氧化碳的工业制法
实验室制取CO2的反应原理:
实验编号 实验药品 实验现象
1 碳酸钠和 稀盐酸
2 大理石和 稀硫酸
3 大理石和 稀盐酸
冒出大量气泡、反应速率非常快
冒出少量气泡、反应速率慢、且反应一会儿就结束。
冒出大量气泡、反应速率适中
药品:碳酸钠( Na2CO3 )、大理石( CaCO3 )
稀盐酸(HCl)、稀硫酸(H2SO4)
问题与讨论:
讨论:1、为什么硫酸与大理石反应难于进行?
2、能否用浓盐酸代替稀盐酸?
3、为什么不用粉末状的碳酸钙或碳酸钠?
生成的硫酸钙微溶于水,会覆盖在大理石表面,阻止反应进行。
浓盐酸易挥发,使制得气体不纯。
反应速率太快,不便于控制。
CaCO3+ H2SO4 === CaSO4 +H2O+CO2↑
总反应:
CaCO3+2HCl==CaCl2 + H2O + CO2
二氧化碳的实验室制法
1、药品:
石灰石或大理石(主要成份为CaCO3)
2、反应原理:
CaCO3+2HCl== H2CO3+CaCl2
H2CO3== H2O+CO2
稀盐酸
A
B
C
D
E
F
实验探究二:实验室制取CO2装置的确定
1、发生装置的确定
2、收集装置的确定
信息提示:CO2的密度大于空气且能溶于水
验满:将燃烧的细木条放在集气瓶口,木条熄灭说明CO2集满。
检验:将气体通入澄清石灰水,或往气体中滴加澄清石灰水,振荡后石灰水变浑浊,说明该气体是CO2。
检验方法
澄清石灰水
变浑浊
验满方法
1、 明确了反应原理,如何选择装置?
2、具体的实验操作步骤?
3、如何检验和验满制得的二氧化碳?
根据O2的实验室制法,思考讨论以下问题:
2、实验室制取二氧化碳一般有五个步骤:①检验装置的气密性,②按要求装好仪器,③向长颈漏斗注入酸液,④向广口瓶中放入大理石小块,⑤收集气体.下列正确操作顺序是( )
A.①②③④⑤ B.②①④③⑤
C.①④②③⑤ D.②③④①⑤
B
1、下列关于实验室制取二氧化碳的说法中,不正确的是( )
A、实验室制取H2与CO2,的发生装置相同,因为都是固体,液体反应且不要加热
B、不能用排水法收集CO2,因为它能溶于水
C、不能选用石灰石与稀硫酸作原料,因为二者不反应
D、不选用Na2CO3粉末与稀盐酸反应,因为二者反应速率太快
C
3、下图是某同学制取二氧化碳的装置图,请说出其中的错误:
1、________________________;
2、 ________________________;
3、 ________________________;
4、实验室制取氧气和二氧化碳都必须用到的仪器是:
A .酒精灯 B. 锥形瓶 C. 铁架台 D. 导气管
长颈漏斗下端没有插入液面以下
锥形瓶中的导管插入到了液面以下
应该用向上排空气法收集气体
√
A
1 实验室制取氧气的发生装置应选择______,收集装置应选择______。
2 实验室制取氢气的发生装置应选择______,收集装置应选择______。
3 实验室制取二氧化碳的发生装置应选择______,收集装置应选择______。
B
D
E
C
F
A
D E
B C
E F
B C
D
5、选择恰当的填
二、CO2气体的检验与验满:
1、检验:将生成的气体通入澄清的石灰水,若石灰水变浑浊,证明该气体是二氧化碳。
2、验满:用燃着的木条靠近集气瓶口,若木条熄灭,说明二氧化碳已经收集满了。
三、气体实验室制法的设计思路
一、实验室制取CO2的装置:
1、制取装置:
2、收集方法:常用向上排空气法
不加热
固+液
总结
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
