2.2 金属的化学性质(金属活动性顺序应用)图像复习(课件 15张PPT)
文档属性
| 名称 | 2.2 金属的化学性质(金属活动性顺序应用)图像复习(课件 15张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 970.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-11-03 00:00:00 | ||
图片预览


文档简介
(共15张PPT)
金属活动性顺序应用
——图像复习
1.反应快慢程度:
金属活动性越强,相同时间里生成H2的速度越快。
Mg > Zn > Fe
( )
( )
( )
甲
乙
丙
反应时间
0
产生H2
质量
Mg
Zn
Fe
金属与酸反应的图像问题
一、根据金属活动性顺序判断金属跟酸反应快慢
将Mg 、 Zn、 Fe三种等质量金属投入到相同溶质质量分数且足量的盐酸中。
2.金属活动性最弱的金属是
Fe
Mg
3.反应不再发生时,最先反应完的一种物质是
丁
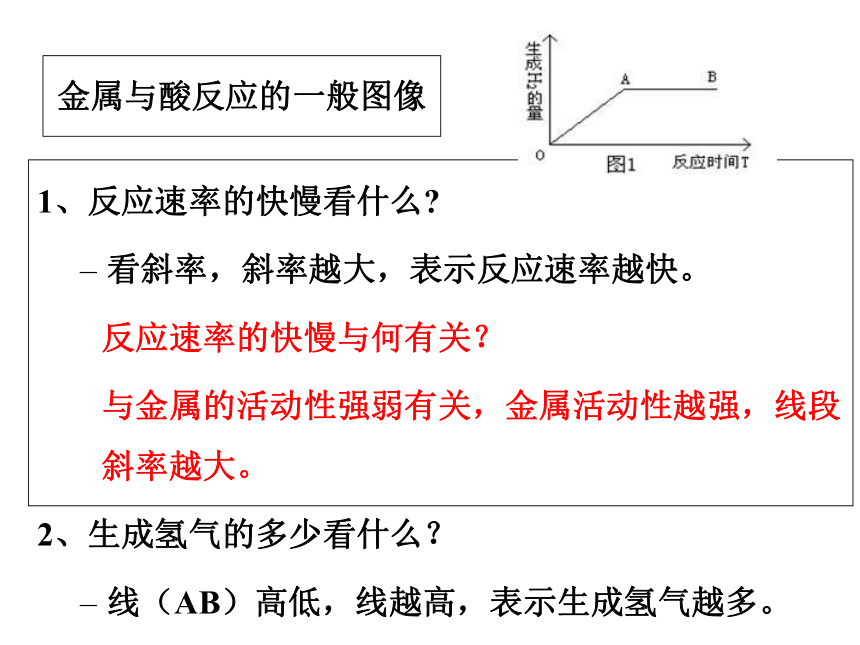
金属与酸反应的一般图像
1、反应速率的快慢看什么
看斜率,斜率越大,表示反应速率越快。
反应速率的快慢与何有关?
与金属的活动性强弱有关,金属活动性越强,线段斜率越大。
2、生成氢气的多少看什么?
线(AB)高低,线越高,表示生成氢气越多。
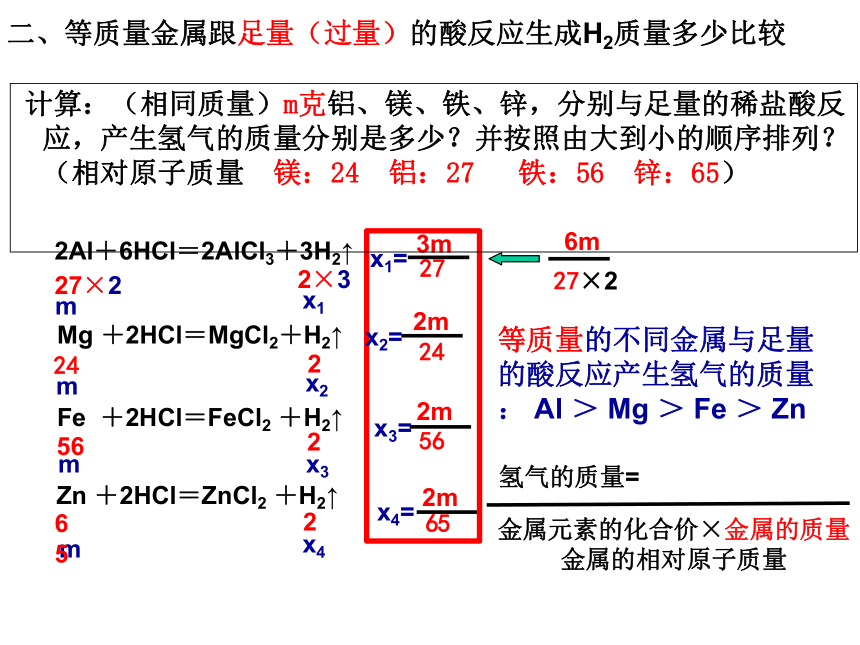
等质量的不同金属与足量的酸反应产生氢气的质量: Al > Mg > Fe > Zn
2m
24
2m
56
2m
65
6m
27×2
3m
27
m
Mg +2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Zn +2HCl=ZnCl2 +H2↑
Fe +2HCl=FeCl2 +H2↑
24
2
2
2
56
65
2×3
27×2
m
m
m
x1
x2
x3
x4
x1=
x2=
x3=
x4=
二、等质量金属跟足量(过量)的酸反应生成H2质量多少比较
计算:(相同质量)m克铝、镁、铁、锌,分别与足量的稀盐酸反应,产生氢气的质量分别是多少?并按照由大到小的顺序排列?(相对原子质量 镁:24 铝:27 铁:56 锌:65)
氢气的质量=
金属元素的化合价×金属的质量
金属的相对原子质量
产生氢气越多,纵坐标越高。
金属活动性越强,横坐标越小
/t
/g
Zn
Fe
Mg Al Zn Fe
. . . .
Al
Mg
Fe
Zn
.
.
.
.
.
Al
.
Mg
.
.
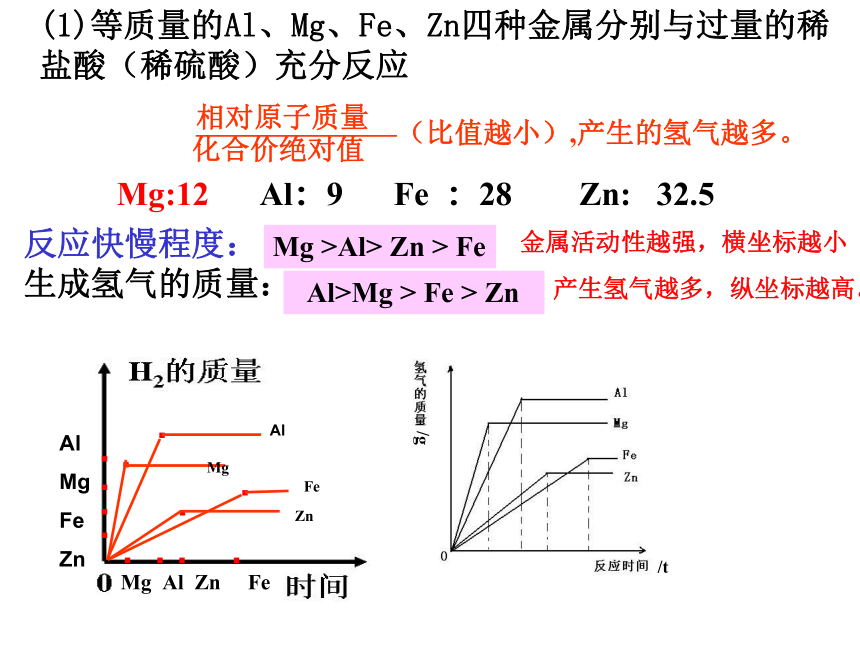
化合价绝对值
———————(比值越小),产生的氢气越多。
相对原子质量
Mg:12 Al:9 Fe :28 Zn: 32.5
反应快慢程度:
生成氢气的质量:
Mg >Al> Zn > Fe
Al>Mg > Fe > Zn
(1)等质量的Al、Mg、Fe、Zn四种金属分别与过量的稀盐酸(稀硫酸)充分反应
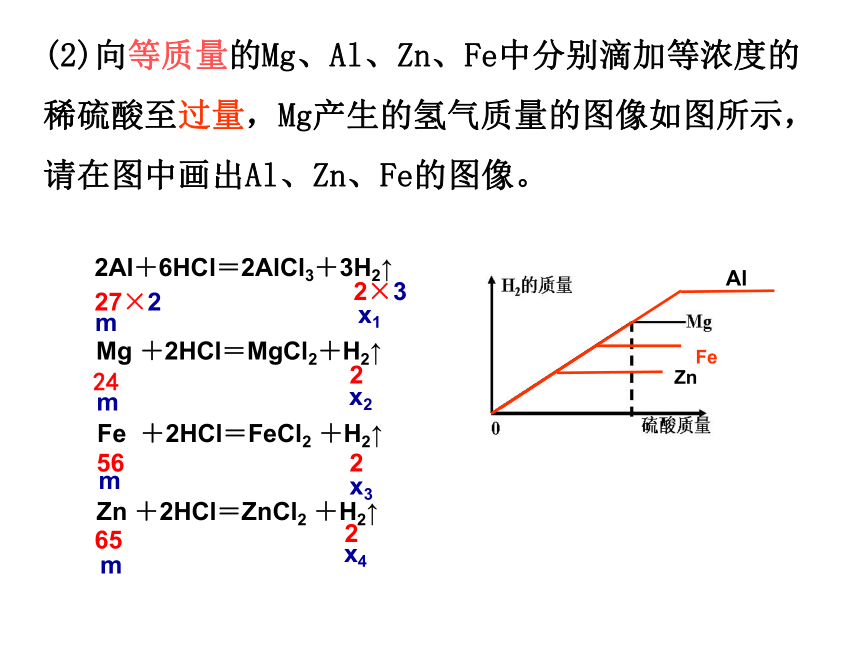
(2)向等质量的Mg、Al、Zn、Fe中分别滴加等浓度的稀硫酸至过量,Mg产生的氢气质量的图像如图所示,请在图中画出Al、Zn、Fe的图像。
Fe
Al
Zn
m
Mg +2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Zn +2HCl=ZnCl2 +H2↑
Fe +2HCl=FeCl2 +H2↑
24
2
2
2
56
65
2×3
27×2
m
m
m
x1
x2
x3
x4
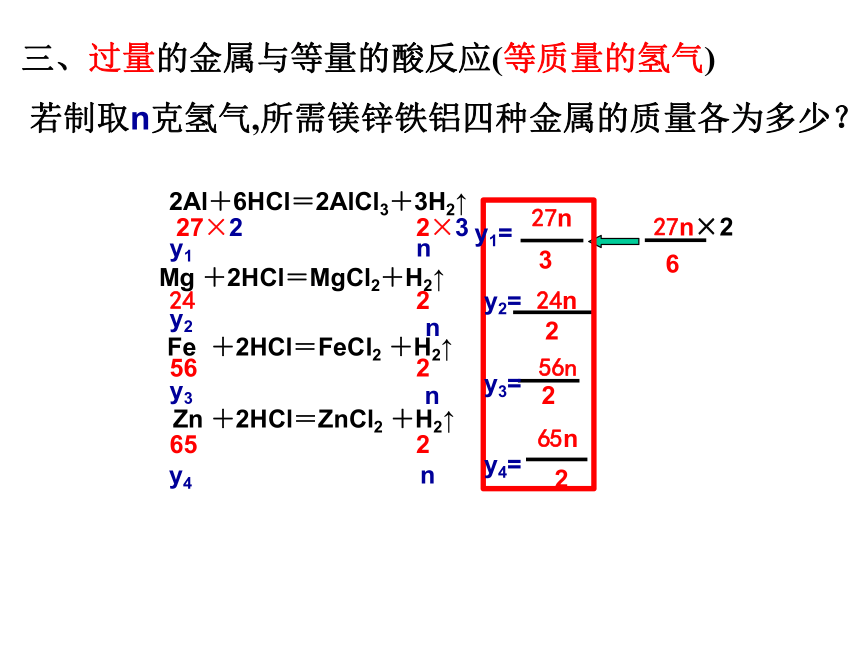
Mg +2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Zn +2HCl=ZnCl2 +H2↑
Fe +2HCl=FeCl2 +H2↑
24
2
2
2
56
65
2×3
27×2
y1
y2
y3
2
24n
2
56n
2
65n
6
27n×2
3
27n
n
n
y1=
y2=
y3=
y4=
三、过量的金属与等量的酸反应(等质量的氢气)
若制取n克氢气,所需镁锌铁铝四种金属的质量各为多少?
y4
n
n
27n
3
y1=
24n
2
y2=
2
56n
y3=
65n
2
y4=
×氢气质量
消耗金属的质量=
金属相对原子质量金属化合价
相对原子质量
化合价绝对值
———————-(比值越大),消耗的金属越多。
制取等质量的氢气
消耗金属的质量
制取2克氢气消耗金属的质量
Mg:24g Al:18g Fe :56g Zn: 65g
产生等质量H2,消耗金属Mg、Al、Fe、Zn的质量
Zn>Fe > Mg> Al
思考:上述四种金属中某一种24克与足量的稀硫酸反应,产生2克氢气,则该金属是哪种金属?
某两种
则该金属有哪些可能性的组合 ?
Al、Mg、Fe、Zn四种足量的金属分别与一定质量的稀硫酸反应制取等质量氢气,画出横坐标为金属质量纵坐标为氢气质量的坐标图
金属质量
产
生
H2
质
量
Al Mg Fe Zn
. . . .
.
.
Al
Mg
Fe
Zn
Mg +H2SO4=MgSO4 +H2↑ 2Al+3H2SO4=Al2(SO4 )3+3H2↑
Fe +H2SO4=FeSO4 +H2↑ Zn +H2SO4=ZnSO4 +H2↑
思考:如果是金属钠过量呢?
时间
硫酸的质量
Zn
Fe
反应时间
等质量的锌、铁和足量的稀硫酸反应,下列图像能正确表示生成的氢气质量与反应时间之间的关系的是 ( )
等质量
D
足量的稀硫酸
Zn
Fe
Zn
Fe
Zn
Fe
氢气的质量
反应时间
氢气的质量
反应时间
氢气的质量
氢气的质量
反应时间
若把横坐标改为消耗硫酸的质量,则应选择( )
消耗硫酸的质量
消耗硫酸的质量
消耗硫酸的质量
消耗硫酸的质量
若要选B请出题
足量且等质量的锌、铁和一定量的稀硫酸反应
1、等质量的Mg、Al、Zn、Fe和等质量等浓度且过量的稀硫酸反应,产生氢气的质量比是?
2、等质量且过量的Mg、Al、Zn、Fe和等质量等浓度的稀硫酸反应,产生氢气的质量比是?
练习3:如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏
B.向右偏
C.先向左偏后向右偏
D.先向右偏后向左偏
D
归纳:
1、指针先偏向金属活动性小的。(活动性小的反应速度慢,产生氢气慢)
2、指针最后偏向相对原子量大的。(等量等价金属,原子量大的产生氢气少)
向等质量的Mg、Fe中分别滴加等浓度的稀硫酸至过量,Mg产生的氢气质量随硫酸质量变化的图像如右图,请在图中画出Fe的图像。
Fe
把四块等质量的锌片分别投入等浓度且足量的MgSO4、AgNO3、FeSO4、CuSO4四种溶液中(假设单位时间内消耗的金属质量相等),固体的质量与反应时间的关系如右图所示,请在右图( )中标出对应的溶液。
(相对原子质量:Zn-65, Cu-64,Fe-56,Ag-108)
MgSO4
CuSO4
FeSO4
AgNO3
将质量相等的A、B两块金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如右图所示(产物中A、B两种元素的化合价相同)。分析右图,可以获得的信息有(任写两条):
①金属B比金属A活泼,
④金属A、B均被完全反应
②等质量的A比B放出的H2多
③金属B放出H2的速度比A快
⑤时间为t1时,B产生的H2比A多,
⑥A的相对原子质量小于B的相对原子质量。
小结:
金属活动性顺序应用
——图像复习
1.反应快慢程度:
金属活动性越强,相同时间里生成H2的速度越快。
Mg > Zn > Fe
( )
( )
( )
甲
乙
丙
反应时间
0
产生H2
质量
Mg
Zn
Fe
金属与酸反应的图像问题
一、根据金属活动性顺序判断金属跟酸反应快慢
将Mg 、 Zn、 Fe三种等质量金属投入到相同溶质质量分数且足量的盐酸中。
2.金属活动性最弱的金属是
Fe
Mg
3.反应不再发生时,最先反应完的一种物质是
丁
金属与酸反应的一般图像
1、反应速率的快慢看什么
看斜率,斜率越大,表示反应速率越快。
反应速率的快慢与何有关?
与金属的活动性强弱有关,金属活动性越强,线段斜率越大。
2、生成氢气的多少看什么?
线(AB)高低,线越高,表示生成氢气越多。
等质量的不同金属与足量的酸反应产生氢气的质量: Al > Mg > Fe > Zn
2m
24
2m
56
2m
65
6m
27×2
3m
27
m
Mg +2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Zn +2HCl=ZnCl2 +H2↑
Fe +2HCl=FeCl2 +H2↑
24
2
2
2
56
65
2×3
27×2
m
m
m
x1
x2
x3
x4
x1=
x2=
x3=
x4=
二、等质量金属跟足量(过量)的酸反应生成H2质量多少比较
计算:(相同质量)m克铝、镁、铁、锌,分别与足量的稀盐酸反应,产生氢气的质量分别是多少?并按照由大到小的顺序排列?(相对原子质量 镁:24 铝:27 铁:56 锌:65)
氢气的质量=
金属元素的化合价×金属的质量
金属的相对原子质量
产生氢气越多,纵坐标越高。
金属活动性越强,横坐标越小
/t
/g
Zn
Fe
Mg Al Zn Fe
. . . .
Al
Mg
Fe
Zn
.
.
.
.
.
Al
.
Mg
.
.
化合价绝对值
———————(比值越小),产生的氢气越多。
相对原子质量
Mg:12 Al:9 Fe :28 Zn: 32.5
反应快慢程度:
生成氢气的质量:
Mg >Al> Zn > Fe
Al>Mg > Fe > Zn
(1)等质量的Al、Mg、Fe、Zn四种金属分别与过量的稀盐酸(稀硫酸)充分反应
(2)向等质量的Mg、Al、Zn、Fe中分别滴加等浓度的稀硫酸至过量,Mg产生的氢气质量的图像如图所示,请在图中画出Al、Zn、Fe的图像。
Fe
Al
Zn
m
Mg +2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Zn +2HCl=ZnCl2 +H2↑
Fe +2HCl=FeCl2 +H2↑
24
2
2
2
56
65
2×3
27×2
m
m
m
x1
x2
x3
x4
Mg +2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Zn +2HCl=ZnCl2 +H2↑
Fe +2HCl=FeCl2 +H2↑
24
2
2
2
56
65
2×3
27×2
y1
y2
y3
2
24n
2
56n
2
65n
6
27n×2
3
27n
n
n
y1=
y2=
y3=
y4=
三、过量的金属与等量的酸反应(等质量的氢气)
若制取n克氢气,所需镁锌铁铝四种金属的质量各为多少?
y4
n
n
27n
3
y1=
24n
2
y2=
2
56n
y3=
65n
2
y4=
×氢气质量
消耗金属的质量=
金属相对原子质量金属化合价
相对原子质量
化合价绝对值
———————-(比值越大),消耗的金属越多。
制取等质量的氢气
消耗金属的质量
制取2克氢气消耗金属的质量
Mg:24g Al:18g Fe :56g Zn: 65g
产生等质量H2,消耗金属Mg、Al、Fe、Zn的质量
Zn>Fe > Mg> Al
思考:上述四种金属中某一种24克与足量的稀硫酸反应,产生2克氢气,则该金属是哪种金属?
某两种
则该金属有哪些可能性的组合 ?
Al、Mg、Fe、Zn四种足量的金属分别与一定质量的稀硫酸反应制取等质量氢气,画出横坐标为金属质量纵坐标为氢气质量的坐标图
金属质量
产
生
H2
质
量
Al Mg Fe Zn
. . . .
.
.
Al
Mg
Fe
Zn
Mg +H2SO4=MgSO4 +H2↑ 2Al+3H2SO4=Al2(SO4 )3+3H2↑
Fe +H2SO4=FeSO4 +H2↑ Zn +H2SO4=ZnSO4 +H2↑
思考:如果是金属钠过量呢?
时间
硫酸的质量
Zn
Fe
反应时间
等质量的锌、铁和足量的稀硫酸反应,下列图像能正确表示生成的氢气质量与反应时间之间的关系的是 ( )
等质量
D
足量的稀硫酸
Zn
Fe
Zn
Fe
Zn
Fe
氢气的质量
反应时间
氢气的质量
反应时间
氢气的质量
氢气的质量
反应时间
若把横坐标改为消耗硫酸的质量,则应选择( )
消耗硫酸的质量
消耗硫酸的质量
消耗硫酸的质量
消耗硫酸的质量
若要选B请出题
足量且等质量的锌、铁和一定量的稀硫酸反应
1、等质量的Mg、Al、Zn、Fe和等质量等浓度且过量的稀硫酸反应,产生氢气的质量比是?
2、等质量且过量的Mg、Al、Zn、Fe和等质量等浓度的稀硫酸反应,产生氢气的质量比是?
练习3:如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏
B.向右偏
C.先向左偏后向右偏
D.先向右偏后向左偏
D
归纳:
1、指针先偏向金属活动性小的。(活动性小的反应速度慢,产生氢气慢)
2、指针最后偏向相对原子量大的。(等量等价金属,原子量大的产生氢气少)
向等质量的Mg、Fe中分别滴加等浓度的稀硫酸至过量,Mg产生的氢气质量随硫酸质量变化的图像如右图,请在图中画出Fe的图像。
Fe
把四块等质量的锌片分别投入等浓度且足量的MgSO4、AgNO3、FeSO4、CuSO4四种溶液中(假设单位时间内消耗的金属质量相等),固体的质量与反应时间的关系如右图所示,请在右图( )中标出对应的溶液。
(相对原子质量:Zn-65, Cu-64,Fe-56,Ag-108)
MgSO4
CuSO4
FeSO4
AgNO3
将质量相等的A、B两块金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如右图所示(产物中A、B两种元素的化合价相同)。分析右图,可以获得的信息有(任写两条):
①金属B比金属A活泼,
④金属A、B均被完全反应
②等质量的A比B放出的H2多
③金属B放出H2的速度比A快
⑤时间为t1时,B产生的H2比A多,
⑥A的相对原子质量小于B的相对原子质量。
小结:
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
