第11章 酸与碱 检测题-2022-2023学年九年级化学京改版(2013)下册(有答案)
文档属性
| 名称 | 第11章 酸与碱 检测题-2022-2023学年九年级化学京改版(2013)下册(有答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 128.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-02 00:00:00 | ||
图片预览

文档简介
第11章 酸与碱 检测题
一、单选题
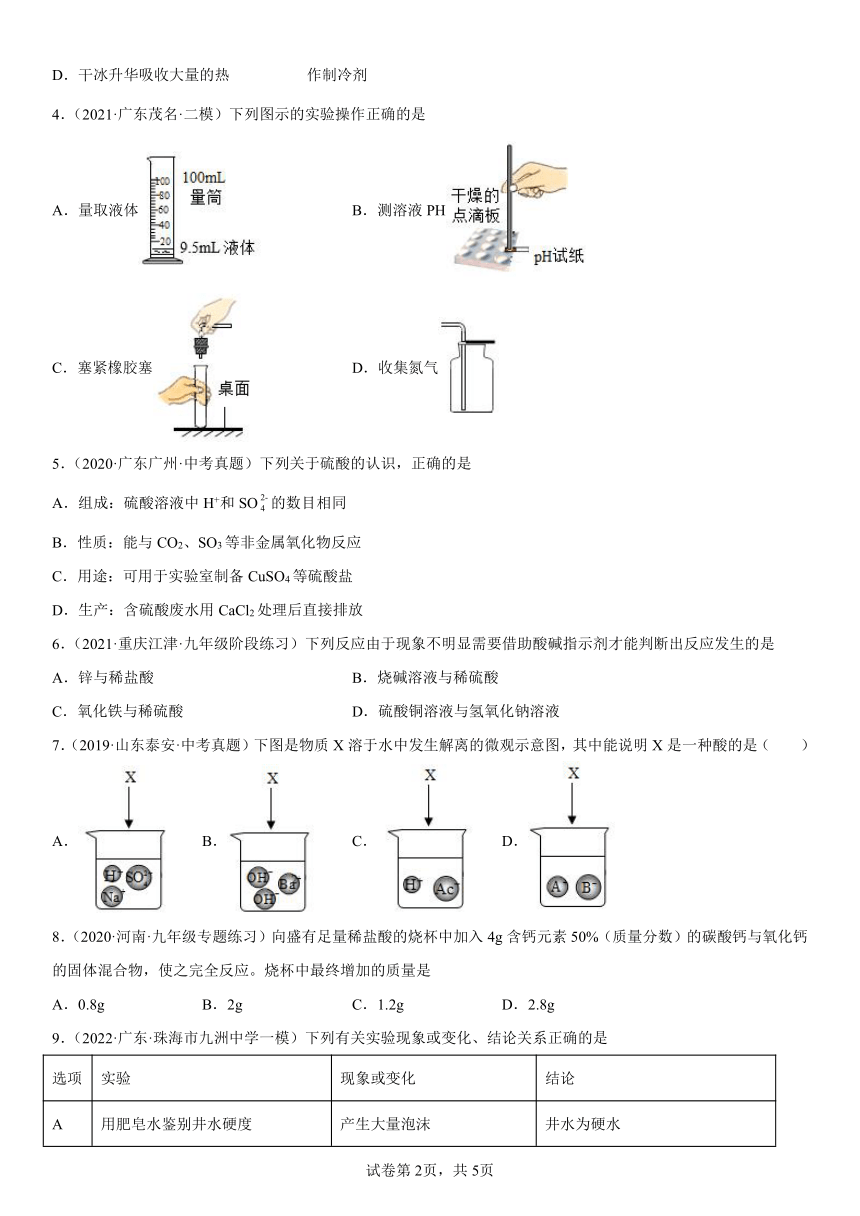
1.(2021·山东聊城·一模)规范的实验操作是实验成功的保证。以下化学实验基本操作中不正确的是
A.稀释浓硫酸
B.读取液体体积
C.滴加液体
D.过滤
2.(2020·湖南·衡阳市船山实验中学一模)推理是学习化学的一种重要方法。下列推理得出的相关结论合理的是( )
A.碱溶液的pH都大于7,pH大于7的溶液一定是碱溶液
B.化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物
C.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
D.金刚石和石墨都是由碳元素组成的单质,所以它们的性质完全相同
3.(2020·山东济宁·中考真题)下列物质的用途,一定涉及化学变化的是
A.金具有黄色金属光泽 制作饰品
B.活性炭具有吸附性 作除味剂
C.生石灰吸收空气中的水分 作干燥剂
D.干冰升华吸收大量的热 作制冷剂
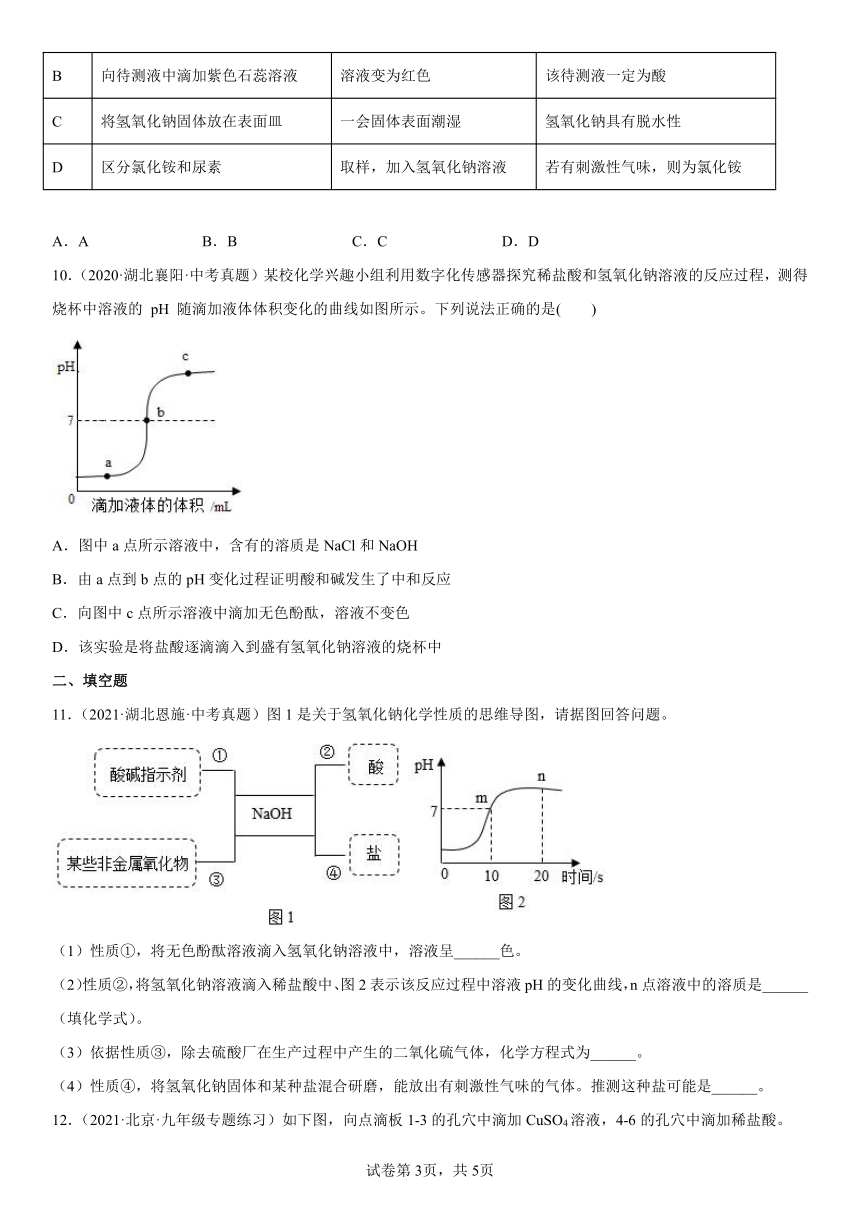
4.(2021·广东茂名·二模)下列图示的实验操作正确的是
A.量取液体 B.测溶液PH
C.塞紧橡胶塞 D.收集氮气
5.(2020·广东广州·中考真题)下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
6.(2021·重庆江津·九年级阶段练习)下列反应由于现象不明显需要借助酸碱指示剂才能判断出反应发生的是
A.锌与稀盐酸 B.烧碱溶液与稀硫酸
C.氧化铁与稀硫酸 D.硫酸铜溶液与氢氧化钠溶液
7.(2019·山东泰安·中考真题)下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
A. B. C. D.
8.(2020·河南·九年级专题练习)向盛有足量稀盐酸的烧杯中加入4g含钙元素50%(质量分数)的碳酸钙与氧化钙的固体混合物,使之完全反应。烧杯中最终增加的质量是
A.0.8g B.2g C.1.2g D.2.8g
9.(2022·广东·珠海市九洲中学一模)下列有关实验现象或变化、结论关系正确的是
选项 实验 现象或变化 结论
A 用肥皂水鉴别井水硬度 产生大量泡沫 井水为硬水
B 向待测液中滴加紫色石蕊溶液 溶液变为红色 该待测液一定为酸
C 将氢氧化钠固体放在表面皿 一会固体表面潮湿 氢氧化钠具有脱水性
D 区分氯化铵和尿素 取样,加入氢氧化钠溶液 若有刺激性气味,则为氯化铵
A.A B.B C.C D.D
10.(2020·湖北襄阳·中考真题)某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
二、填空题
11.(2021·湖北恩施·中考真题)图1是关于氢氧化钠化学性质的思维导图,请据图回答问题。
(1)性质①,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈______色。
(2)性质②,将氢氧化钠溶液滴入稀盐酸中、图2表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是______(填化学式)。
(3)依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为______。
(4)性质④,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐可能是______。
12.(2021·北京·九年级专题练习)如下图,向点滴板1-3的孔穴中滴加CuSO4溶液,4-6的孔穴中滴加稀盐酸。
(1)加入稀盐酸后,没有发生反应的孔穴是___________。
(2)能证明铁的活动性比铜强的实验是___________(填孔穴序号)。
(3)孔穴4中发生反应的化学方程式为___________。
13.(2020·山东济宁·中考真题)用滤纸折成蝴蝶并喷洒某种溶液后,悬挂于铁架台上。另取一只盛有某未知溶液的烧杯,放在纸蝴蝶的下方(如图)。一会儿,纸蝴蝶的颜色发生变化,请回答:
(1)若纸蝴蝶上喷洒的是酚酞溶液,纸蝴蝶变红色,烧杯中的溶液是 _______ ;
(2)若纸蝴蝶上喷洒的是石蕊溶液,纸蝴蝶变红色,烧杯中的溶液是 _______ ,若纸蝴蝶变蓝色,烧杯中的溶液是 _______ ;
(3)试分析产生以上现象的原因: ___________________________________________ 。
14.(2022·北京·101中学九年级阶段练习)如下图所示,向加有不同试剂的点滴板孔穴中分别滴加稀盐酸,研究物质的性质。
(1)孔穴1中观察到的现象是___________。
(2)孔穴2中的溶液变黄,反应的化学方程式为___________。
(3)从金属活动性的角度解释孔穴3、4现象不同的原因是___________。
(4)孔穴5中的现象为溶液由红色变为无色,则A可能是NaOH溶液和___________的混合液。
15.(2022·全国·九年级专题练习)0.056克氧化钙溶于100克水中,所得溶液中溶质的化学式为__________,其质量为__________g,溶剂的的化学式为__________,其质量为__________g,溶液的质量为__________g
三、计算题
16.(2019·山东济宁·九年级阶段练习)正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
17.(2020·福建福州·中考真题)国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋和氢氧化钠反应的化学方程式:CH3COOH+NaOH====CH3COONa+H2O假设该市售食醋样品中其它物质不与氢氧化钠发生反应)
18.(2021·四川雅安·中考真题)欲测定某瓶稀硫酸的溶质质量分数,现取20g该样品于烧杯中,将质量分数为10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请回答下列问题:
(1)N点溶液中的溶质是___________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.C
4.B
5.C
6.B
7.C
8.D
9.D
10.B
11.(1)红 NaCl、NaOH (2) (3)铵盐
12. (1) 5 (2)3或5、6 (3)
13. (1) 浓氨水 浓盐酸 (2)浓氨水 (3)浓氨水显碱性、浓盐酸显酸性,它们又都具有挥发性,挥发出来的物质能使无色酚酞溶液或紫色石蕊溶液变色
14. (1) 紫色石蕊溶液变红 (2)
(3)在金属活动性顺序中,铜位于氢后,不与稀盐酸反应;锌位于氢前,能与稀盐酸反应 酚酞溶液
15. (1) Ca(OH)2 0.074 (2)H2O (3)99.982 100.056
16.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
17.设10mL食醋样品中醋酸的质量为 x
则该食醋的总酸含量为4.5g/100mL,该食醋的总酸含量符合国家标准.
18.(1)Na2SO4、NaOH
(2)当pH值为7时,此时氢氧化钠和稀硫酸恰好完全反应,此时消耗的氢氧化钠溶液的质量为8g,则消耗NaOH溶液中的NaOH质量为8g×10%=0.8g,
设稀硫酸的溶质质量分数为x
x=4.9%
答:该稀硫酸的溶质质量分数为4.9%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2021·山东聊城·一模)规范的实验操作是实验成功的保证。以下化学实验基本操作中不正确的是
A.稀释浓硫酸
B.读取液体体积
C.滴加液体
D.过滤
2.(2020·湖南·衡阳市船山实验中学一模)推理是学习化学的一种重要方法。下列推理得出的相关结论合理的是( )
A.碱溶液的pH都大于7,pH大于7的溶液一定是碱溶液
B.化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物
C.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
D.金刚石和石墨都是由碳元素组成的单质,所以它们的性质完全相同
3.(2020·山东济宁·中考真题)下列物质的用途,一定涉及化学变化的是
A.金具有黄色金属光泽 制作饰品
B.活性炭具有吸附性 作除味剂
C.生石灰吸收空气中的水分 作干燥剂
D.干冰升华吸收大量的热 作制冷剂
4.(2021·广东茂名·二模)下列图示的实验操作正确的是
A.量取液体 B.测溶液PH
C.塞紧橡胶塞 D.收集氮气
5.(2020·广东广州·中考真题)下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
6.(2021·重庆江津·九年级阶段练习)下列反应由于现象不明显需要借助酸碱指示剂才能判断出反应发生的是
A.锌与稀盐酸 B.烧碱溶液与稀硫酸
C.氧化铁与稀硫酸 D.硫酸铜溶液与氢氧化钠溶液
7.(2019·山东泰安·中考真题)下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
A. B. C. D.
8.(2020·河南·九年级专题练习)向盛有足量稀盐酸的烧杯中加入4g含钙元素50%(质量分数)的碳酸钙与氧化钙的固体混合物,使之完全反应。烧杯中最终增加的质量是
A.0.8g B.2g C.1.2g D.2.8g
9.(2022·广东·珠海市九洲中学一模)下列有关实验现象或变化、结论关系正确的是
选项 实验 现象或变化 结论
A 用肥皂水鉴别井水硬度 产生大量泡沫 井水为硬水
B 向待测液中滴加紫色石蕊溶液 溶液变为红色 该待测液一定为酸
C 将氢氧化钠固体放在表面皿 一会固体表面潮湿 氢氧化钠具有脱水性
D 区分氯化铵和尿素 取样,加入氢氧化钠溶液 若有刺激性气味,则为氯化铵
A.A B.B C.C D.D
10.(2020·湖北襄阳·中考真题)某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
二、填空题
11.(2021·湖北恩施·中考真题)图1是关于氢氧化钠化学性质的思维导图,请据图回答问题。
(1)性质①,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈______色。
(2)性质②,将氢氧化钠溶液滴入稀盐酸中、图2表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是______(填化学式)。
(3)依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为______。
(4)性质④,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐可能是______。
12.(2021·北京·九年级专题练习)如下图,向点滴板1-3的孔穴中滴加CuSO4溶液,4-6的孔穴中滴加稀盐酸。
(1)加入稀盐酸后,没有发生反应的孔穴是___________。
(2)能证明铁的活动性比铜强的实验是___________(填孔穴序号)。
(3)孔穴4中发生反应的化学方程式为___________。
13.(2020·山东济宁·中考真题)用滤纸折成蝴蝶并喷洒某种溶液后,悬挂于铁架台上。另取一只盛有某未知溶液的烧杯,放在纸蝴蝶的下方(如图)。一会儿,纸蝴蝶的颜色发生变化,请回答:
(1)若纸蝴蝶上喷洒的是酚酞溶液,纸蝴蝶变红色,烧杯中的溶液是 _______ ;
(2)若纸蝴蝶上喷洒的是石蕊溶液,纸蝴蝶变红色,烧杯中的溶液是 _______ ,若纸蝴蝶变蓝色,烧杯中的溶液是 _______ ;
(3)试分析产生以上现象的原因: ___________________________________________ 。
14.(2022·北京·101中学九年级阶段练习)如下图所示,向加有不同试剂的点滴板孔穴中分别滴加稀盐酸,研究物质的性质。
(1)孔穴1中观察到的现象是___________。
(2)孔穴2中的溶液变黄,反应的化学方程式为___________。
(3)从金属活动性的角度解释孔穴3、4现象不同的原因是___________。
(4)孔穴5中的现象为溶液由红色变为无色,则A可能是NaOH溶液和___________的混合液。
15.(2022·全国·九年级专题练习)0.056克氧化钙溶于100克水中,所得溶液中溶质的化学式为__________,其质量为__________g,溶剂的的化学式为__________,其质量为__________g,溶液的质量为__________g
三、计算题
16.(2019·山东济宁·九年级阶段练习)正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
17.(2020·福建福州·中考真题)国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋和氢氧化钠反应的化学方程式:CH3COOH+NaOH====CH3COONa+H2O假设该市售食醋样品中其它物质不与氢氧化钠发生反应)
18.(2021·四川雅安·中考真题)欲测定某瓶稀硫酸的溶质质量分数,现取20g该样品于烧杯中,将质量分数为10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请回答下列问题:
(1)N点溶液中的溶质是___________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.C
4.B
5.C
6.B
7.C
8.D
9.D
10.B
11.(1)红 NaCl、NaOH (2) (3)铵盐
12. (1) 5 (2)3或5、6 (3)
13. (1) 浓氨水 浓盐酸 (2)浓氨水 (3)浓氨水显碱性、浓盐酸显酸性,它们又都具有挥发性,挥发出来的物质能使无色酚酞溶液或紫色石蕊溶液变色
14. (1) 紫色石蕊溶液变红 (2)
(3)在金属活动性顺序中,铜位于氢后,不与稀盐酸反应;锌位于氢前,能与稀盐酸反应 酚酞溶液
15. (1) Ca(OH)2 0.074 (2)H2O (3)99.982 100.056
16.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
17.设10mL食醋样品中醋酸的质量为 x
则该食醋的总酸含量为4.5g/100mL,该食醋的总酸含量符合国家标准.
18.(1)Na2SO4、NaOH
(2)当pH值为7时,此时氢氧化钠和稀硫酸恰好完全反应,此时消耗的氢氧化钠溶液的质量为8g,则消耗NaOH溶液中的NaOH质量为8g×10%=0.8g,
设稀硫酸的溶质质量分数为x
x=4.9%
答:该稀硫酸的溶质质量分数为4.9%。
答案第1页,共2页
答案第1页,共2页
