第八章 常见的酸碱盐 测试题- 2022-2023学年科粤版化学九年级下册(有答案)
文档属性
| 名称 | 第八章 常见的酸碱盐 测试题- 2022-2023学年科粤版化学九年级下册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 105.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-02 10:00:04 | ||
图片预览


文档简介
第八章 常见的酸碱盐 测试题
一、单选题
1.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.溶液中滴入石蕊仍为紫色
B.溶液中滴入酚酞显红色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞不显色
2.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水 B.有沉淀生成
C.有气体生成 D.有盐生成
3.下列图示的实验操作正确的是
A.量取液体 B.测溶液PH
C.塞紧橡胶塞 D.收集氮气
4.实验室里区分下列物质的实验设计方案都合理的是
选项 需要区分的物质 实验方法
A 碳铵和磷矿粉 ①加熟石灰研磨后闻气味 ②观察颜色
B 氧化铜和铁粉 ①观察颜色 ②用磁铁吸
C 苏打和小苏打 ①溶于水加无色酚酞溶液 ②加稀盐酸后观察
D 黄铜和18K黄金 ①加稀盐酸 ②加热后观察颜色
A.A B.B C.C D.D
5.研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是( )
选项 实验 现象
A 将氢氧化钠固体放在表面皿上,放置一会儿 固体受潮,逐渐溶解
B 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 溶液变红
C 向盛有氢氧化钠溶液的试管中加入一根头发丝,加热煮沸 头发丝无任何变化
D 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 有蓝色沉淀生成
A.A B.B C.C D.D
6.下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是
A.NaOH KOH HCl B.NaCl NaOH HCl
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
7.下列归纳完全正确的一组是
A.化学与能源 B.性质与用途
①使用共享单车出行能有效减少碳排放 ②金刚石属于金属材料 ③可燃冰会成为未来的清洁能源 ①洗洁精能溶解油污,可洗涤餐具上油污 ②氢氧化钠有吸水性,可作某些气体干燥剂 ③熟石灰显碱性,可用于改良酸性土壤
C.化学与安全 D.化学实验中的先与后
①进入矿井前要做灯火试验 ②煤气泄露立即开灯查找泄露 ③用湿毛巾捂住口鼻可防止CO中毒 ①给固体加热时:先预热后集中加热 ②称量5g氯化钠:先加砝码后加药品 ③可燃性气体燃烧:先验纯后点燃
A.A B.B C.C D.D
8.将物质进行分类、类比是学习化学的重要途径,下列有关说法正确的是
A.硅与碳的最外层电子数相同,二氧化硅能与氢氧化钠溶液反应
B.醋酸、纯碱、硫酸钡分别属于酸、碱、盐
C.化学变化大多伴随着发光放热,所以有发光放热的变化一定是化学变化
D.硫酸、盐酸、干冰都属于纯净物
9.下列做法不符合“节能降耗、保护环境”这一主题的是( )
A.合理和综合利用煤和石油
B.研制太阳能电池、海洋电池等
C.大量使用农药化肥提高粮食产量
D.推广垃圾分类、回收和处理
10.推理是化学学习中常用的思维方法。下列推理正确的是
A.酸能使紫色石蕊试液变红。通入CO2后的紫色石蕊试液变红,所以CO2是酸
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.酸与碱作用生成盐和水是中和反应,所以生成盐和水的反应一定是中和反应
D.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
二、填空题
11.化学就在我们身边。从①熟石灰②金刚石③氯化钠④干冰四种物质中,选择适当的物质填空(填序号)。
(1)用于炒菜调味的是_____;
(2)用于人工降雨的是_____;
(3)用来裁玻璃的是_____;
(4)用来改良酸性土壤的是_____。
12.如下图所示,电子秤上的量筒中分别盛有蒸馏水、浓硫酸,放置一段时间。
(1)A中示数变小,从微粒的角度解释其原因是____________。
(2)B中示数____________(填“变大”“不变”或“变小”),其原因是____________。
13.我们的胃液中含有盐酸,它有助于消化,但胃酸过多会引起胃部不适。有时可以用小苏打治疗,反应的方程式为________________,化学反应前后一定没有变化的离子是________________(离子符号表示)。
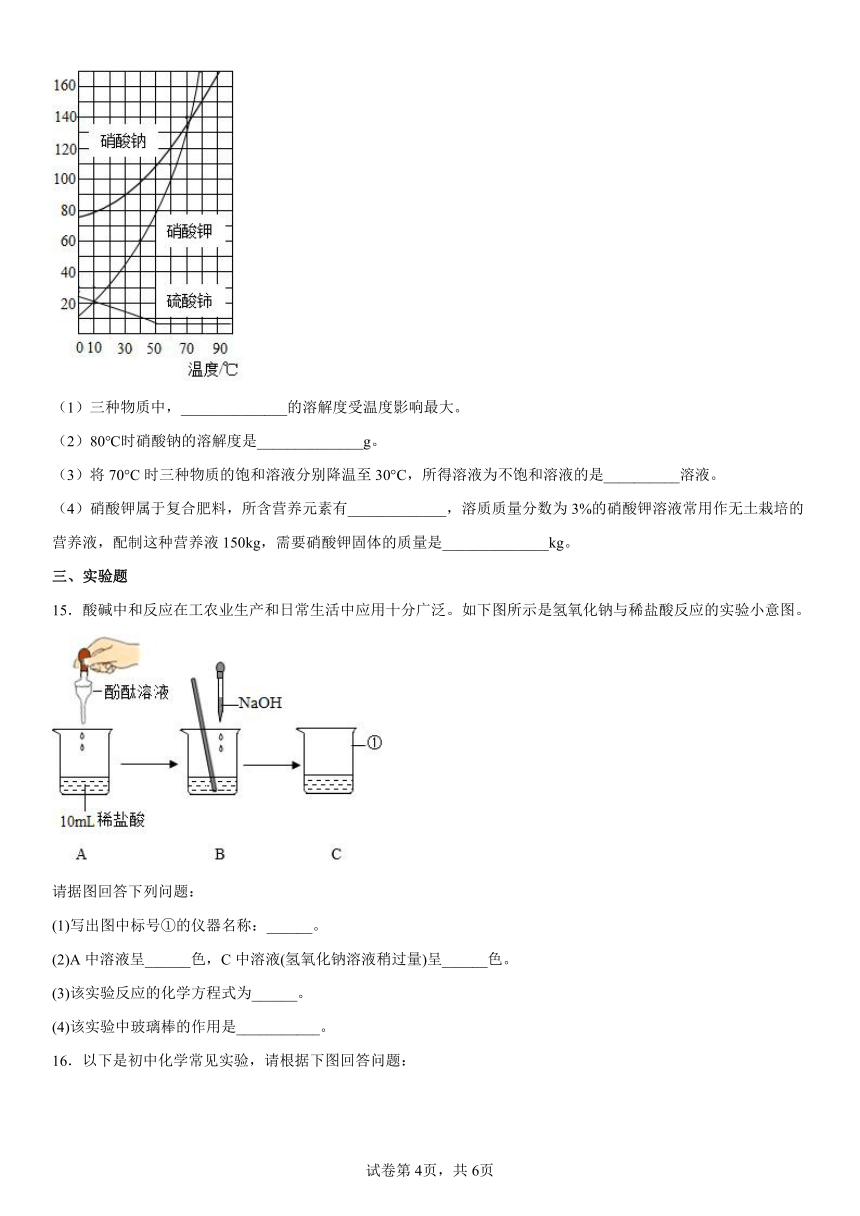
14.溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中,______________的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是______________g。
(3)将70°C时三种物质的饱和溶液分别降温至30°C,所得溶液为不饱和溶液的是__________溶液。
(4)硝酸钾属于复合肥料,所含营养元素有_____________,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量是______________kg。
三、实验题
15.酸碱中和反应在工农业生产和日常生活中应用十分广泛。如下图所示是氢氧化钠与稀盐酸反应的实验小意图。
请据图回答下列问题:
(1)写出图中标号①的仪器名称:______。
(2)A中溶液呈______色,C中溶液(氢氧化钠溶液稍过量)呈______色。
(3)该实验反应的化学方程式为______。
(4)该实验中玻璃棒的作用是___________。
16.以下是初中化学常见实验,请根据下图回答问题:
(1)图一实验中酚酞溶液变红,说明分子具有___________性质;
(2)图二实验中看到___________现象时,证明该装置气密性良好;
(3)用三实验中玻璃棒搅拌的作用是___________。
四、计算题
17.实验室用10g8%的氢氧化钠溶液和稀硫酸进行中和反应实验,实验过程中溶液的pH变化如图所示:
(1)A点溶液的溶质_________。(填化学式)
(2)计算所用的该稀硫酸的质量分数为__________?
18.小新用20 g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。操作过程如下。请计算:
(1)20 g样品中碳酸钠的质量为多少g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
19.某化肥厂生产的一种化肥包装袋上的说明如图所示,化学兴趣小组为测定其纯度,取样品5.6克,完全溶于水,向所得溶液中加入100克一定溶质质量分数的硝酸银溶液,恰好完全反应生成14.35克沉淀(杂质不与硝酸银溶液反应)。通过计算回答。
氯化铵净重25Kg 纯度≥95% XX化肥有限责任公司
(1)所用硝酸银溶液的溶质质量分数;_____。
(2)该化肥是否合格(结果精确到0.1%)。_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.B
4.A
5.C
6.B
7.D
8.A
9.C
10.D
11. (1) ③ (2) ④ (3) ② (4) ①
12. (1)水分子不断运动 (2) 变大 (3) 浓硫酸具有吸水性
13. (1) NaHCO3+HCl=NaCl+H2O+CO2↑ (2) Na+ 、Cl-
14. (1) 硝酸钾(或KNO3) (2) 150 硫酸铈 (3) K、N(或“钾、氮”) (4) 4.5
15.(1)烧杯
(2) 无 红
(3)
(4)搅拌,使酸和碱充分反应
16.(1)不断运动
(2)玻璃管内液面上升(推动注射器)或玻璃管下端出现气泡(拉动注射器)
(3)使得热量迅速散失,防止局部过热引起酸液飞溅。
17.(1)Na2SO4、H2SO4;(2)9.8%
18.(1)10.6g
20 g样品中碳酸钠的质量为20g×53%=10.6g
(2)反应后所得滤液中氢氧化钠的质量分数为4%。
19.解:设硝酸银的质量为x,氯化铵质量为y。
x=17g
y=5.35g
所用硝酸银溶液的溶质质量分数
样品的纯度为
故填:17%,合格
答案第1页,共2页
答案第1页,共2页
一、单选题
1.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.溶液中滴入石蕊仍为紫色
B.溶液中滴入酚酞显红色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞不显色
2.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水 B.有沉淀生成
C.有气体生成 D.有盐生成
3.下列图示的实验操作正确的是
A.量取液体 B.测溶液PH
C.塞紧橡胶塞 D.收集氮气
4.实验室里区分下列物质的实验设计方案都合理的是
选项 需要区分的物质 实验方法
A 碳铵和磷矿粉 ①加熟石灰研磨后闻气味 ②观察颜色
B 氧化铜和铁粉 ①观察颜色 ②用磁铁吸
C 苏打和小苏打 ①溶于水加无色酚酞溶液 ②加稀盐酸后观察
D 黄铜和18K黄金 ①加稀盐酸 ②加热后观察颜色
A.A B.B C.C D.D
5.研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是( )
选项 实验 现象
A 将氢氧化钠固体放在表面皿上,放置一会儿 固体受潮,逐渐溶解
B 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 溶液变红
C 向盛有氢氧化钠溶液的试管中加入一根头发丝,加热煮沸 头发丝无任何变化
D 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 有蓝色沉淀生成
A.A B.B C.C D.D
6.下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是
A.NaOH KOH HCl B.NaCl NaOH HCl
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
7.下列归纳完全正确的一组是
A.化学与能源 B.性质与用途
①使用共享单车出行能有效减少碳排放 ②金刚石属于金属材料 ③可燃冰会成为未来的清洁能源 ①洗洁精能溶解油污,可洗涤餐具上油污 ②氢氧化钠有吸水性,可作某些气体干燥剂 ③熟石灰显碱性,可用于改良酸性土壤
C.化学与安全 D.化学实验中的先与后
①进入矿井前要做灯火试验 ②煤气泄露立即开灯查找泄露 ③用湿毛巾捂住口鼻可防止CO中毒 ①给固体加热时:先预热后集中加热 ②称量5g氯化钠:先加砝码后加药品 ③可燃性气体燃烧:先验纯后点燃
A.A B.B C.C D.D
8.将物质进行分类、类比是学习化学的重要途径,下列有关说法正确的是
A.硅与碳的最外层电子数相同,二氧化硅能与氢氧化钠溶液反应
B.醋酸、纯碱、硫酸钡分别属于酸、碱、盐
C.化学变化大多伴随着发光放热,所以有发光放热的变化一定是化学变化
D.硫酸、盐酸、干冰都属于纯净物
9.下列做法不符合“节能降耗、保护环境”这一主题的是( )
A.合理和综合利用煤和石油
B.研制太阳能电池、海洋电池等
C.大量使用农药化肥提高粮食产量
D.推广垃圾分类、回收和处理
10.推理是化学学习中常用的思维方法。下列推理正确的是
A.酸能使紫色石蕊试液变红。通入CO2后的紫色石蕊试液变红,所以CO2是酸
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.酸与碱作用生成盐和水是中和反应,所以生成盐和水的反应一定是中和反应
D.酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
二、填空题
11.化学就在我们身边。从①熟石灰②金刚石③氯化钠④干冰四种物质中,选择适当的物质填空(填序号)。
(1)用于炒菜调味的是_____;
(2)用于人工降雨的是_____;
(3)用来裁玻璃的是_____;
(4)用来改良酸性土壤的是_____。
12.如下图所示,电子秤上的量筒中分别盛有蒸馏水、浓硫酸,放置一段时间。
(1)A中示数变小,从微粒的角度解释其原因是____________。
(2)B中示数____________(填“变大”“不变”或“变小”),其原因是____________。
13.我们的胃液中含有盐酸,它有助于消化,但胃酸过多会引起胃部不适。有时可以用小苏打治疗,反应的方程式为________________,化学反应前后一定没有变化的离子是________________(离子符号表示)。
14.溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中,______________的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是______________g。
(3)将70°C时三种物质的饱和溶液分别降温至30°C,所得溶液为不饱和溶液的是__________溶液。
(4)硝酸钾属于复合肥料,所含营养元素有_____________,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量是______________kg。
三、实验题
15.酸碱中和反应在工农业生产和日常生活中应用十分广泛。如下图所示是氢氧化钠与稀盐酸反应的实验小意图。
请据图回答下列问题:
(1)写出图中标号①的仪器名称:______。
(2)A中溶液呈______色,C中溶液(氢氧化钠溶液稍过量)呈______色。
(3)该实验反应的化学方程式为______。
(4)该实验中玻璃棒的作用是___________。
16.以下是初中化学常见实验,请根据下图回答问题:
(1)图一实验中酚酞溶液变红,说明分子具有___________性质;
(2)图二实验中看到___________现象时,证明该装置气密性良好;
(3)用三实验中玻璃棒搅拌的作用是___________。
四、计算题
17.实验室用10g8%的氢氧化钠溶液和稀硫酸进行中和反应实验,实验过程中溶液的pH变化如图所示:
(1)A点溶液的溶质_________。(填化学式)
(2)计算所用的该稀硫酸的质量分数为__________?
18.小新用20 g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。操作过程如下。请计算:
(1)20 g样品中碳酸钠的质量为多少g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
19.某化肥厂生产的一种化肥包装袋上的说明如图所示,化学兴趣小组为测定其纯度,取样品5.6克,完全溶于水,向所得溶液中加入100克一定溶质质量分数的硝酸银溶液,恰好完全反应生成14.35克沉淀(杂质不与硝酸银溶液反应)。通过计算回答。
氯化铵净重25Kg 纯度≥95% XX化肥有限责任公司
(1)所用硝酸银溶液的溶质质量分数;_____。
(2)该化肥是否合格(结果精确到0.1%)。_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.B
4.A
5.C
6.B
7.D
8.A
9.C
10.D
11. (1) ③ (2) ④ (3) ② (4) ①
12. (1)水分子不断运动 (2) 变大 (3) 浓硫酸具有吸水性
13. (1) NaHCO3+HCl=NaCl+H2O+CO2↑ (2) Na+ 、Cl-
14. (1) 硝酸钾(或KNO3) (2) 150 硫酸铈 (3) K、N(或“钾、氮”) (4) 4.5
15.(1)烧杯
(2) 无 红
(3)
(4)搅拌,使酸和碱充分反应
16.(1)不断运动
(2)玻璃管内液面上升(推动注射器)或玻璃管下端出现气泡(拉动注射器)
(3)使得热量迅速散失,防止局部过热引起酸液飞溅。
17.(1)Na2SO4、H2SO4;(2)9.8%
18.(1)10.6g
20 g样品中碳酸钠的质量为20g×53%=10.6g
(2)反应后所得滤液中氢氧化钠的质量分数为4%。
19.解:设硝酸银的质量为x,氯化铵质量为y。
x=17g
y=5.35g
所用硝酸银溶液的溶质质量分数
样品的纯度为
故填:17%,合格
答案第1页,共2页
答案第1页,共2页
