化学人教版(2019)必修第二册5.1.2硫酸(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.2硫酸(共35张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 30.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-02 23:19:38 | ||
图片预览





文档简介
(共35张PPT)
如果没有硫酸,
许多现代工业都不可能存在。
傅 鹰
第2课时 硫酸
5-1 硫及其化合物
【学习目标与核心素养】
学习目标
1、了解浓硫酸的三大特性。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、掌握硫酸根离子的检验方法
核心素养
1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
硫酸
铅蓄电池
医药
化肥
农药
酸洗
试剂
干燥剂
炸药
我们都需要
化学工业之母
有人称硫酸是化学工业生产的“发动机”。
世界上常把硫酸的产量作为衡量
一个国家工业发达程度的标志
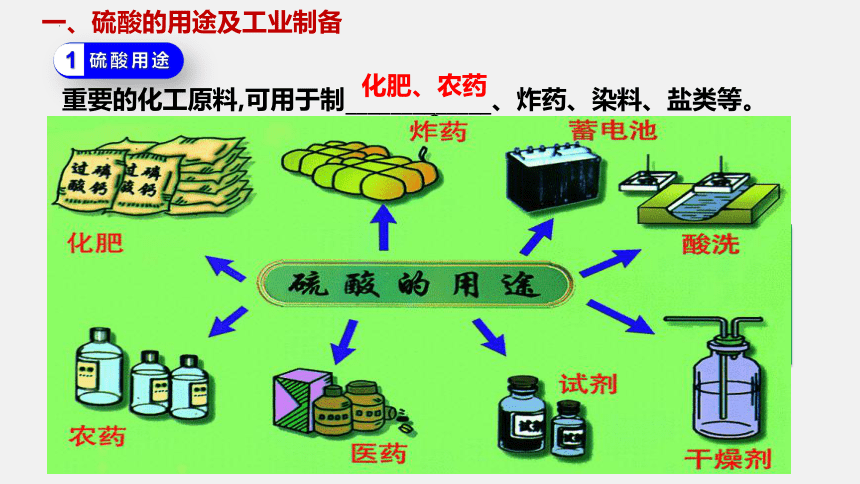
重要的化工原料,可用于制_____________、炸药、染料、盐类等。
一、硫酸的用途及工业制备
化肥、农药
硫酸用途
1
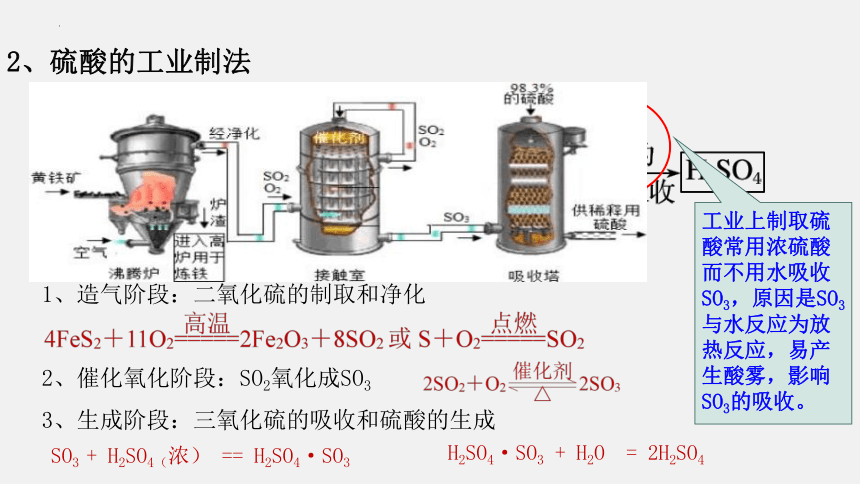
1、造气阶段:二氧化硫的制取和净化
2、催化氧化阶段:SO2氧化成SO3
3、生成阶段:三氧化硫的吸收和硫酸的生成
H2SO4·SO3 + H2O = 2H2SO4
SO3 + H2SO4(浓) == H2SO4·SO3
2、硫酸的工业制法
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
?
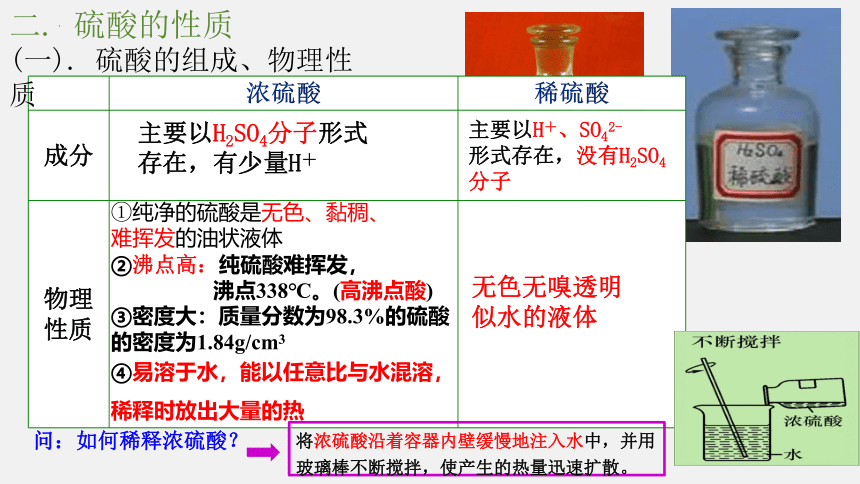
浓硫酸 稀硫酸
成分
物理性质
主要以H2SO4分子形式存在,有少量H+
主要以H+、SO42-
形式存在,没有H2SO4分子
二. 硫酸的性质
(一). 硫酸的组成、物理性质
无色无嗅透明
似水的液体
①纯净的硫酸是无色、黏稠、
难挥发的油状液体
②沸点高:纯硫酸难挥发,
沸点338℃。(高沸点酸)
③密度大:质量分数为98.3%的硫酸
的密度为1.84g/cm3
④易溶于水,能以任意比与水混溶,
稀释时放出大量的热
问:如何稀释浓硫酸?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
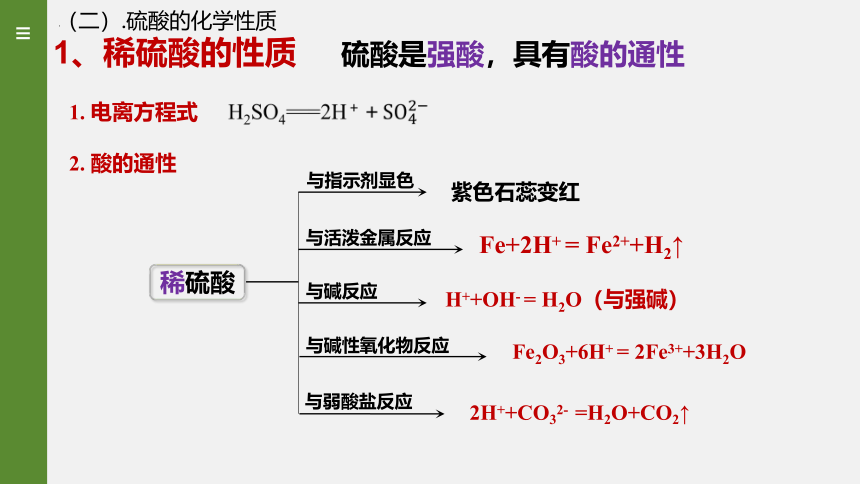
1、稀硫酸的性质
硫酸是强酸,具有酸的通性
2. 酸的通性
与指示剂显色
紫色石蕊变红
与活泼金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
1. 电离方程式
稀硫酸
Fe+2H+ = Fe2++H2↑
H++OH- = H2O(与强碱)
Fe2O3+6H+ = 2Fe3++3H2O
2H++CO32- =H2O+CO2↑
(二).硫酸的化学性质
实验验证
描述现象
结论
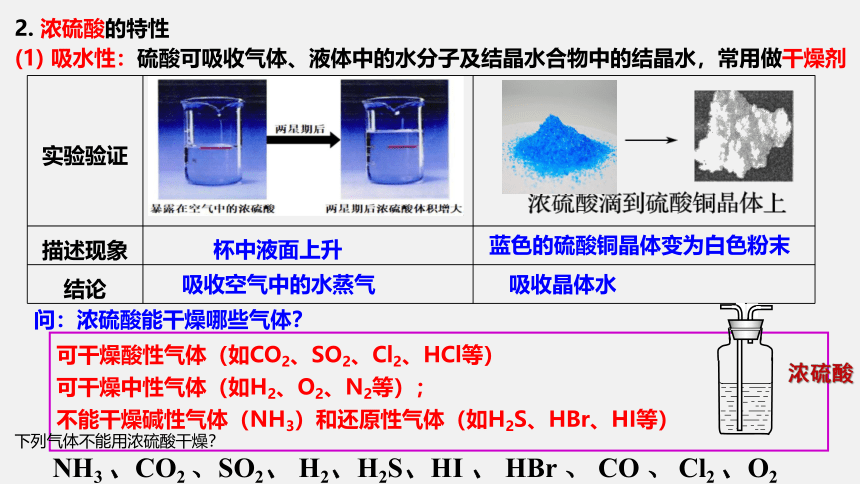
2. 浓硫酸的特性
(1) 吸水性:硫酸可吸收气体、液体中的水分子及结晶水合物中的结晶水,常用做干燥剂
杯中液面上升
吸收空气中的水蒸气
蓝色的硫酸铜晶体变为白色粉末
吸收晶体水
问:浓硫酸能干燥哪些气体?
可干燥酸性气体(如CO2、SO2、Cl2、HCl等)
可干燥中性气体(如H2、O2、N2等);
不能干燥碱性气体(NH3)和还原性气体(如H2S、HBr、HI等)
NH3 、CO2 、SO2、 H2、H2S、HI 、 HBr 、 CO 、 Cl2 、O2
下列气体不能用浓硫酸干燥?
浓硫酸
在实验探究课上,同学们积极思考,共设计出下图所示的四种实验装置用以验证浓硫酸的吸水性,其中在理论上可行的是___________。
试一试
仔细观察实验现象,并尝试解释实验现象。
现象 分析
蔗糖变黑
迅速膨胀,疏松多孔海绵状的固体
温度升高,有刺激性气味
浓硫酸的脱水性使蔗糖炭化
产生大量气体
过程中放出热量
思考:气体可能是什么,如何产生的?
(2) 脱水性:浓硫酸能把有机物中的氢氧原子按2:1的个数比脱去,
【黑面包实验】
C12H22O11
浓硫酸
12C+11H2O
蔗糖
脱水性
强氧化性
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
==
△
问:实验过程涉及到哪些化学反应?
注:
①有机物被浓硫酸脱去水并不一定都生成C
②把浓硫酸点在蓝色石蕊试纸上,将看到
试纸先变红,后变黑,变黑就是脱水炭化了
③若不慎将浓硫酸溅在皮肤上,应用大量
水进行冲洗,然后再涂上NaHCO3稀溶液
该实验结论:
浓硫酸具有脱水性(和强氧化性)
吸水性 脱水性
原理 浓硫酸能够吸收_______ _______________及固体 中的结晶水 浓硫酸能把有机物中_____
___________________脱
去,剩余黑色的炭
区别 _____________ ____________________
_________________
应用 _________
气体、
液体中的水分子
氢、
氧元素按水的组成比
物质中含有H2O
物质中不含有H2O,只含
有氢元素和氧元素
作干燥剂
吸水性与脱水性
【对比分析】
有水为吸 无水则脱
3、设计实验来验证浓硫酸与炭反应是否生成了二氧化碳、水和二氧化硫。
按正确的顺序连接下列仪器,并说明你的理由.
【思考与交流】
仪器连接如下:
检验水(白色固体为蓝色)
检验二氧化硫(品红褪色)
除去二氧化硫(溶液褪色)
检验二氧化硫是否除尽
检验二氧化碳(溶液变浑浊)
(3) 强氧化性
(1)与金属的反应
实验现象
将a试管里的溶液慢慢倒入水中,溶液变为_____
a试管中铜丝表面__________________________
b试管中的品红溶液逐渐变为________
c试管中的紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
氧化性和酸性
硫酸盐和SO2
【实验5-3】
根据金属活动性,铝比锌活泼,工业上为何能用铝槽车和铁罐车盛放、运输浓硫酸?
(2)常温下,冷的浓硫酸能使Fe、Al钝化(使金属表面生成一层致密的氧化物)钝化是化学变化 。工业上用铝槽车和铁罐车盛放、运输浓硫酸。
(3)与具有还原性的化合物反应,如H2S、HI、HBr、FeCl2等。
H2S+3H2SO4 = 4SO2↑+4H2O
如将少量铁放入浓硫酸中加热,会发生反应。反应开始的一段时间内生成的气体是H2吗?
思考﹒ 运用
你认为是什么气体?
如将过量的铁与浓硫酸加热,会得到什么气体?
【课堂练习】
1.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为____________________________________________。
利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为____________________________________。
以上两种方法哪种好?______________,原因是___________________
_____________________________________________________________
______________________。
第一种方法好
①制得相同质量的产品,第一种方法消耗的硫酸少,②第二种方法生成SO2,会造成大气污染,③第一种方法节约能源
问:如何鉴别浓硫酸与稀硫酸?
方法 操作 结论
脱水法 用玻璃棒蘸取两液体分别涂在纸上 变黑者是浓硫酸
稀释法 分别加入盛水的试管中 明显放热者是浓硫酸
吸水法 分别滴加到硫酸铜晶体(CuSO4·5H2O)上 蓝色晶体变白者是浓硫酸
钝化法 常温下,取已去氧化膜的两块铝片(或铁片)分别放入盛有浓、稀硫酸的试管中 有大量气泡冒出的是稀硫酸,无明显现象的是浓硫酸
生雾法 分别滴加到浓盐酸中 有白雾产生的是浓硫酸
观察法 分别用玻璃棒蘸取两液体 黏稠状的是浓硫酸
密度法 分别称量相同体积的两液体 质量大的是浓硫酸
氧化法 分别取两支试管,加入铜片后再分别加入两液体,加热 溶液变蓝,有刺激性气味气体产生的是浓硫酸
如何检验硫酸根离子?
硫酸盐
一些含 结晶水的硫酸盐 叫做 矾 。
胆矾 ,绿矾 ,
皓矾 ,明矾 ,
生石膏 ,熟石膏 ,
重晶石 。
CuSO4·5H2O
FeSO4·7H2O
ZnSO4·7H2O
KAl(SO4)2·12H2O
BaSO4
2CaSO4·H2O
CaSO4·2H2O
拓展
如何检验硫酸根离子?
实验操作
实验现象 先 ,加入盐酸后______ 先 ,加入盐酸后______ 先_____________,加入盐酸后_______________
【实验5-4】
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且有气泡产生
实验结论 SO42-与Ba2+反应生成不溶于盐酸的_____, 离子方程式:____________________ CO32-与Ba2+反应生成的白色沉淀BaCO3,可溶于盐酸
白色沉淀
SO42- + Ba2+ = BaSO4↓
加稀盐酸的目的是排除 CO32- 、SO32- 、Ag+干扰
问题一.盐酸的作用?
问题二.检验溶液中是否含有SO42-时,可用稀硫酸或稀硝酸酸化吗
不可以,无法确认是后续引入或转化的SO42- ,还是原溶液含有
四、硫酸根离子的检验
答题模板:
被检液 取清液 有无白色沉淀(判断有无 )
总结:
离子的检验步骤:取×××溶液少量于试管中,加入×××,有(或无)×××现象,则证明有(或无)某离子
易错警示
“先现象,后结论”
如向BaCl2溶液中加入稀H2SO4时,现象是“有白色沉淀生成”,
不能说成“有白色的BaSO4沉淀生成”
【真实情景思考】
现在我们炒菜用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?粗盐经溶解、过滤和蒸发后还含有硫酸盐及CaCl2、MgCl2等杂质。如何进行粗盐提纯吗?
【思考讨论】(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
引入了Ba2+、CO32-、OH-
试剂的用量和顺序
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
粗盐的提纯
(1) 经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果按照下表所示顺序除去它们,应加入什么试剂?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH- = Mg(OH)2↓
Na2CO3
【思考与讨论】
引入了Ba2+、CO32-、OH-
试剂的用量和顺序
Ba2++=BaSO4↓
Ca2++ = CaCO3↓
试剂添加顺序必须注意:
①Na2CO3必须在BaCl2之后,以除去过量的Ba2+
②盐酸必须在Na2CO3和NaOH之后,除CO32- 和OH-
③加盐酸前必须过滤,过滤后加入盐酸除去直至无气泡产生
④盐酸除去过量除杂剂,调节溶液酸碱性
①BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
几种过量试剂加入顺序
为保障杂质离子完全除去,只要 在 之后加入即可。
碳酸钠溶液
氯化钡溶液
仪器:烧杯,漏斗,玻璃棒,铁架台
过滤
操作要点:一贴、二低、三靠
一贴:滤纸要紧贴漏斗;
二低:滤纸要低于漏斗边缘;溶液要低于滤纸.
三靠:烧杯要紧靠在玻璃棒上;
玻璃棒紧靠在滤纸三层处;
漏斗下端紧靠在烧杯内壁.
过滤:利用物质的溶解性不同分离难溶物与可溶物
知识回顾
仪器:蒸发皿,酒精灯,铁架台,玻璃棒
蒸发
操作要点:
①蒸发皿的液体不超过容积的2/3
②加热时,用玻璃棒不断搅拌
③出现较多固体时,应停止加热,利用余热蒸干
④取下未冷却的蒸发皿时,要放在石棉网上
蒸发:利用溶液沸点不同加热使溶剂挥发,分离溶质与溶剂。
知识回顾
除杂原则
不增
1
2
3
不减
易分
四原则
4
易复原
不引入新的杂质
不可前门驱虎后门进狼
不能损耗或减少被提纯物质的量
不可玉石俱焚
被提纯物质与杂质易分离
不可难舍难分
被提纯物质易复原
归纳与整理
除杂须知
除杂试剂必须过量
1
四必须
斩草要除根
2
3
过量试剂必须除尽
去除多种杂质时必须考虑加入试剂的顺序
4
化必须选择最佳的除杂途径
防止引入新的杂质
归纳与整理
课堂小结
感谢您的聆听
如果没有硫酸,
许多现代工业都不可能存在。
傅 鹰
第2课时 硫酸
5-1 硫及其化合物
【学习目标与核心素养】
学习目标
1、了解浓硫酸的三大特性。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、掌握硫酸根离子的检验方法
核心素养
1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
硫酸
铅蓄电池
医药
化肥
农药
酸洗
试剂
干燥剂
炸药
我们都需要
化学工业之母
有人称硫酸是化学工业生产的“发动机”。
世界上常把硫酸的产量作为衡量
一个国家工业发达程度的标志
重要的化工原料,可用于制_____________、炸药、染料、盐类等。
一、硫酸的用途及工业制备
化肥、农药
硫酸用途
1
1、造气阶段:二氧化硫的制取和净化
2、催化氧化阶段:SO2氧化成SO3
3、生成阶段:三氧化硫的吸收和硫酸的生成
H2SO4·SO3 + H2O = 2H2SO4
SO3 + H2SO4(浓) == H2SO4·SO3
2、硫酸的工业制法
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
?
浓硫酸 稀硫酸
成分
物理性质
主要以H2SO4分子形式存在,有少量H+
主要以H+、SO42-
形式存在,没有H2SO4分子
二. 硫酸的性质
(一). 硫酸的组成、物理性质
无色无嗅透明
似水的液体
①纯净的硫酸是无色、黏稠、
难挥发的油状液体
②沸点高:纯硫酸难挥发,
沸点338℃。(高沸点酸)
③密度大:质量分数为98.3%的硫酸
的密度为1.84g/cm3
④易溶于水,能以任意比与水混溶,
稀释时放出大量的热
问:如何稀释浓硫酸?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
1、稀硫酸的性质
硫酸是强酸,具有酸的通性
2. 酸的通性
与指示剂显色
紫色石蕊变红
与活泼金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
1. 电离方程式
稀硫酸
Fe+2H+ = Fe2++H2↑
H++OH- = H2O(与强碱)
Fe2O3+6H+ = 2Fe3++3H2O
2H++CO32- =H2O+CO2↑
(二).硫酸的化学性质
实验验证
描述现象
结论
2. 浓硫酸的特性
(1) 吸水性:硫酸可吸收气体、液体中的水分子及结晶水合物中的结晶水,常用做干燥剂
杯中液面上升
吸收空气中的水蒸气
蓝色的硫酸铜晶体变为白色粉末
吸收晶体水
问:浓硫酸能干燥哪些气体?
可干燥酸性气体(如CO2、SO2、Cl2、HCl等)
可干燥中性气体(如H2、O2、N2等);
不能干燥碱性气体(NH3)和还原性气体(如H2S、HBr、HI等)
NH3 、CO2 、SO2、 H2、H2S、HI 、 HBr 、 CO 、 Cl2 、O2
下列气体不能用浓硫酸干燥?
浓硫酸
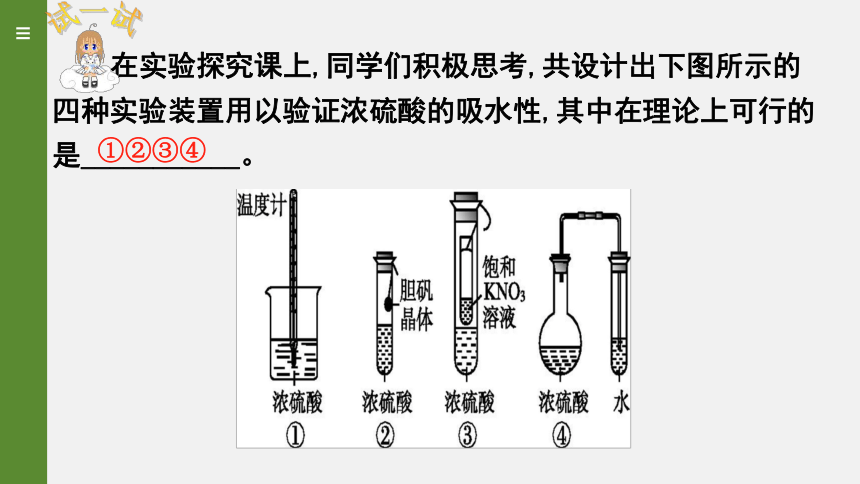
在实验探究课上,同学们积极思考,共设计出下图所示的四种实验装置用以验证浓硫酸的吸水性,其中在理论上可行的是___________。
试一试
仔细观察实验现象,并尝试解释实验现象。
现象 分析
蔗糖变黑
迅速膨胀,疏松多孔海绵状的固体
温度升高,有刺激性气味
浓硫酸的脱水性使蔗糖炭化
产生大量气体
过程中放出热量
思考:气体可能是什么,如何产生的?
(2) 脱水性:浓硫酸能把有机物中的氢氧原子按2:1的个数比脱去,
【黑面包实验】
C12H22O11
浓硫酸
12C+11H2O
蔗糖
脱水性
强氧化性
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
==
△
问:实验过程涉及到哪些化学反应?
注:
①有机物被浓硫酸脱去水并不一定都生成C
②把浓硫酸点在蓝色石蕊试纸上,将看到
试纸先变红,后变黑,变黑就是脱水炭化了
③若不慎将浓硫酸溅在皮肤上,应用大量
水进行冲洗,然后再涂上NaHCO3稀溶液
该实验结论:
浓硫酸具有脱水性(和强氧化性)
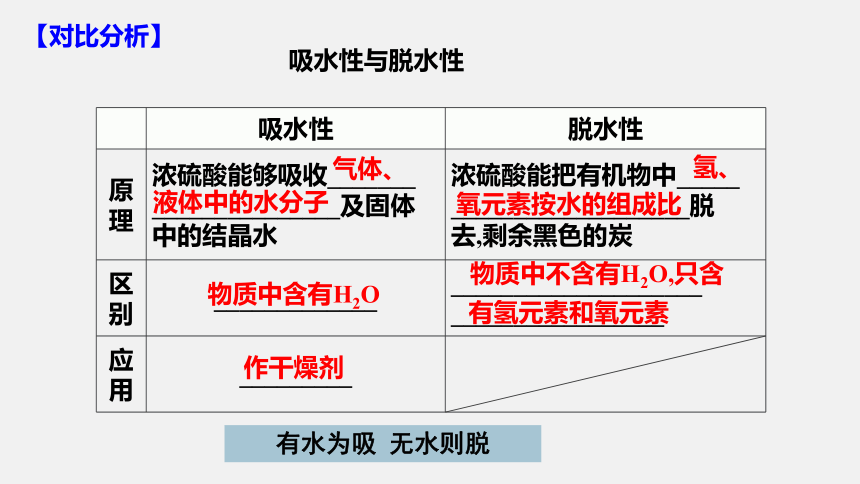
吸水性 脱水性
原理 浓硫酸能够吸收_______ _______________及固体 中的结晶水 浓硫酸能把有机物中_____
___________________脱
去,剩余黑色的炭
区别 _____________ ____________________
_________________
应用 _________
气体、
液体中的水分子
氢、
氧元素按水的组成比
物质中含有H2O
物质中不含有H2O,只含
有氢元素和氧元素
作干燥剂
吸水性与脱水性
【对比分析】
有水为吸 无水则脱
3、设计实验来验证浓硫酸与炭反应是否生成了二氧化碳、水和二氧化硫。
按正确的顺序连接下列仪器,并说明你的理由.
【思考与交流】
仪器连接如下:
检验水(白色固体为蓝色)
检验二氧化硫(品红褪色)
除去二氧化硫(溶液褪色)
检验二氧化硫是否除尽
检验二氧化碳(溶液变浑浊)
(3) 强氧化性
(1)与金属的反应
实验现象
将a试管里的溶液慢慢倒入水中,溶液变为_____
a试管中铜丝表面__________________________
b试管中的品红溶液逐渐变为________
c试管中的紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
氧化性和酸性
硫酸盐和SO2
【实验5-3】
根据金属活动性,铝比锌活泼,工业上为何能用铝槽车和铁罐车盛放、运输浓硫酸?
(2)常温下,冷的浓硫酸能使Fe、Al钝化(使金属表面生成一层致密的氧化物)钝化是化学变化 。工业上用铝槽车和铁罐车盛放、运输浓硫酸。
(3)与具有还原性的化合物反应,如H2S、HI、HBr、FeCl2等。
H2S+3H2SO4 = 4SO2↑+4H2O
如将少量铁放入浓硫酸中加热,会发生反应。反应开始的一段时间内生成的气体是H2吗?
思考﹒ 运用
你认为是什么气体?
如将过量的铁与浓硫酸加热,会得到什么气体?
【课堂练习】
1.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为____________________________________________。
利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为____________________________________。
以上两种方法哪种好?______________,原因是___________________
_____________________________________________________________
______________________。
第一种方法好
①制得相同质量的产品,第一种方法消耗的硫酸少,②第二种方法生成SO2,会造成大气污染,③第一种方法节约能源
问:如何鉴别浓硫酸与稀硫酸?
方法 操作 结论
脱水法 用玻璃棒蘸取两液体分别涂在纸上 变黑者是浓硫酸
稀释法 分别加入盛水的试管中 明显放热者是浓硫酸
吸水法 分别滴加到硫酸铜晶体(CuSO4·5H2O)上 蓝色晶体变白者是浓硫酸
钝化法 常温下,取已去氧化膜的两块铝片(或铁片)分别放入盛有浓、稀硫酸的试管中 有大量气泡冒出的是稀硫酸,无明显现象的是浓硫酸
生雾法 分别滴加到浓盐酸中 有白雾产生的是浓硫酸
观察法 分别用玻璃棒蘸取两液体 黏稠状的是浓硫酸
密度法 分别称量相同体积的两液体 质量大的是浓硫酸
氧化法 分别取两支试管,加入铜片后再分别加入两液体,加热 溶液变蓝,有刺激性气味气体产生的是浓硫酸
如何检验硫酸根离子?
硫酸盐
一些含 结晶水的硫酸盐 叫做 矾 。
胆矾 ,绿矾 ,
皓矾 ,明矾 ,
生石膏 ,熟石膏 ,
重晶石 。
CuSO4·5H2O
FeSO4·7H2O
ZnSO4·7H2O
KAl(SO4)2·12H2O
BaSO4
2CaSO4·H2O
CaSO4·2H2O
拓展
如何检验硫酸根离子?
实验操作
实验现象 先 ,加入盐酸后______ 先 ,加入盐酸后______ 先_____________,加入盐酸后_______________
【实验5-4】
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且有气泡产生
实验结论 SO42-与Ba2+反应生成不溶于盐酸的_____, 离子方程式:____________________ CO32-与Ba2+反应生成的白色沉淀BaCO3,可溶于盐酸
白色沉淀
SO42- + Ba2+ = BaSO4↓
加稀盐酸的目的是排除 CO32- 、SO32- 、Ag+干扰
问题一.盐酸的作用?
问题二.检验溶液中是否含有SO42-时,可用稀硫酸或稀硝酸酸化吗
不可以,无法确认是后续引入或转化的SO42- ,还是原溶液含有
四、硫酸根离子的检验
答题模板:
被检液 取清液 有无白色沉淀(判断有无 )
总结:
离子的检验步骤:取×××溶液少量于试管中,加入×××,有(或无)×××现象,则证明有(或无)某离子
易错警示
“先现象,后结论”
如向BaCl2溶液中加入稀H2SO4时,现象是“有白色沉淀生成”,
不能说成“有白色的BaSO4沉淀生成”
【真实情景思考】
现在我们炒菜用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?粗盐经溶解、过滤和蒸发后还含有硫酸盐及CaCl2、MgCl2等杂质。如何进行粗盐提纯吗?
【思考讨论】(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
引入了Ba2+、CO32-、OH-
试剂的用量和顺序
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
粗盐的提纯
(1) 经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果按照下表所示顺序除去它们,应加入什么试剂?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH- = Mg(OH)2↓
Na2CO3
【思考与讨论】
引入了Ba2+、CO32-、OH-
试剂的用量和顺序
Ba2++=BaSO4↓
Ca2++ = CaCO3↓
试剂添加顺序必须注意:
①Na2CO3必须在BaCl2之后,以除去过量的Ba2+
②盐酸必须在Na2CO3和NaOH之后,除CO32- 和OH-
③加盐酸前必须过滤,过滤后加入盐酸除去直至无气泡产生
④盐酸除去过量除杂剂,调节溶液酸碱性
①BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
几种过量试剂加入顺序
为保障杂质离子完全除去,只要 在 之后加入即可。
碳酸钠溶液
氯化钡溶液
仪器:烧杯,漏斗,玻璃棒,铁架台
过滤
操作要点:一贴、二低、三靠
一贴:滤纸要紧贴漏斗;
二低:滤纸要低于漏斗边缘;溶液要低于滤纸.
三靠:烧杯要紧靠在玻璃棒上;
玻璃棒紧靠在滤纸三层处;
漏斗下端紧靠在烧杯内壁.
过滤:利用物质的溶解性不同分离难溶物与可溶物
知识回顾
仪器:蒸发皿,酒精灯,铁架台,玻璃棒
蒸发
操作要点:
①蒸发皿的液体不超过容积的2/3
②加热时,用玻璃棒不断搅拌
③出现较多固体时,应停止加热,利用余热蒸干
④取下未冷却的蒸发皿时,要放在石棉网上
蒸发:利用溶液沸点不同加热使溶剂挥发,分离溶质与溶剂。
知识回顾
除杂原则
不增
1
2
3
不减
易分
四原则
4
易复原
不引入新的杂质
不可前门驱虎后门进狼
不能损耗或减少被提纯物质的量
不可玉石俱焚
被提纯物质与杂质易分离
不可难舍难分
被提纯物质易复原
归纳与整理
除杂须知
除杂试剂必须过量
1
四必须
斩草要除根
2
3
过量试剂必须除尽
去除多种杂质时必须考虑加入试剂的顺序
4
化必须选择最佳的除杂途径
防止引入新的杂质
归纳与整理
课堂小结
感谢您的聆听
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
