化学人教版(2019)必修第二册6.1.1化学能与热能(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.1化学能与热能(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 34.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-02 23:21:40 | ||
图片预览









文档简介
(共39张PPT)
【情境引入】
火箭发射的动力是什么?
能 量
你一定想知道,这种能量从何而来?
它与化学物质和化学反应有什么关系?
请随我一起走进教材第六章:化学反应与能量。
第六章 化学反应与能量
第一节 化学反应与能量变化
化学反应与光能、热能、电能...
“暖宝宝”中含有铁粉、活性炭、水、氯化钠等物质,遇空气发生反应的化学方程式:
4Fe+3O2+6H2O=4Fe(OH)3
该过程放热
思考:
生活中哪些事实说明了在化学反应中伴随着能量的变化?请说出能量转化的方式。
现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,是人类获取能量的重要途径。
第六章 化学反应与能量
第一节 化学反应与能量变化
第1课时 化学反应与热能
【学习目标与核心素养】
学习目标
1、理解化学反应中能量变化的主要原因——化学键的断裂和形成
2、知道化学反应中的能量变化和物质具有的能量之间的关系
3、了解吸热反应和放热反应的概念,熟知常见的吸热反应和放热反应
核心素养
1、 理解化学反应中能量的变化取决于反应物与生成物的总能量的相对大小
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
思考1、用眼睛不能直接观察到反应中的热量变化,那么,应采取哪些简单易行的办法来了解反应中的热量变化
可以用手触摸反应容器的器壁感受温度变化,也可以利用温度计测量反应前后温度变化。发光、引燃后撤去热源继续反应、熔化和结冰、气体的热胀冷缩等
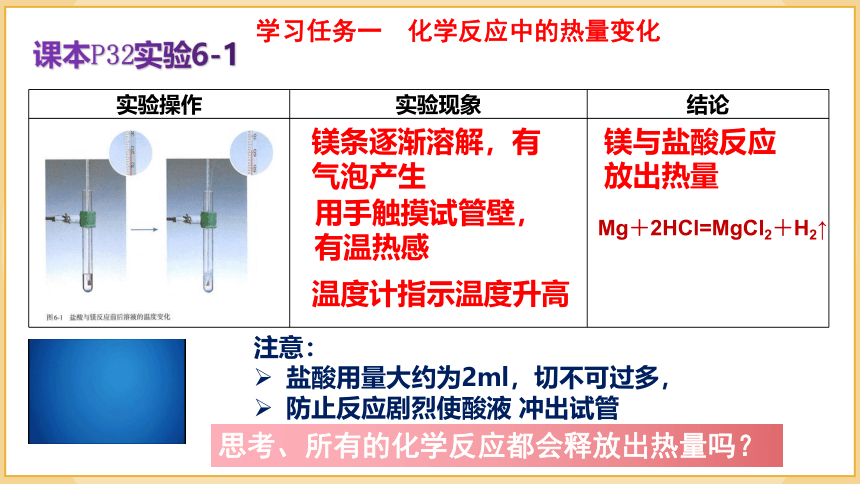
实验操作 实验现象 结论
镁条逐渐溶解,有气泡产生
镁与盐酸反应放出热量
用手触摸试管壁,有温热感
温度计指示温度升高
课本P32实验6-1
Mg+2HCl=MgCl2+H2↑
注意:
盐酸用量大约为2ml,切不可过多,
防止反应剧烈使酸液 冲出试管
学习任务一 化学反应中的热量变化
思考、所有的化学反应都会释放出热量吗?
实验操作 实验现象 实验结论
该反应产生NH3,吸收热量
以上两个实验中,化学反应前后的温度变化说明化学反应过程中伴有热量的释放或吸收
课本P33实验6-2
①有刺激性气味气体产生、
②用手摸烧杯底部有冰凉感觉、
③用手拿起烧杯,木片粘结到烧杯的底部
④烧杯中的反应物呈糊状
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
注意:
强碱Ba(OH)2 8H2O有毒,不要用手直接接触
实验结束后立即向烧杯中加入稀盐酸,处理尾气。
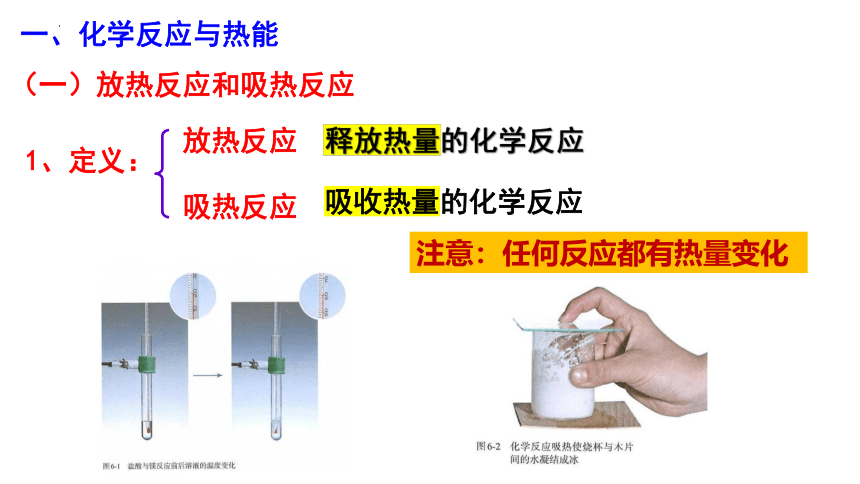
一、化学反应与热能
释放热量的化学反应
吸收热量的化学反应
1、定义:
吸热反应
放热反应
注意:任何反应都有热量变化
(一)放热反应和吸热反应
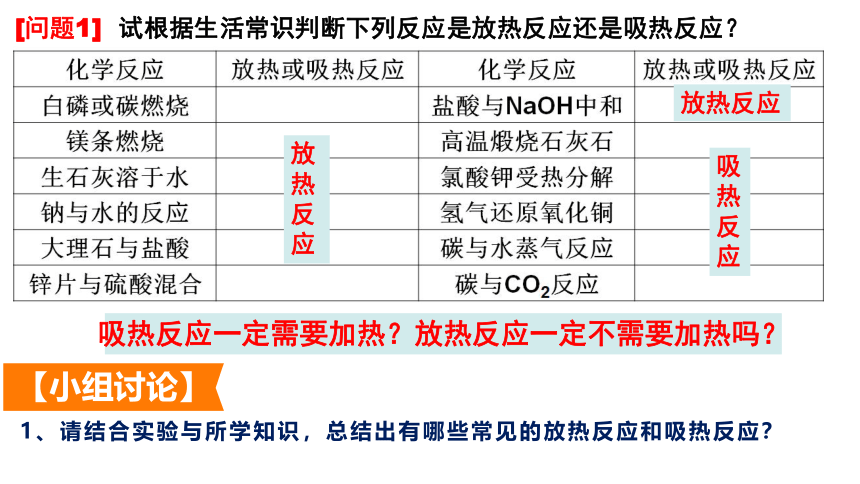
[问题1] 试根据生活常识判断下列反应是放热反应还是吸热反应?
放热反应
放热反应
吸热反应
吸热反应一定需要加热?放热反应一定不需要加热吗?
【小组讨论】
1、请结合实验与所学知识,总结出有哪些常见的放热反应和吸热反应?
2、常见放热反应和吸热反应类型
(1)常见放热反应
(2)常见吸热反应
①金属与水或酸置换
②中和反应
③大部分化合反应
④燃料的燃烧
⑤物质的缓慢氧化
①铵盐与碱的反应
②大部分分解反应
③盐酸与碳酸氢钠
④ 以C与CO为还原剂的氧化还原反应
例如,C+H2O==CO+H2
高温
C+CO2=2CO吸热反应
Ba(OH)2·8H2O+NH4Cl
H2O2分解反应为放热反应
思考:有人说,稀释浓硫酸、固体烧碱溶解都放热,故是放热反应。溶解NH4NO3固体吸热,故是吸热反应。你认为正确吗?为什么?
1.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。铁粉和硫粉加热才能发生反应,属于吸热反应吗
典题精练
化学反应的放热与吸热与反应条件没有关系。需要加热的反应不一定是吸热反应;放热的反应不一定不需要加热
2.于谦的这首诗中,涉及哪些反应 请写出这些反应的化学方程式,并指明反应是放热反应还是吸热反应。
提示:CaCO3====CaO+CO2↑ 吸热反应
CaO+H2O====Ca(OH)2 放热反应
Ca(OH)2 +CO2====CaCO3↓+H2O 放热反应
高温
【思考与交流】
化学反应过程中为什么会有能量的变化?为什么有的化学反应释放热量,有的化学反应吸收热量?从化学反应的本质角度又如何解释呢?
物质中的原子之间是通过化学键相结合的,当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。
(1)在1 mol氢分子中,含有 mol氢原子,含有 mol H—H键。
(2)已知在25 ℃和101 kPa条件下,由2 mol H原子形成1 mol H—H键时,放出436 kJ的能量。若要使1 mol氢分子变为2 mol氢原子时,需要断开1 mol H—H键,其能量变化是 。
2
1
吸收436 kJ的能量
例如
(1)CH4的结构式是 ,1 mol CH4分子中含有 mol C—H键。
(2)在CH4中,断开1 mol C—H键要吸收415 kJ的能量。若要形成
1 mol CH4中的C—H键其能量变化是 。
4
放出4 mol×415 kJ·mol-1
=1 660 kJ的能量
又如
结论:在相同条件下,由原子形成1 mol化学键时所 ,与断开1 mol相同化学键所 是相等的。
放出的能量
吸收的能量
断开1 mol H-H 键要吸收 436 kJ 的能量
断开1 mol Cl-Cl 键要吸收 243 kJ 的能量
生成1 mol H-Cl 键要释放 431 kJ 的能量
H2 + Cl2 = 2HCl
E吸收=436+243=679 kJ
E放出=431×2=862 kJ
E1< E2 放热反应
E(kJ)
反应历程
H2 + Cl2
2H+2Cl
2HCl
-183 kJ
+436 kJ (H2)
+243 kJ (Cl2)
2×(-431 kJ)
= - 862 kJ
能量变化关系示意图
能量变化取决于断键吸收的总能量与成键放出的总能量的相对大小
1、化学反应的实质
旧键断裂
新键形成
吸热
放热
吸收能量E1>释放能量E2 该反应为吸热反应
吸收能量E1<释放能量E2 该反应为放热反应
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
(二)化学反应的能量变化的本质
H=反应物的总键能—生成物的总键能
【键能】
定义:形成1mol化学键所放出的能量或 断裂1mol化学键所吸收的能量
共价键 键能 共价键 键能
H-H 436 C-H 415.0
Cl-Cl 247 O-H 462.8
I-I 152.7 H-Cl 431.8
键能越大→化学键越牢固→物质越稳定
思考:物质越稳定和键能及能量又怎样的关系呢?
【注意】
物质的能量
微观粒子都在不停地运动和相互作用着,如分子平动能、分子转动能、分子振动能、分子间势能、原子间键能、电子运动能、核内基本粒子间核能等等。系统内部这些能量的总和叫做系统的内能即热力学能,也就是中学教材上所说的物质具有的能量。
物质的能量和物质稳定性的关系是什么?
冰
水
水蒸气
温度不断升高,自身能量不断增大,稳定性越来越低
能量越低,越稳定;键能越高,越稳定。
物质本身具有的能量越低→物质越稳定
能量
练习 断开1mol石墨与金刚石中的化学键所需要吸收的能量(键能)
分别是Q1和Q2(Q1>Q2)
试分析:
1、石墨和金刚石相比较,相对稳定的是 。
2、石墨和金刚石所具有的能量相对较低的是 。
3、石墨在一定条件下转化为金刚石是 反应
石墨
C
石墨
吸热
石墨
金刚石
【练习】
计算:2H2 + O2= 2H2O 反应中能量变化的数值标注在下图中。
E吸=
____KJ
E放=
____KJ
共价键 键能 共价键 键能 共价键 键能
H-H 436 O=O 496 H-O 463
整个反应过程(放出/吸收)
__________________kJ热量
放出484
1368
1852
断键吸收的能量
成键释放的能量
E吸 < E放
【放热反应】
E吸 > E放
【吸热反应】
3、化学反应过程的能量变化图(微观)
断键吸收的能量
成键释放的能量
【思考与交流】
1、化学反应的本质是什么?请从反应本质角度思考,有些放热反应需加热才能进行,加热的目的是什么?
提供反应物断键所需的能量
2、为什么有些反应需加热才能发生,有些反应不需加热就能发生?
断开不同的化学键所需能量不同
练习1.
1 mol H2
共价键断裂
吸收436 kJ能量
2 mol H
0.5 mol O2
共价键断裂
吸收249 kJ能量
1 mol O
共价键形成
释放930 kJ能量
1 mol H2O
吸收的能量:685 kJ
释放的能量:930 kJ
<
放热反应
请根据下列信息判断氢气燃烧生成水蒸气时是吸热反应还是放热反应。
【课堂练习】
注意:放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
反应物的总能量>生成物的总能量
化学反应放出能量
反应物的总能量
生成物的总能量
能量的释放
[思考]各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。根据下述示意图判断反应物、生物物具有的总能量相对大小与放热反应和吸热反应有何关系?
反应物的总能量<生成物的总能量
化学反应吸收能量
反应物的总能量
生成物的总能量
能量的吸收
请同学们画出相应的反应过程与物质能量示意图
生成物
的 总能量
能量
能量
生成物
的总能量
反应物
的总能量
图1反应进程
反 应 物 的总能量
图2反应进程
吸收热量
放出热量
①反应物总能量 小于 生成物总能量,为吸热反应。
②反应物的总能量大于生成物的总能量时 为放热反应
能量变化取决于反应物的总能量与生成物的总能量的相对大小
4.化学反应的能量变化的宏观分析
H=生成物的总能量—反应物的总能量
小组讨论:学会辨别能量-过程图
对于反应N2+3H2=2NH3,在图中找出:
(1)反应物总能量
(2)生成物总能量
(3)断键吸收的能量
(4)成键释放的能量
(5)该反应属于 反应
E2
E1
E3-E2
E3-E1
放热
1、宏观角度:物质的能量
2、微观角度:化学键断裂与形成
用图像表征以上两个角度的吸、放热反应过程
如何判断一个化学反应完成后的结果是吸热还是放热?
总 结
反应物总能量
生成物总能量
能
量
E断
E成
E反> E生
E断< E成
放热反应
根据反应物与生成物
总能量的相对大小
比较断键吸收的能量与
成键释放的能量的相对大小
注意 物质的能量越低 越稳定而键能越高,键能物质本身能量相反
【例1】已知反应A + B === C + D的能量变化如图所示,下列关于此反应的说法不正确的是( )
A.是吸热反应
B.该反应不符合能量守恒定律
C.生成物的总能量高于反应物的总能量
D.反应中断开化学键吸收的总能量高于
形成化学键放出的总能量
B
题型一:能量变化图
【例2】已知部分键能如下表所示,计算下列三个反应中的能量变化情况。
(1)CH4 + 2O2 ==== CO2 + 2H2O,1 mol CH4完全反应时,_________(填吸收/放出)________ kJ能量。
(2)已知N2 + 3H2 ==== 2NH3,消耗1 mol N2 时放出92 kJ的热量,则上表中x的数值为 ________。
(3)如下图为白磷(P4)和P4O6的结构,1mol 白磷完全
燃烧生成P4O6,________(填吸收/放出)________kJ能量。
题型二:键能的计算
化学键 H—H H—N N≡N O=O C—H C=O H—O P—P P—O
键能(kJ/mol) 436 391 x 498 414 750 465 198 360
放出
946
放出 1638
708
小结
反应类型 放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
宏观原因
微观原因
图示
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
成键时释放的总能量大于断键时吸收的总能量
成键时释放的总能量小于断键时吸收的总能量
H=反应物的总键能—生成物的总键能
H=生成物的总能量—反应物的总能量
消费量(折合成标准煤)/万吨 消费总量 分类消费总量
煤炭 石油 天然气 水电、风电、核电
429905 273849 78673 25364 52019
占比/ % 100 64 18 6 12
2015年我国能源消费总量和构成
2、利用过程中面临两个问题
自主学习
[问题2]阅读必修二教材第34-35页,回答下列有关问题:
1、现阶段人类获取热能的主要途径是什么?使用最多的常规能源有哪些?
2、从我国能源消费总量和构成角度,了解我国能源利用存在哪些问题?
1、人类利用能源的三个阶段:柴草时期、化石能源时期和多能源结构时期。
能源的不可再生,储量有限;产生大量大气污染物。
二、人类对能源的利用
为了改善人类的生存环境,促进社会可持续发展,节能和寻找清洁的新能源成为人类的必然选择
地热能
3、解决办法
节约能源
寻找新能源
燃料燃烧阶段——改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率
能量利用阶段——使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
新能源特点:资源丰富、可以再生、无污染
常见新能源:太阳能、风能、地热能、海洋能、氢能等
【思考与讨论】
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法或建议,并与同学讨论。
1.在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是____(填字母,下同)。
A.石油 B.煤 C.天然气 D.生物质能
D
课堂练习
(2)下列对能源的看法合理的是_______。
A.化石能源属于不可再生能源,只会越用越少
B.生物质能是一种可再生能源,有广泛的前景
C.太阳能、氢能、核能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约
型社会
ABCD
典题精练
1.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2D
2、在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。化学方程式分别为P4(s)+5O2(g)===P4O10(s);4P(s)+5O2(g)===P4O10(s)。由此判断,下列说法正确的是 ( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
D
(2)已知在高温、高压、催化剂作用下,1 mol C(石墨)转化为C(金刚石),吸收1.9 kJ的热量。
①该反应________(填“是”或“不是”)吸热反应。
②C(石墨)和C(金刚石)相比,____________能量高,____________更稳定。
③推测C(石墨)与C(金刚石)各1 mol在相同条件下燃烧,________________放出的热量多。
是
C(金刚石) C(石墨)
C(金刚石)
3.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,
说明这个反应是___________(填“吸热”或“放热”)
反应,NO2和CO的总能量________
(填“大于”“小于”或“等于”)CO2和NO的总能量。
放热
大于
课堂小结
放热反应
吸热反应
1、常见的吸、放热反应
2、化学反应中能量变化的原因
3、化学反应中能量的利用情况和节能减排的意义。
【情境引入】
火箭发射的动力是什么?
能 量
你一定想知道,这种能量从何而来?
它与化学物质和化学反应有什么关系?
请随我一起走进教材第六章:化学反应与能量。
第六章 化学反应与能量
第一节 化学反应与能量变化
化学反应与光能、热能、电能...
“暖宝宝”中含有铁粉、活性炭、水、氯化钠等物质,遇空气发生反应的化学方程式:
4Fe+3O2+6H2O=4Fe(OH)3
该过程放热
思考:
生活中哪些事实说明了在化学反应中伴随着能量的变化?请说出能量转化的方式。
现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,是人类获取能量的重要途径。
第六章 化学反应与能量
第一节 化学反应与能量变化
第1课时 化学反应与热能
【学习目标与核心素养】
学习目标
1、理解化学反应中能量变化的主要原因——化学键的断裂和形成
2、知道化学反应中的能量变化和物质具有的能量之间的关系
3、了解吸热反应和放热反应的概念,熟知常见的吸热反应和放热反应
核心素养
1、 理解化学反应中能量的变化取决于反应物与生成物的总能量的相对大小
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
思考1、用眼睛不能直接观察到反应中的热量变化,那么,应采取哪些简单易行的办法来了解反应中的热量变化
可以用手触摸反应容器的器壁感受温度变化,也可以利用温度计测量反应前后温度变化。发光、引燃后撤去热源继续反应、熔化和结冰、气体的热胀冷缩等
实验操作 实验现象 结论
镁条逐渐溶解,有气泡产生
镁与盐酸反应放出热量
用手触摸试管壁,有温热感
温度计指示温度升高
课本P32实验6-1
Mg+2HCl=MgCl2+H2↑
注意:
盐酸用量大约为2ml,切不可过多,
防止反应剧烈使酸液 冲出试管
学习任务一 化学反应中的热量变化
思考、所有的化学反应都会释放出热量吗?
实验操作 实验现象 实验结论
该反应产生NH3,吸收热量
以上两个实验中,化学反应前后的温度变化说明化学反应过程中伴有热量的释放或吸收
课本P33实验6-2
①有刺激性气味气体产生、
②用手摸烧杯底部有冰凉感觉、
③用手拿起烧杯,木片粘结到烧杯的底部
④烧杯中的反应物呈糊状
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
注意:
强碱Ba(OH)2 8H2O有毒,不要用手直接接触
实验结束后立即向烧杯中加入稀盐酸,处理尾气。
一、化学反应与热能
释放热量的化学反应
吸收热量的化学反应
1、定义:
吸热反应
放热反应
注意:任何反应都有热量变化
(一)放热反应和吸热反应
[问题1] 试根据生活常识判断下列反应是放热反应还是吸热反应?
放热反应
放热反应
吸热反应
吸热反应一定需要加热?放热反应一定不需要加热吗?
【小组讨论】
1、请结合实验与所学知识,总结出有哪些常见的放热反应和吸热反应?
2、常见放热反应和吸热反应类型
(1)常见放热反应
(2)常见吸热反应
①金属与水或酸置换
②中和反应
③大部分化合反应
④燃料的燃烧
⑤物质的缓慢氧化
①铵盐与碱的反应
②大部分分解反应
③盐酸与碳酸氢钠
④ 以C与CO为还原剂的氧化还原反应
例如,C+H2O==CO+H2
高温
C+CO2=2CO吸热反应
Ba(OH)2·8H2O+NH4Cl
H2O2分解反应为放热反应
思考:有人说,稀释浓硫酸、固体烧碱溶解都放热,故是放热反应。溶解NH4NO3固体吸热,故是吸热反应。你认为正确吗?为什么?
1.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。铁粉和硫粉加热才能发生反应,属于吸热反应吗
典题精练
化学反应的放热与吸热与反应条件没有关系。需要加热的反应不一定是吸热反应;放热的反应不一定不需要加热
2.于谦的这首诗中,涉及哪些反应 请写出这些反应的化学方程式,并指明反应是放热反应还是吸热反应。
提示:CaCO3====CaO+CO2↑ 吸热反应
CaO+H2O====Ca(OH)2 放热反应
Ca(OH)2 +CO2====CaCO3↓+H2O 放热反应
高温
【思考与交流】
化学反应过程中为什么会有能量的变化?为什么有的化学反应释放热量,有的化学反应吸收热量?从化学反应的本质角度又如何解释呢?
物质中的原子之间是通过化学键相结合的,当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。
(1)在1 mol氢分子中,含有 mol氢原子,含有 mol H—H键。
(2)已知在25 ℃和101 kPa条件下,由2 mol H原子形成1 mol H—H键时,放出436 kJ的能量。若要使1 mol氢分子变为2 mol氢原子时,需要断开1 mol H—H键,其能量变化是 。
2
1
吸收436 kJ的能量
例如
(1)CH4的结构式是 ,1 mol CH4分子中含有 mol C—H键。
(2)在CH4中,断开1 mol C—H键要吸收415 kJ的能量。若要形成
1 mol CH4中的C—H键其能量变化是 。
4
放出4 mol×415 kJ·mol-1
=1 660 kJ的能量
又如
结论:在相同条件下,由原子形成1 mol化学键时所 ,与断开1 mol相同化学键所 是相等的。
放出的能量
吸收的能量
断开1 mol H-H 键要吸收 436 kJ 的能量
断开1 mol Cl-Cl 键要吸收 243 kJ 的能量
生成1 mol H-Cl 键要释放 431 kJ 的能量
H2 + Cl2 = 2HCl
E吸收=436+243=679 kJ
E放出=431×2=862 kJ
E1< E2 放热反应
E(kJ)
反应历程
H2 + Cl2
2H+2Cl
2HCl
-183 kJ
+436 kJ (H2)
+243 kJ (Cl2)
2×(-431 kJ)
= - 862 kJ
能量变化关系示意图
能量变化取决于断键吸收的总能量与成键放出的总能量的相对大小
1、化学反应的实质
旧键断裂
新键形成
吸热
放热
吸收能量E1>释放能量E2 该反应为吸热反应
吸收能量E1<释放能量E2 该反应为放热反应
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
(二)化学反应的能量变化的本质
H=反应物的总键能—生成物的总键能
【键能】
定义:形成1mol化学键所放出的能量或 断裂1mol化学键所吸收的能量
共价键 键能 共价键 键能
H-H 436 C-H 415.0
Cl-Cl 247 O-H 462.8
I-I 152.7 H-Cl 431.8
键能越大→化学键越牢固→物质越稳定
思考:物质越稳定和键能及能量又怎样的关系呢?
【注意】
物质的能量
微观粒子都在不停地运动和相互作用着,如分子平动能、分子转动能、分子振动能、分子间势能、原子间键能、电子运动能、核内基本粒子间核能等等。系统内部这些能量的总和叫做系统的内能即热力学能,也就是中学教材上所说的物质具有的能量。
物质的能量和物质稳定性的关系是什么?
冰
水
水蒸气
温度不断升高,自身能量不断增大,稳定性越来越低
能量越低,越稳定;键能越高,越稳定。
物质本身具有的能量越低→物质越稳定
能量
练习 断开1mol石墨与金刚石中的化学键所需要吸收的能量(键能)
分别是Q1和Q2(Q1>Q2)
试分析:
1、石墨和金刚石相比较,相对稳定的是 。
2、石墨和金刚石所具有的能量相对较低的是 。
3、石墨在一定条件下转化为金刚石是 反应
石墨
C
石墨
吸热
石墨
金刚石
【练习】
计算:2H2 + O2= 2H2O 反应中能量变化的数值标注在下图中。
E吸=
____KJ
E放=
____KJ
共价键 键能 共价键 键能 共价键 键能
H-H 436 O=O 496 H-O 463
整个反应过程(放出/吸收)
__________________kJ热量
放出484
1368
1852
断键吸收的能量
成键释放的能量
E吸 < E放
【放热反应】
E吸 > E放
【吸热反应】
3、化学反应过程的能量变化图(微观)
断键吸收的能量
成键释放的能量
【思考与交流】
1、化学反应的本质是什么?请从反应本质角度思考,有些放热反应需加热才能进行,加热的目的是什么?
提供反应物断键所需的能量
2、为什么有些反应需加热才能发生,有些反应不需加热就能发生?
断开不同的化学键所需能量不同
练习1.
1 mol H2
共价键断裂
吸收436 kJ能量
2 mol H
0.5 mol O2
共价键断裂
吸收249 kJ能量
1 mol O
共价键形成
释放930 kJ能量
1 mol H2O
吸收的能量:685 kJ
释放的能量:930 kJ
<
放热反应
请根据下列信息判断氢气燃烧生成水蒸气时是吸热反应还是放热反应。
【课堂练习】
注意:放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
反应物的总能量>生成物的总能量
化学反应放出能量
反应物的总能量
生成物的总能量
能量的释放
[思考]各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。根据下述示意图判断反应物、生物物具有的总能量相对大小与放热反应和吸热反应有何关系?
反应物的总能量<生成物的总能量
化学反应吸收能量
反应物的总能量
生成物的总能量
能量的吸收
请同学们画出相应的反应过程与物质能量示意图
生成物
的 总能量
能量
能量
生成物
的总能量
反应物
的总能量
图1反应进程
反 应 物 的总能量
图2反应进程
吸收热量
放出热量
①反应物总能量 小于 生成物总能量,为吸热反应。
②反应物的总能量大于生成物的总能量时 为放热反应
能量变化取决于反应物的总能量与生成物的总能量的相对大小
4.化学反应的能量变化的宏观分析
H=生成物的总能量—反应物的总能量
小组讨论:学会辨别能量-过程图
对于反应N2+3H2=2NH3,在图中找出:
(1)反应物总能量
(2)生成物总能量
(3)断键吸收的能量
(4)成键释放的能量
(5)该反应属于 反应
E2
E1
E3-E2
E3-E1
放热
1、宏观角度:物质的能量
2、微观角度:化学键断裂与形成
用图像表征以上两个角度的吸、放热反应过程
如何判断一个化学反应完成后的结果是吸热还是放热?
总 结
反应物总能量
生成物总能量
能
量
E断
E成
E反> E生
E断< E成
放热反应
根据反应物与生成物
总能量的相对大小
比较断键吸收的能量与
成键释放的能量的相对大小
注意 物质的能量越低 越稳定而键能越高,键能物质本身能量相反
【例1】已知反应A + B === C + D的能量变化如图所示,下列关于此反应的说法不正确的是( )
A.是吸热反应
B.该反应不符合能量守恒定律
C.生成物的总能量高于反应物的总能量
D.反应中断开化学键吸收的总能量高于
形成化学键放出的总能量
B
题型一:能量变化图
【例2】已知部分键能如下表所示,计算下列三个反应中的能量变化情况。
(1)CH4 + 2O2 ==== CO2 + 2H2O,1 mol CH4完全反应时,_________(填吸收/放出)________ kJ能量。
(2)已知N2 + 3H2 ==== 2NH3,消耗1 mol N2 时放出92 kJ的热量,则上表中x的数值为 ________。
(3)如下图为白磷(P4)和P4O6的结构,1mol 白磷完全
燃烧生成P4O6,________(填吸收/放出)________kJ能量。
题型二:键能的计算
化学键 H—H H—N N≡N O=O C—H C=O H—O P—P P—O
键能(kJ/mol) 436 391 x 498 414 750 465 198 360
放出
946
放出 1638
708
小结
反应类型 放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
宏观原因
微观原因
图示
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
成键时释放的总能量大于断键时吸收的总能量
成键时释放的总能量小于断键时吸收的总能量
H=反应物的总键能—生成物的总键能
H=生成物的总能量—反应物的总能量
消费量(折合成标准煤)/万吨 消费总量 分类消费总量
煤炭 石油 天然气 水电、风电、核电
429905 273849 78673 25364 52019
占比/ % 100 64 18 6 12
2015年我国能源消费总量和构成
2、利用过程中面临两个问题
自主学习
[问题2]阅读必修二教材第34-35页,回答下列有关问题:
1、现阶段人类获取热能的主要途径是什么?使用最多的常规能源有哪些?
2、从我国能源消费总量和构成角度,了解我国能源利用存在哪些问题?
1、人类利用能源的三个阶段:柴草时期、化石能源时期和多能源结构时期。
能源的不可再生,储量有限;产生大量大气污染物。
二、人类对能源的利用
为了改善人类的生存环境,促进社会可持续发展,节能和寻找清洁的新能源成为人类的必然选择
地热能
3、解决办法
节约能源
寻找新能源
燃料燃烧阶段——改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率
能量利用阶段——使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
新能源特点:资源丰富、可以再生、无污染
常见新能源:太阳能、风能、地热能、海洋能、氢能等
【思考与讨论】
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法或建议,并与同学讨论。
1.在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是____(填字母,下同)。
A.石油 B.煤 C.天然气 D.生物质能
D
课堂练习
(2)下列对能源的看法合理的是_______。
A.化石能源属于不可再生能源,只会越用越少
B.生物质能是一种可再生能源,有广泛的前景
C.太阳能、氢能、核能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约
型社会
ABCD
典题精练
1.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2
2、在25 ℃,101 kPa下,1 mol的白磷(化学式为P4)完全燃烧放出的热量比4 mol的红磷(化学式为P)完全燃烧放出的热量多。化学方程式分别为P4(s)+5O2(g)===P4O10(s);4P(s)+5O2(g)===P4O10(s)。由此判断,下列说法正确的是 ( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
D
(2)已知在高温、高压、催化剂作用下,1 mol C(石墨)转化为C(金刚石),吸收1.9 kJ的热量。
①该反应________(填“是”或“不是”)吸热反应。
②C(石墨)和C(金刚石)相比,____________能量高,____________更稳定。
③推测C(石墨)与C(金刚石)各1 mol在相同条件下燃烧,________________放出的热量多。
是
C(金刚石) C(石墨)
C(金刚石)
3.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,
说明这个反应是___________(填“吸热”或“放热”)
反应,NO2和CO的总能量________
(填“大于”“小于”或“等于”)CO2和NO的总能量。
放热
大于
课堂小结
放热反应
吸热反应
1、常见的吸、放热反应
2、化学反应中能量变化的原因
3、化学反应中能量的利用情况和节能减排的意义。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
