化学人教版(2019)必修第二册6.1.2化学能与电能(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.2化学能与电能(共34张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 14.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-02 23:15:08 | ||
图片预览









文档简介
(共34张PPT)
能源的多样性
水能
风能
石油
天然气
蒸汽
电能
原煤
同学们你知道有那些能源吗?
标准 分类 定义 举例
按转换过程分 一次能源 从自然界直接取得的自然资源 煤、石油、天然气等化石燃料,水能、风能、生物质能、太阳能等
二次能源 一次能源经过加工转换后获得的能源 各种石油制品、煤气、蒸气、电力、氢能、沼气
按性质分 可再生能源 可持续利用的一次能源 风能、水能、生物质能、太阳能、潮汐能、沼气等
不可再生能源 经过亿万年形成的短期内无法恢复的能源 石油、煤、天然气等化石燃料、核能等
按利用历史分 常规能源 在一定历史时期,已被人们广泛利用的能源 煤、石油、天然气等
新能源 随着科技的不断发展,才开始被人类采用的能源 地热能、氢能、核能、风能、太阳能、海洋能和生物质能等
能源分类:
火力发电
水力发电
风力发电
太阳能发电
核能发电
电池供电
同学们能想象一下没有电之后的生活会是什么样的吗?
第一节 化学反应与能量变化
第二课时
化学反应与电能(原电池原理)
第六章 化学反应与能量
【学习目标与核心素养】
学习目标
1、初步了解火力发电过程中的能量转化
2、通过实验探究,掌握构成原电池的条件及原电池的原理
3、了解化学电源在实际生活中的应用及废旧电池的处理和利用
核心素养
1、 科学探究与创新意识:认识构成原电池的条件及其原理,判断原电池的正负极,利用原电池原理能设计原电池。
2、宏观辨识与微观探析:会分析物质化学变化中的能量变化与物质微观结构的关系。
我国目前电能主要来自火力发电,其次是水力发电。
问:火电厂是如何产生电能的?
发电原理又是什么?
火电站的工作原理
火力发电--化学能间接转化为电能
化学能(煤)
燃烧
蒸汽轮机
机械能
发电机
电能
热能
火力发电存在的问题
①煤炭是非可再生资源,会造成能源危机
②煤炭燃烧会产生污染性气体
③经多次转换,能量损耗大,燃料的利用率低
火力发电存在几种形式的能量转化
火力发电
将化学能经一系列能量转化为电能
过程
燃烧
关键
氧化还原反应
本质
氧化剂与还原剂之间发生电子的转移
本质
旧键断裂和新键形成、体系能量变化
引起
化学反应的能量能不能直接转变为电能呢?
化学能直接转化为电能需要满足什么条件?
(1)物质间的反应必须是氧化还原反应;
(2)反应能够自发进行(反应条件与限度)。
【实验6-3】
(1) 将锌片和铜片插入盛有稀硫酸的烧
杯中,观察现象。
(2) 用导线连接锌片和铜片,观察、比
较导线连接前后的现象。
(3) 如图6-6所示,用导线在锌片和铜片
之间串联一个电流表,
观察电流表的指针是否偏转。
探究把化学能直接转变为电能的装置
实 验 现 象
铜片插入稀硫酸
锌片插入稀硫酸
锌片和铜片上 端连接在一起 插入稀硫酸 铜片
锌片
电流表
铜片上无气泡
锌片上有气泡
铜片上有气泡
Zn+H2SO4=ZnSO4+H2↑
锌片逐渐溶解无气泡
电流表的指针偏转
(1)将铜片和锌片分别插入稀硫酸溶液中,观察现象并解释原因。(注意两块金属片不要相接触)
问题:
(2)将铜片和锌片用导线连接插入稀硫酸溶液中,观察现象并解释原因。
稀H2SO4
Zn
Cu
【探究】 该装置是如何将化学能转化为电能的?
锌片:
铜片:
Zn - 2e- = Zn2+
2H+ + 2e- = H2 ↑
导线:
连接锌片与铜片,保证电子流动
溶液:
提供离子,保证离子移动,形成回路
总反应:
Zn + 2H+ =Zn2+ + H2 ↑
电子流向:
锌片→导线→铜片
电流流向:
铜片→导线→锌片→溶液→铜片(循环)
H2SO4溶液
e-
e-
e-
Ⅰ
一、原电池
1、概念:将化学能直接转变为电能的装置
本质:氧化反应和还原反应分别在两
个不同的区域进行。
负极:Zn - 2e- = Zn2+(氧化反应)
正极:2H+ + 2e- = H2 ↑(还原反应)
电池总反应:Zn + 2H+ == Zn2+ + H2↑
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
负极:
正极:
电子流出(或电流流进)的一极
电子流入(或电流流出)的一极
能量转化: 能转变为 能。
化学
电
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
负极
正极
阳离子
阴离子
SO42-
发生溶解
产生气泡
原电池总反应:Zn+2H+=Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
3、电子、离子的移动方向
外电路:
内电路:
外电路
内电路
2、工作原理
负氧正还
【阳正,阴负】
阳离子向正极移动;阴离子向负极移动
注意电子不下水 离子不上岸
原电池
电子流出
电子流入
外电路:电子定向移动
内电路:阴阳离子定向移动
注意:电子不下水,离子不上岸
负氧正还
【阳正,阴负】
条件1:活泼性不同的两个电极
条件2:电极需插进电解质溶液中
c
c
NaCl溶液
酒 精
负极:较活泼的金属
正极:较不活泼的金属或非金属导体 (石墨)等
↑
探究实验:构成原电池的条件
条件3:必须形成闭合回路
条件4:必须存在自发的氧化还原反应
(2)要有电解质溶液或熔融的电解质
①电解质溶液一般要能够与负极发生反应
②电解质溶液中溶解的其他物质能与负极发生反应(如:O2)
(3)形成闭合回路
①导线相连
②电极直接接触
(4)氧化还原反应
氧化还原反应是自发进行的,但自发进行的氧化还原反应不一定都能设计成原电池
4、原电池构成条件:
两极一液一连线,氧化还原是条件
(1)两个能导电的电极——正极和负极:
①一般是活泼性不同的两种金属(或金属和非金属)
②惰性电极:Pt、C
A.①②⑤⑥ B.④⑥⑦⑧⑨ C.②⑤⑥⑦ D.④⑥⑦⑨
如果能形成原电池,请找出负极是哪一极?
例1.哪些能形成原电池( )
D
√
√
√
√
能否构成原电池的判断——四看
(1)看电极:两极为导体且存在活泼性差异
(燃料电池的电极一般为惰性电极)
(2)看溶液:两极插入电解质溶液中
(3)看回路:形成闭合回路或两极直接接触
(4)看本质:有无自发的氧化还原反应发生
5.判断原电池正负极方法(重要)
判断依据 正极 负极
电极材料
电子流向
电极反应
电极现象
溶液中离子流向
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
电极减轻
阳离子流向正极
阴离子流向负极
电流流向
电流流出
电流流入
【思考】
请判断以下能否形成原电池,如果能形成,负极是哪一极?
稀硫酸
Al
Mg
A
氢氧化钠
Al
Mg
A
稀硝酸
Fe
Cu
A
浓硝酸
Fe
Cu
A
稀硫酸
硫酸铜
Zn
Fe
设计原电池,以Fe+CuSO4=FeSO4+Cu进行设计,画出原电池示意图,标出正负极和电子移动方向,并写出该电池的正负极电极反应式。
【课堂探究】
负极
正极
负极反应:Fe-2e- = Fe2+
故只能用铁做负极
正极反应:Cu2++2e- =Cu,
故正极材料只需要活泼性比铁弱即可,如:铜、银、石墨等
电解质溶液:必修含有Cu2+,为可溶性铜盐如:CuSO4溶液
1、设计化学电源
设计原电池的基本思路
还原剂 + 氧化剂=氧化产物+还原产物
氧化还原反应
氧化反应
还原反应
分开进行
形成
闭合回路
(失电子)
(得电子)
原电池
负极反应物
负极材料
正极反应物
正极材料
Fe+CuSO4=FeSO4+Cu
Fe
负极
正极
?
二、原电池的应用
原理:理论上任何自发的氧化还原反应都可以设计成原电池
设计思路
(1)定反应:确定一个能够自发进行的氧化还原反应。
(2)拆两半:将氧化还原反应拆分为氧化反应和还原反应两个半反应,
分别作为负极和正极的电极反应
还原剂-ne-===氧化产物(负极电极反应);
氧化剂+ne-===还原产物(正极电极反应)。
(3)找材料:电极材料必须导电,负极材料一般选择较活泼的金属材料,
或者在该氧化还原反应中,本身失去电子的材料;
电解质溶液一般能与负极反应。
(4)画装置:连接电路形成闭合回路,画出原电池示意图。
请根据下列离子反应,各设计一个原电池。画出原电池的构造示意图,并写出电极反应式。
Fe+2H+=Fe2++H2↑
挑战自我
Cu+2Fe3+=Cu2++2Fe2+
一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是
看谁做得既准又快
实验室制取氢气时,常在稀硫酸中加入少量的硫酸铜溶液,其目的是什么?
思考
H+
H+
提示:装置乙产生H2的反应速率快。
装置甲中,氧化反应和还原反应都在Zn表面进行,生成的Zn2+排斥H+,使H+越来越难靠近Zn表面得电子。
装置乙构成了原电池,氧化反应和还原反应分别在两个不同区域进行,Zn失去的电子沿导线聚集在Cu棒上,溶液中H+非常容易靠近Cu表面得电子生成H2,因此反应速率加快。
2、加快化学反应速率
在锌与稀H2SO4反应制取氢气时加入少量CuSO4溶液,CuSO4与锌发生置换反应
生成Cu,从而形成Cu-Zn微小原电池,加快产生H2的速率
练习:过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是( )
A.加入适量NaCl溶液 B.加入适量的水
C.加入几滴硫酸铜溶液 D.再加入少量稀硫酸
C
练习:把A、B、C、D四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此四种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
②
A>B
C>D
A>C
D>B
一般来说,作负极的金属的活动性强于正极金属
3、判断金属活动性强弱比较
C
如在船底表面镶嵌锌块,以减少船体被海水腐蚀。
牺牲阳极的阴极保护法
原理:
作原电池正极的金属材料不参与反应
方法:将被保护金属作为原电池的正极而受到保护,
另外一种金属作负极被腐蚀
4、用于金属保护
练习:如图下列各烧杯中都盛有海水,铁在其中腐蚀由快到慢的顺序是( )
Fe
A
B
Sn
Fe
C
Zn
Fe
D
Cu
Fe
A. B >A >C > D
B. D > C > A > B
C. D > B > A > C
D. C > B > D > A
间接:
直接:
化学能
燃烧
热 能
蒸汽
机械能
发动机
电能
装置
原电池
概
念
构成条件
工作原理
化
学
能
与
电
能
【总结】
应用
能源的多样性
水能
风能
石油
天然气
蒸汽
电能
原煤
同学们你知道有那些能源吗?
标准 分类 定义 举例
按转换过程分 一次能源 从自然界直接取得的自然资源 煤、石油、天然气等化石燃料,水能、风能、生物质能、太阳能等
二次能源 一次能源经过加工转换后获得的能源 各种石油制品、煤气、蒸气、电力、氢能、沼气
按性质分 可再生能源 可持续利用的一次能源 风能、水能、生物质能、太阳能、潮汐能、沼气等
不可再生能源 经过亿万年形成的短期内无法恢复的能源 石油、煤、天然气等化石燃料、核能等
按利用历史分 常规能源 在一定历史时期,已被人们广泛利用的能源 煤、石油、天然气等
新能源 随着科技的不断发展,才开始被人类采用的能源 地热能、氢能、核能、风能、太阳能、海洋能和生物质能等
能源分类:
火力发电
水力发电
风力发电
太阳能发电
核能发电
电池供电
同学们能想象一下没有电之后的生活会是什么样的吗?
第一节 化学反应与能量变化
第二课时
化学反应与电能(原电池原理)
第六章 化学反应与能量
【学习目标与核心素养】
学习目标
1、初步了解火力发电过程中的能量转化
2、通过实验探究,掌握构成原电池的条件及原电池的原理
3、了解化学电源在实际生活中的应用及废旧电池的处理和利用
核心素养
1、 科学探究与创新意识:认识构成原电池的条件及其原理,判断原电池的正负极,利用原电池原理能设计原电池。
2、宏观辨识与微观探析:会分析物质化学变化中的能量变化与物质微观结构的关系。
我国目前电能主要来自火力发电,其次是水力发电。
问:火电厂是如何产生电能的?
发电原理又是什么?
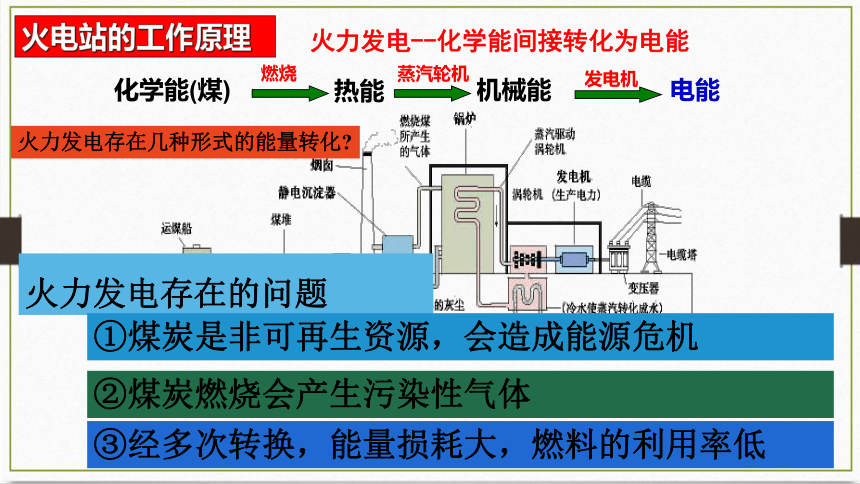
火电站的工作原理
火力发电--化学能间接转化为电能
化学能(煤)
燃烧
蒸汽轮机
机械能
发电机
电能
热能
火力发电存在的问题
①煤炭是非可再生资源,会造成能源危机
②煤炭燃烧会产生污染性气体
③经多次转换,能量损耗大,燃料的利用率低
火力发电存在几种形式的能量转化
火力发电
将化学能经一系列能量转化为电能
过程
燃烧
关键
氧化还原反应
本质
氧化剂与还原剂之间发生电子的转移
本质
旧键断裂和新键形成、体系能量变化
引起
化学反应的能量能不能直接转变为电能呢?
化学能直接转化为电能需要满足什么条件?
(1)物质间的反应必须是氧化还原反应;
(2)反应能够自发进行(反应条件与限度)。
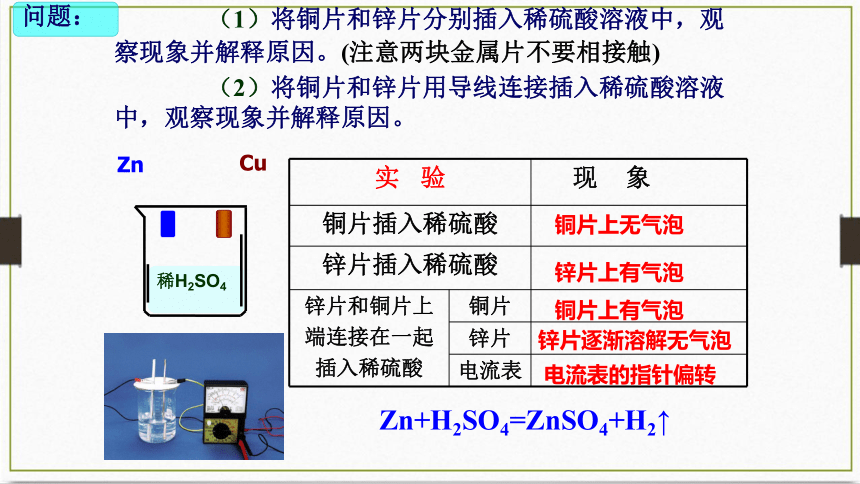
【实验6-3】
(1) 将锌片和铜片插入盛有稀硫酸的烧
杯中,观察现象。
(2) 用导线连接锌片和铜片,观察、比
较导线连接前后的现象。
(3) 如图6-6所示,用导线在锌片和铜片
之间串联一个电流表,
观察电流表的指针是否偏转。
探究把化学能直接转变为电能的装置
实 验 现 象
铜片插入稀硫酸
锌片插入稀硫酸
锌片和铜片上 端连接在一起 插入稀硫酸 铜片
锌片
电流表
铜片上无气泡
锌片上有气泡
铜片上有气泡
Zn+H2SO4=ZnSO4+H2↑
锌片逐渐溶解无气泡
电流表的指针偏转
(1)将铜片和锌片分别插入稀硫酸溶液中,观察现象并解释原因。(注意两块金属片不要相接触)
问题:
(2)将铜片和锌片用导线连接插入稀硫酸溶液中,观察现象并解释原因。
稀H2SO4
Zn
Cu
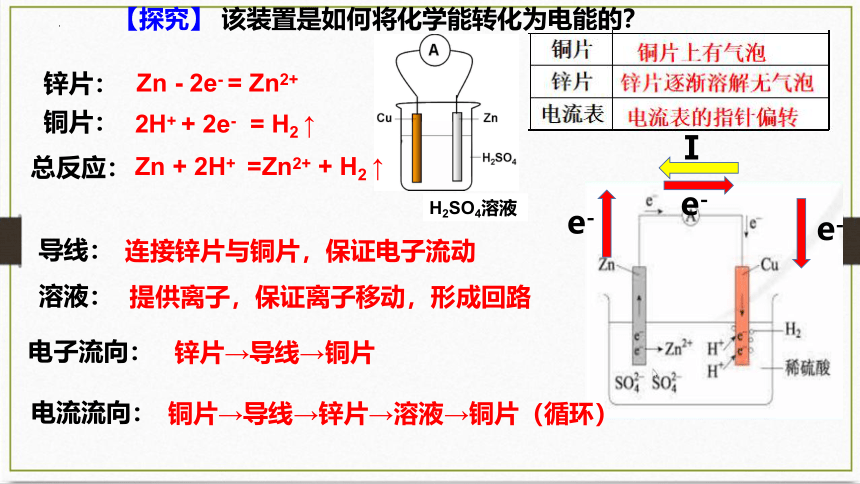
【探究】 该装置是如何将化学能转化为电能的?
锌片:
铜片:
Zn - 2e- = Zn2+
2H+ + 2e- = H2 ↑
导线:
连接锌片与铜片,保证电子流动
溶液:
提供离子,保证离子移动,形成回路
总反应:
Zn + 2H+ =Zn2+ + H2 ↑
电子流向:
锌片→导线→铜片
电流流向:
铜片→导线→锌片→溶液→铜片(循环)
H2SO4溶液
e-
e-
e-
Ⅰ
一、原电池
1、概念:将化学能直接转变为电能的装置
本质:氧化反应和还原反应分别在两
个不同的区域进行。
负极:Zn - 2e- = Zn2+(氧化反应)
正极:2H+ + 2e- = H2 ↑(还原反应)
电池总反应:Zn + 2H+ == Zn2+ + H2↑
A
Zn
Cu
SO42-
H+
H+
正极
负极
e-
负极:
正极:
电子流出(或电流流进)的一极
电子流入(或电流流出)的一极
能量转化: 能转变为 能。
化学
电
Cu
Zn
-
-
-
Zn2+
H+
H+
Zn-2e-=Zn2+
2H++2e-=H2↑
氧化反应
还原反应
负极
正极
阳离子
阴离子
SO42-
发生溶解
产生气泡
原电池总反应:Zn+2H+=Zn2++H2↑
电子流向:负极 沿导线 正极
电流方向:正极 沿导线 负极
3、电子、离子的移动方向
外电路:
内电路:
外电路
内电路
2、工作原理
负氧正还
【阳正,阴负】
阳离子向正极移动;阴离子向负极移动
注意电子不下水 离子不上岸
原电池
电子流出
电子流入
外电路:电子定向移动
内电路:阴阳离子定向移动
注意:电子不下水,离子不上岸
负氧正还
【阳正,阴负】
条件1:活泼性不同的两个电极
条件2:电极需插进电解质溶液中
c
c
NaCl溶液
酒 精
负极:较活泼的金属
正极:较不活泼的金属或非金属导体 (石墨)等
↑
探究实验:构成原电池的条件
条件3:必须形成闭合回路
条件4:必须存在自发的氧化还原反应
(2)要有电解质溶液或熔融的电解质
①电解质溶液一般要能够与负极发生反应
②电解质溶液中溶解的其他物质能与负极发生反应(如:O2)
(3)形成闭合回路
①导线相连
②电极直接接触
(4)氧化还原反应
氧化还原反应是自发进行的,但自发进行的氧化还原反应不一定都能设计成原电池
4、原电池构成条件:
两极一液一连线,氧化还原是条件
(1)两个能导电的电极——正极和负极:
①一般是活泼性不同的两种金属(或金属和非金属)
②惰性电极:Pt、C
A.①②⑤⑥ B.④⑥⑦⑧⑨ C.②⑤⑥⑦ D.④⑥⑦⑨
如果能形成原电池,请找出负极是哪一极?
例1.哪些能形成原电池( )
D
√
√
√
√
能否构成原电池的判断——四看
(1)看电极:两极为导体且存在活泼性差异
(燃料电池的电极一般为惰性电极)
(2)看溶液:两极插入电解质溶液中
(3)看回路:形成闭合回路或两极直接接触
(4)看本质:有无自发的氧化还原反应发生
5.判断原电池正负极方法(重要)
判断依据 正极 负极
电极材料
电子流向
电极反应
电极现象
溶液中离子流向
不活泼金属或非金属导体
活泼金属
电子流入
电子流出
还原反应
氧化反应
电极增重或产生气体
电极减轻
阳离子流向正极
阴离子流向负极
电流流向
电流流出
电流流入
【思考】
请判断以下能否形成原电池,如果能形成,负极是哪一极?
稀硫酸
Al
Mg
A
氢氧化钠
Al
Mg
A
稀硝酸
Fe
Cu
A
浓硝酸
Fe
Cu
A
稀硫酸
硫酸铜
Zn
Fe
设计原电池,以Fe+CuSO4=FeSO4+Cu进行设计,画出原电池示意图,标出正负极和电子移动方向,并写出该电池的正负极电极反应式。
【课堂探究】
负极
正极
负极反应:Fe-2e- = Fe2+
故只能用铁做负极
正极反应:Cu2++2e- =Cu,
故正极材料只需要活泼性比铁弱即可,如:铜、银、石墨等
电解质溶液:必修含有Cu2+,为可溶性铜盐如:CuSO4溶液
1、设计化学电源
设计原电池的基本思路
还原剂 + 氧化剂=氧化产物+还原产物
氧化还原反应
氧化反应
还原反应
分开进行
形成
闭合回路
(失电子)
(得电子)
原电池
负极反应物
负极材料
正极反应物
正极材料
Fe+CuSO4=FeSO4+Cu
Fe
负极
正极
?
二、原电池的应用
原理:理论上任何自发的氧化还原反应都可以设计成原电池
设计思路
(1)定反应:确定一个能够自发进行的氧化还原反应。
(2)拆两半:将氧化还原反应拆分为氧化反应和还原反应两个半反应,
分别作为负极和正极的电极反应
还原剂-ne-===氧化产物(负极电极反应);
氧化剂+ne-===还原产物(正极电极反应)。
(3)找材料:电极材料必须导电,负极材料一般选择较活泼的金属材料,
或者在该氧化还原反应中,本身失去电子的材料;
电解质溶液一般能与负极反应。
(4)画装置:连接电路形成闭合回路,画出原电池示意图。
请根据下列离子反应,各设计一个原电池。画出原电池的构造示意图,并写出电极反应式。
Fe+2H+=Fe2++H2↑
挑战自我
Cu+2Fe3+=Cu2++2Fe2+
一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是
看谁做得既准又快
实验室制取氢气时,常在稀硫酸中加入少量的硫酸铜溶液,其目的是什么?
思考
H+
H+
提示:装置乙产生H2的反应速率快。
装置甲中,氧化反应和还原反应都在Zn表面进行,生成的Zn2+排斥H+,使H+越来越难靠近Zn表面得电子。
装置乙构成了原电池,氧化反应和还原反应分别在两个不同区域进行,Zn失去的电子沿导线聚集在Cu棒上,溶液中H+非常容易靠近Cu表面得电子生成H2,因此反应速率加快。
2、加快化学反应速率
在锌与稀H2SO4反应制取氢气时加入少量CuSO4溶液,CuSO4与锌发生置换反应
生成Cu,从而形成Cu-Zn微小原电池,加快产生H2的速率
练习:过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是( )
A.加入适量NaCl溶液 B.加入适量的水
C.加入几滴硫酸铜溶液 D.再加入少量稀硫酸
C
练习:把A、B、C、D四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此四种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
②
A>B
C>D
A>C
D>B
一般来说,作负极的金属的活动性强于正极金属
3、判断金属活动性强弱比较
C
如在船底表面镶嵌锌块,以减少船体被海水腐蚀。
牺牲阳极的阴极保护法
原理:
作原电池正极的金属材料不参与反应
方法:将被保护金属作为原电池的正极而受到保护,
另外一种金属作负极被腐蚀
4、用于金属保护
练习:如图下列各烧杯中都盛有海水,铁在其中腐蚀由快到慢的顺序是( )
Fe
A
B
Sn
Fe
C
Zn
Fe
D
Cu
Fe
A. B >A >C > D
B. D > C > A > B
C. D > B > A > C
D. C > B > D > A
间接:
直接:
化学能
燃烧
热 能
蒸汽
机械能
发动机
电能
装置
原电池
概
念
构成条件
工作原理
化
学
能
与
电
能
【总结】
应用
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
