第6章常用的金属和盐 期中复习 2021-2022学年九年级化学沪教版(上海)第二学期(含答案)
文档属性
| 名称 | 第6章常用的金属和盐 期中复习 2021-2022学年九年级化学沪教版(上海)第二学期(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 103.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-03 00:00:00 | ||
图片预览


文档简介
第6章常用的金属和盐
一、单选题
1.硝酸铵是一种氮肥,易溶于水,受热易分解,遇碱时放出氨气,在高温或受猛烈撞击时易爆炸,下列使用硝酸铵的做法不正确的是
A.储存和运输时密封防潮
B.结块时用铁锤砸碎再用
C.施用时不宜与碱混和使用
D.给农作物施肥后及时盖土
2.下列实验中有化学反应发生,且能观察到明显现象的是
A.向氯化钾溶液中滴入稀硫酸
B.向硫酸钠溶液中滴入氯化锌溶液
C.向氧化铜粉末中滴入氢氧化钠溶液
D.高温下向氧化铁粉末中通入一氧化碳
3.2018年5月我国自主建造的第一艘航母下海,为保证航母的使用寿命,下列防锈措施不可行的是
A.用抗锈蚀性能优异的合金制造航母零部件 B.刷防锈漆
C.船体表面镀一层黄金 D.给某些部位涂油
4.下列有关化肥或农药的叙述错误的是( )
A.硫酸铵属于复合肥料,所含的营养元素是氮和硫
B.氯化铵和磷矿粉从外观即可区分
C.农药施用后,会通过农作物、农产品等发生转移
D.化肥和农药施用不当,会对环境造成污染
5.现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
6.下列防锈措施合理的是
A.经常用水冲洗自行车链条 B.在铁制暖气片上刷“银粉”
C.用“钢丝球”打磨铝锅表面 D.用过的菜刀及时用盐水清洗
7.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
8.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
9.下列物质的用途中,利用其物理性质的是( )
A.铜用于制作导线 B.一氧化碳用于炼铁 C.天然气用作燃料 D.氧气用于气焊
10.工业上用来测定空气中某污染物含量的化学方程式为:,下列判断正确的是
A.反应中溴元素(Br)的化合价降低了 B.反应中硫元素的化合价降低了
C.X的化学式为SO3 D.反应属于置换反应
二、简答题
11.化学与文学有着不解之缘,很多成语中都蕴含着化学知识,请回答下列问题:
(1)“真金不怕火炼”说明金具有的性质是_____。
(2)“釜底抽薪”说明灭火的原理之一是_____。
12.下面是某校学生进行“金属的物理性质和化学性质”的实验活动:
(1)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则黄铜的硬度_____(填“>””<”或“=”)纯铜的硬度。
(2)同学收集到的金属制品有硬币、铝质导线、铜质火锅、小刀等,其中利用金属导热性的是_____。
(3)实验A中可观察到的现象为_____;实验B中,_____与酸反应最快。
(4)实验C中,小云同学选择一种金属丝放入两种不同溶液中,则所用的金属是_____;其中发生反应的化学方程式为_____,发生反应后该金属丝的质量_____(填“变大”“减小”或“不变”)
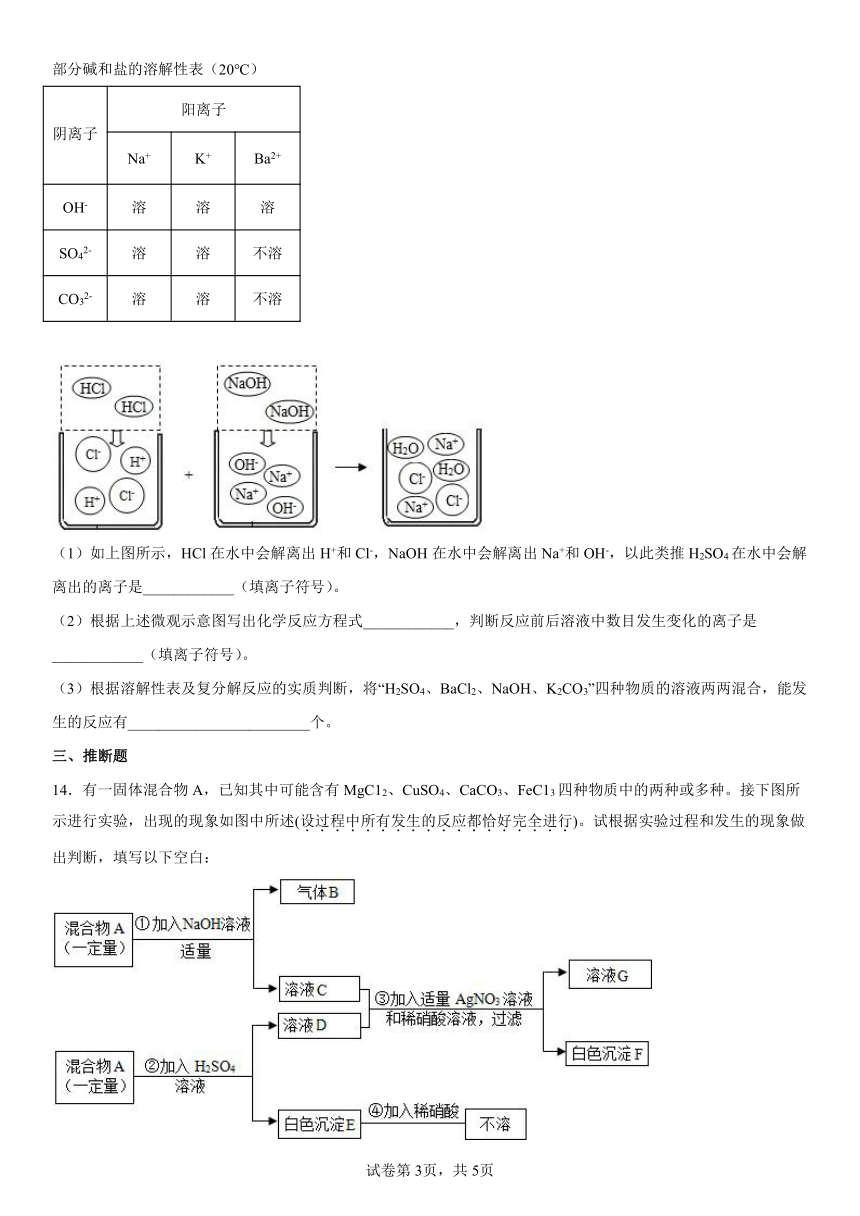
13.可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据如下所列溶解性表及氢氧化钠溶液和盐酸反应的微观示意图回答问题。
部分碱和盐的溶解性表(20℃)
阴离子 阳离子
Na+ K+ Ba2+
OH- 溶 溶 溶
SO42- 溶 溶 不溶
CO32- 溶 溶 不溶
(1)如上图所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是____________(填离子符号)。
(2)根据上述微观示意图写出化学反应方程式____________,判断反应前后溶液中数目发生变化的离子是____________(填离子符号)。
(3)根据溶解性表及复分解反应的实质判断,将“H2SO4、BaCl2、NaOH、K2CO3”四种物质的溶液两两混合,能发生的反应有________________________个。
三、推断题
14.有一固体混合物A,已知其中可能含有MgC12、CuSO4、CaCO3、FeC13四种物质中的两种或多种。接下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为___________。
(2)在混合物A里,上述四种物质中肯定不存在的是___________。
(3)在溶液F中,一定大量存在的酸根离子是___________。(写离子符号)
(4)写出1个生成白色沉淀G的化学方程式:___________。
(5)溶液F的溶质有 ___________ 。(写化学式)
15.A、B、C、D、E为初中是常见的五种物质,A是赤铁矿的主要成分,B、C为组成元素相同的气体,F是紫红色固体单质,G的溶液为浅绿色,物质之间的转化关系如图所示。
请回答:
(1)D的化学式为 _____ ;G的名称为 _______ ;
(2)反应①的化学方程式为 ________ ;
(3)反应③的化学方程式为 _______ ,该反应的基本反应类型是 _______ ;
(4)写出物质C在生活的一种用途 ______ .
四、实验题
16.某实验小组为了探究影响金属与酸反应快慢的因素,进行了下列活动。
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
根据以上三个实验现象可得出的结论是:____________;_____________;____________。
17.为了探究相关金属的活动性,设计了如下图所示的实验。
(1)实验①的目的是_____。
(2)实验②中发生反应的反应方程式为_____。
(3)该探究得到的实验结论是_____。
18.化学小组同学用如图所示装置探究铁的金属活动性。
(1)若要证明Fe在金属活动性顺序中位于氢前,X溶液可选用_____,其现象为_____,其化学方程式为:_____,其基本反应类型是_____反应。
(2)若X溶液为少量硫酸铜溶液,该反应的化学方程式为_____。待充分反应后,取出铁片,放入金属R,观察到R表面有黑色固体析出。根据上述实验现象,得出Fe、Cu、R的金属活动性顺序为_____。
五、计算题
19.将8g含杂质的粗锌,加入到盛有100g稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),恰好完全反应,称得烧杯内物质的总质量为107.8g。试计算:
(1)生成氢气的质量为______g。
(2)所用粗锌中锌的质量是多少?所用稀硫酸中溶质的质量分数是多少?
20.金属锰大量用于制造锰钢。地壳中含锰的矿石有软锰矿,软锰矿的主要成分是二氧化锰。金属锰可用软锰矿跟铝反应来制取,其反应为3MnO2+4Al2Al2O3+3Mn。
(1)用100t含MnO278.3%的软锰矿石,可冶炼出多少t锰(准确至0.1t,下同)。
(2)实际冶炼出的锰是含有5%杂质的粗锰,则实际得到多少t粗锰。
21.实验室常用锌粒和稀硫酸反应制取氢气,若用6.5g锌和稀盐酸反应,则:
(1)可制取_____质量的氢气?
(2)理论上需要_____溶质质量分数为9.8%的稀硫酸?
(3)求恰好完全反应时所得溶液的溶质质量分数_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.C
4.A
5.C
6.B
7.B
8.C
9.A
10.A
11.(1)高温下,金的化学性质不活泼
(2)清除可燃物
12. (1)> 铜质火锅 (2)发出耀眼的白光,放出大量的热,生成白色粉末状物质 (3)镁 铜 2AgNO3+Cu=Cu(NO3)2+2Ag 变大
13.(1) H+、SO42- (2)HCl+NaOH═NaCl+H2O (3)H+、OH- 4
14. (1) CO2 CuSO4、FeCl3 (2) NaCl+AgNO3=AgCl↓+NaNO3 (3)Ca(NO3)2 、NaNO3
15. (1) Fe 硫酸亚铁 (2) 置换反应 (3)光合作用、灭火等
16. (1) 金属活动性,活动性越强,反应速率越快 (2)金属与酸的接触面,接触面越大,反应越快 (3)酸的浓度,酸的浓度越大,反应越快
17. (1) 比较Cu与Ag的活动性强弱 (2)Fe+2HCl=FeCl2+H2↑ (3)活动性排列:Fe>Cu>Ag
18.(1) 稀硫酸或稀盐酸 (2)有气泡产生,溶液逐渐变为浅绿色 置换 (3) R>Fe>Cu(或Cu<Fe<R)
19.(1)0.2
(2)解:设粗锌中锌的质量为 x;所用稀硫酸中溶质的质量为y
答:所用粗锌中锌的质量是6.5g;所用稀硫酸中溶质的质量分数是9.8%。
20.(1)49.5t;(2)52.1t
21.(1)生成氢气质量为0.2g。
(2)需要溶质质量分数为9.8%的稀硫酸的质量为100g。
(3)恰好完全反应时所得溶液的溶质质量分数15.1%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.硝酸铵是一种氮肥,易溶于水,受热易分解,遇碱时放出氨气,在高温或受猛烈撞击时易爆炸,下列使用硝酸铵的做法不正确的是
A.储存和运输时密封防潮
B.结块时用铁锤砸碎再用
C.施用时不宜与碱混和使用
D.给农作物施肥后及时盖土
2.下列实验中有化学反应发生,且能观察到明显现象的是
A.向氯化钾溶液中滴入稀硫酸
B.向硫酸钠溶液中滴入氯化锌溶液
C.向氧化铜粉末中滴入氢氧化钠溶液
D.高温下向氧化铁粉末中通入一氧化碳
3.2018年5月我国自主建造的第一艘航母下海,为保证航母的使用寿命,下列防锈措施不可行的是
A.用抗锈蚀性能优异的合金制造航母零部件 B.刷防锈漆
C.船体表面镀一层黄金 D.给某些部位涂油
4.下列有关化肥或农药的叙述错误的是( )
A.硫酸铵属于复合肥料,所含的营养元素是氮和硫
B.氯化铵和磷矿粉从外观即可区分
C.农药施用后,会通过农作物、农产品等发生转移
D.化肥和农药施用不当,会对环境造成污染
5.现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
6.下列防锈措施合理的是
A.经常用水冲洗自行车链条 B.在铁制暖气片上刷“银粉”
C.用“钢丝球”打磨铝锅表面 D.用过的菜刀及时用盐水清洗
7.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
8.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
9.下列物质的用途中,利用其物理性质的是( )
A.铜用于制作导线 B.一氧化碳用于炼铁 C.天然气用作燃料 D.氧气用于气焊
10.工业上用来测定空气中某污染物含量的化学方程式为:,下列判断正确的是
A.反应中溴元素(Br)的化合价降低了 B.反应中硫元素的化合价降低了
C.X的化学式为SO3 D.反应属于置换反应
二、简答题
11.化学与文学有着不解之缘,很多成语中都蕴含着化学知识,请回答下列问题:
(1)“真金不怕火炼”说明金具有的性质是_____。
(2)“釜底抽薪”说明灭火的原理之一是_____。
12.下面是某校学生进行“金属的物理性质和化学性质”的实验活动:
(1)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则黄铜的硬度_____(填“>””<”或“=”)纯铜的硬度。
(2)同学收集到的金属制品有硬币、铝质导线、铜质火锅、小刀等,其中利用金属导热性的是_____。
(3)实验A中可观察到的现象为_____;实验B中,_____与酸反应最快。
(4)实验C中,小云同学选择一种金属丝放入两种不同溶液中,则所用的金属是_____;其中发生反应的化学方程式为_____,发生反应后该金属丝的质量_____(填“变大”“减小”或“不变”)
13.可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据如下所列溶解性表及氢氧化钠溶液和盐酸反应的微观示意图回答问题。
部分碱和盐的溶解性表(20℃)
阴离子 阳离子
Na+ K+ Ba2+
OH- 溶 溶 溶
SO42- 溶 溶 不溶
CO32- 溶 溶 不溶
(1)如上图所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是____________(填离子符号)。
(2)根据上述微观示意图写出化学反应方程式____________,判断反应前后溶液中数目发生变化的离子是____________(填离子符号)。
(3)根据溶解性表及复分解反应的实质判断,将“H2SO4、BaCl2、NaOH、K2CO3”四种物质的溶液两两混合,能发生的反应有________________________个。
三、推断题
14.有一固体混合物A,已知其中可能含有MgC12、CuSO4、CaCO3、FeC13四种物质中的两种或多种。接下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行)。试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体B的化学式为___________。
(2)在混合物A里,上述四种物质中肯定不存在的是___________。
(3)在溶液F中,一定大量存在的酸根离子是___________。(写离子符号)
(4)写出1个生成白色沉淀G的化学方程式:___________。
(5)溶液F的溶质有 ___________ 。(写化学式)
15.A、B、C、D、E为初中是常见的五种物质,A是赤铁矿的主要成分,B、C为组成元素相同的气体,F是紫红色固体单质,G的溶液为浅绿色,物质之间的转化关系如图所示。
请回答:
(1)D的化学式为 _____ ;G的名称为 _______ ;
(2)反应①的化学方程式为 ________ ;
(3)反应③的化学方程式为 _______ ,该反应的基本反应类型是 _______ ;
(4)写出物质C在生活的一种用途 ______ .
四、实验题
16.某实验小组为了探究影响金属与酸反应快慢的因素,进行了下列活动。
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
根据以上三个实验现象可得出的结论是:____________;_____________;____________。
17.为了探究相关金属的活动性,设计了如下图所示的实验。
(1)实验①的目的是_____。
(2)实验②中发生反应的反应方程式为_____。
(3)该探究得到的实验结论是_____。
18.化学小组同学用如图所示装置探究铁的金属活动性。
(1)若要证明Fe在金属活动性顺序中位于氢前,X溶液可选用_____,其现象为_____,其化学方程式为:_____,其基本反应类型是_____反应。
(2)若X溶液为少量硫酸铜溶液,该反应的化学方程式为_____。待充分反应后,取出铁片,放入金属R,观察到R表面有黑色固体析出。根据上述实验现象,得出Fe、Cu、R的金属活动性顺序为_____。
五、计算题
19.将8g含杂质的粗锌,加入到盛有100g稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),恰好完全反应,称得烧杯内物质的总质量为107.8g。试计算:
(1)生成氢气的质量为______g。
(2)所用粗锌中锌的质量是多少?所用稀硫酸中溶质的质量分数是多少?
20.金属锰大量用于制造锰钢。地壳中含锰的矿石有软锰矿,软锰矿的主要成分是二氧化锰。金属锰可用软锰矿跟铝反应来制取,其反应为3MnO2+4Al2Al2O3+3Mn。
(1)用100t含MnO278.3%的软锰矿石,可冶炼出多少t锰(准确至0.1t,下同)。
(2)实际冶炼出的锰是含有5%杂质的粗锰,则实际得到多少t粗锰。
21.实验室常用锌粒和稀硫酸反应制取氢气,若用6.5g锌和稀盐酸反应,则:
(1)可制取_____质量的氢气?
(2)理论上需要_____溶质质量分数为9.8%的稀硫酸?
(3)求恰好完全反应时所得溶液的溶质质量分数_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.C
4.A
5.C
6.B
7.B
8.C
9.A
10.A
11.(1)高温下,金的化学性质不活泼
(2)清除可燃物
12. (1)> 铜质火锅 (2)发出耀眼的白光,放出大量的热,生成白色粉末状物质 (3)镁 铜 2AgNO3+Cu=Cu(NO3)2+2Ag 变大
13.(1) H+、SO42- (2)HCl+NaOH═NaCl+H2O (3)H+、OH- 4
14. (1) CO2 CuSO4、FeCl3 (2) NaCl+AgNO3=AgCl↓+NaNO3 (3)Ca(NO3)2 、NaNO3
15. (1) Fe 硫酸亚铁 (2) 置换反应 (3)光合作用、灭火等
16. (1) 金属活动性,活动性越强,反应速率越快 (2)金属与酸的接触面,接触面越大,反应越快 (3)酸的浓度,酸的浓度越大,反应越快
17. (1) 比较Cu与Ag的活动性强弱 (2)Fe+2HCl=FeCl2+H2↑ (3)活动性排列:Fe>Cu>Ag
18.(1) 稀硫酸或稀盐酸 (2)有气泡产生,溶液逐渐变为浅绿色 置换 (3) R>Fe>Cu(或Cu<Fe<R)
19.(1)0.2
(2)解:设粗锌中锌的质量为 x;所用稀硫酸中溶质的质量为y
答:所用粗锌中锌的质量是6.5g;所用稀硫酸中溶质的质量分数是9.8%。
20.(1)49.5t;(2)52.1t
21.(1)生成氢气质量为0.2g。
(2)需要溶质质量分数为9.8%的稀硫酸的质量为100g。
(3)恰好完全反应时所得溶液的溶质质量分数15.1%。
答案第1页,共2页
答案第1页,共2页
