人教版选择性必修一1.1.1 反应热 焓变 课件(33张PPT)
文档属性
| 名称 | 人教版选择性必修一1.1.1 反应热 焓变 课件(33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 00:00:00 | ||
图片预览




文档简介
(共33张PPT)
第1节 反应热
第1课时:反应热 焓变
第一章
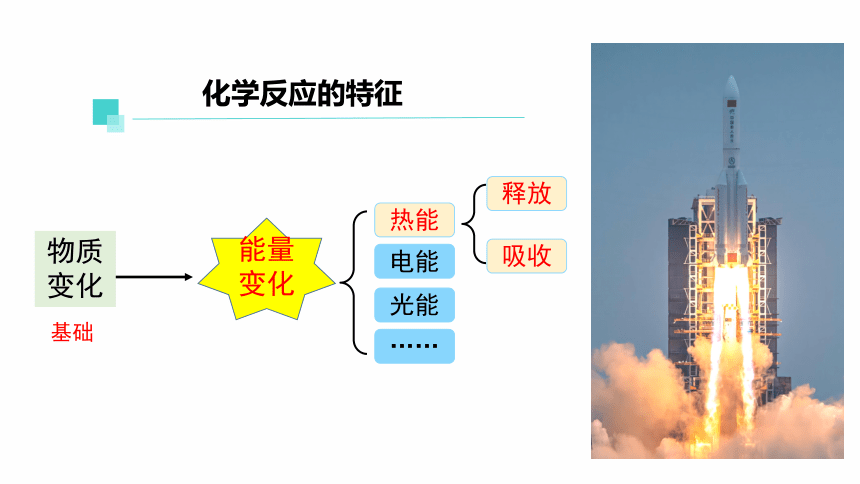
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
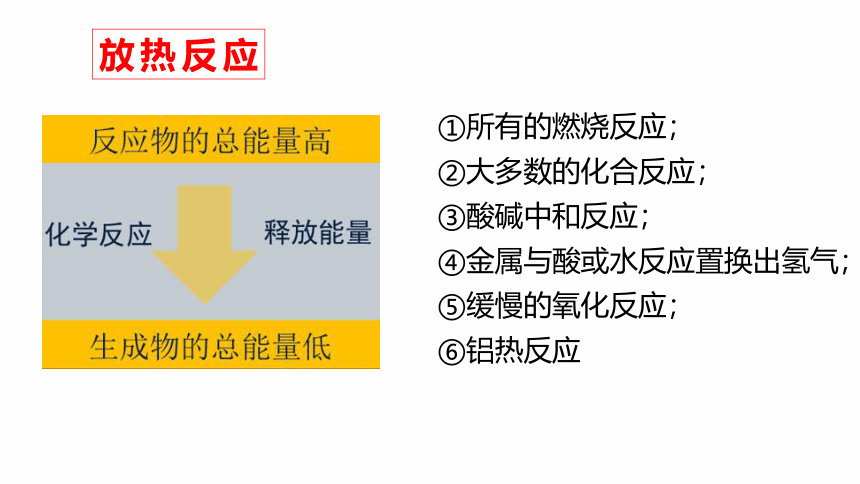
放热反应
①所有的燃烧反应;
②大多数的化合反应;
③酸碱中和反应;
④金属与酸或水反应置换出氢气;
⑤缓慢的氧化反应;
⑥铝热反应
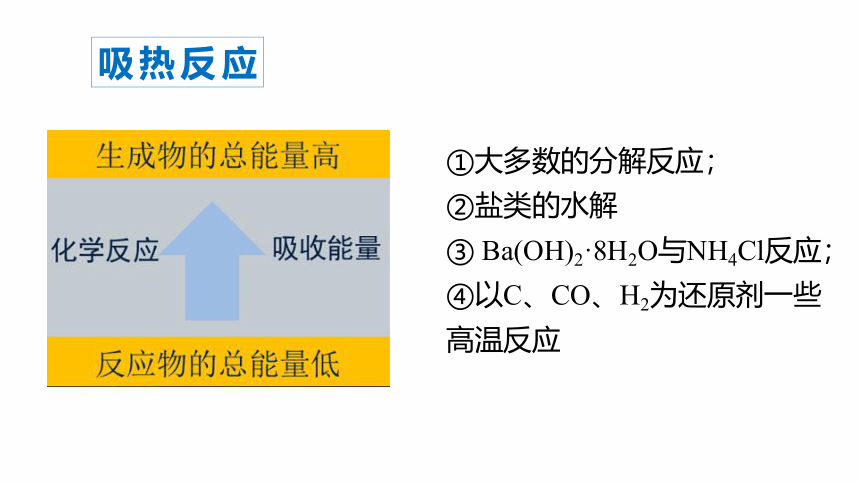
吸热反应
①大多数的分解反应;
②盐类的水解
③ Ba(OH)2·8H2O与NH4Cl反应;
④以C、CO、H2为还原剂一些高温反应
如何定量描述化学化学反应过程中释放或吸收的热量呢?
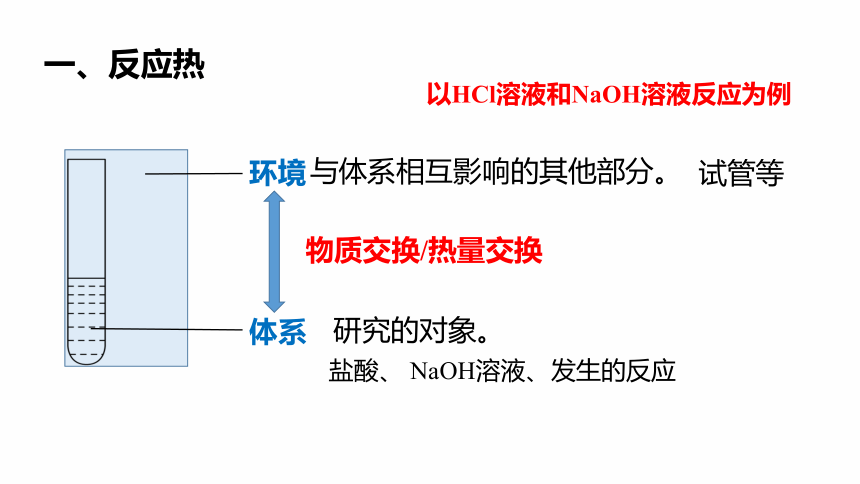
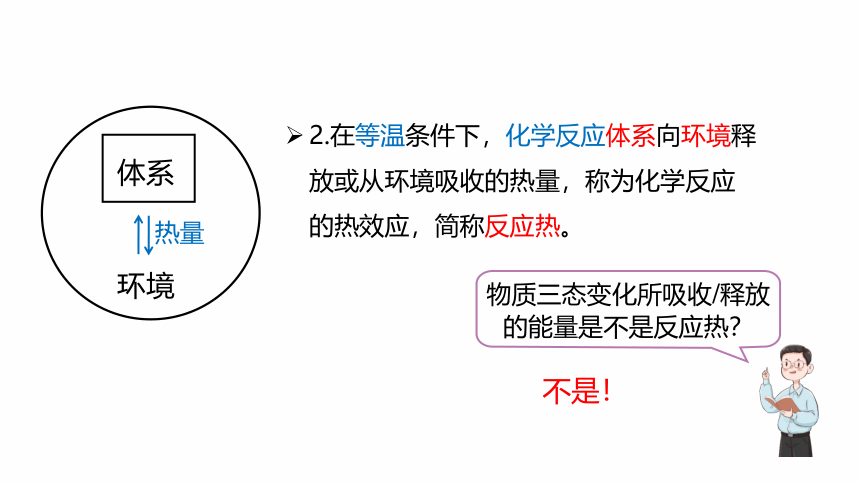
环境
体系
与体系相互影响的其他部分。
研究的对象。
一、反应热
试管等
盐酸、 NaOH溶液、发生的反应
物质交换/热量交换
以HCl溶液和NaOH溶液反应为例
2.在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
体系
热量
环境
物质三态变化所吸收/释放的能量是不是反应热?
不是!
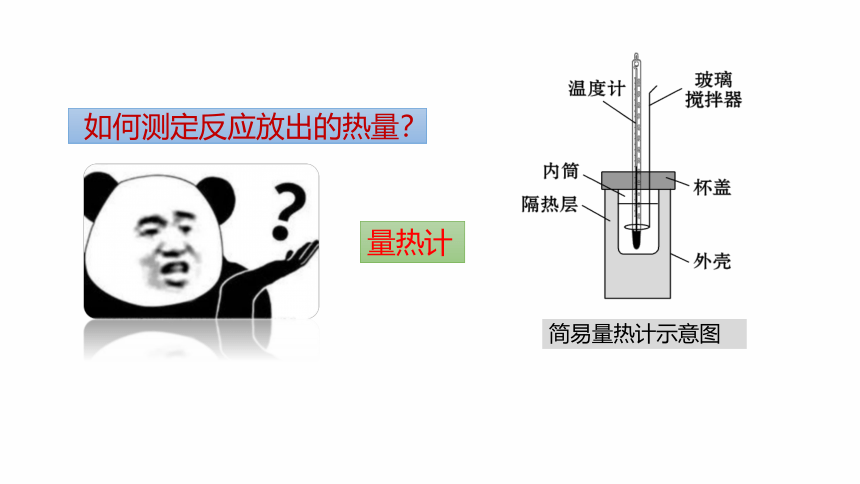
量热计
简易量热计示意图
如何测定反应放出的热量?
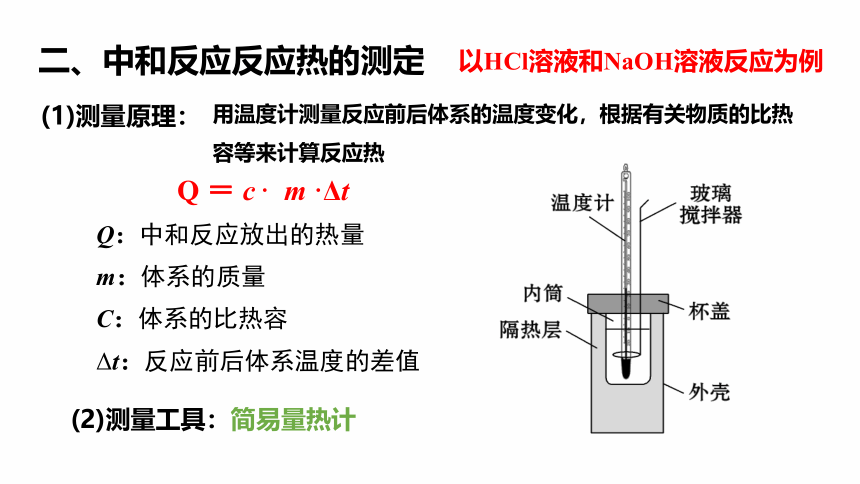
二、中和反应反应热的测定
以HCl溶液和NaOH溶液反应为例
(2)测量工具:简易量热计
(1)测量原理:
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热
Q = c · m ·Δt
Q:中和反应放出的热量
m:体系的质量
C:体系的比热容
Δt:反应前后体系温度的差值
50 mL 0.50 mol/L的盐酸
50 mL 0.55 mol/L氢氧化钠溶液
简易量热计、量筒 (50 mL)两个、
温度计、玻璃搅拌器
实验药品:
实验仪器:
实验原理:
Q = C m Δt
Q:中和反应放出的热量 m:反应混合液的质量
C:反应混合液的比热容 Δt:反应前后溶液温度的差值
实验探究——中和反应反应热的测定
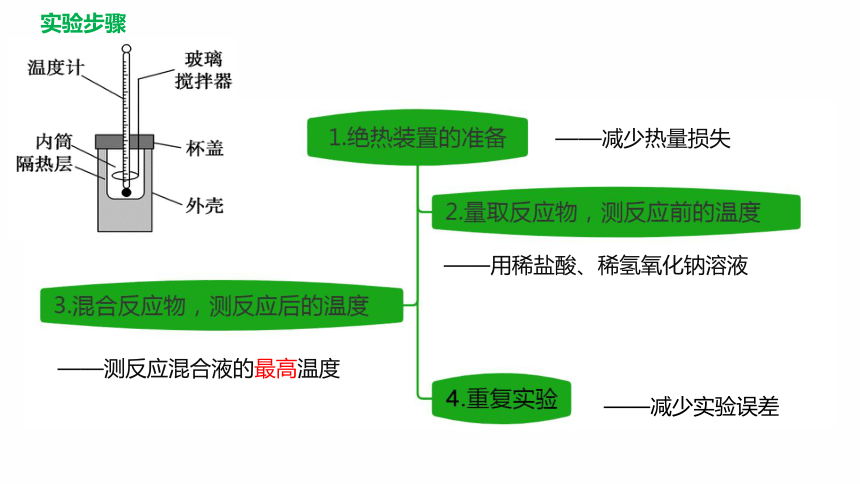
实验步骤
——减少热量损失
——用稀盐酸、稀氢氧化钠溶液
——测反应混合液的最高温度
——减少实验误差
实验探究——中和反应反应热的测定
【数据处理】
(1)取盐酸温度和NaOH溶液温度的__________记为反应前体系的温度(t1) 。计算温度差(t2 - t1),将数据填入下表。
平均值
次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
盐酸 NaOH 溶液 平均值 1 21.0 21.0 24.3
2 21.1 21.1 24.5
3 21.2 21.3 24.6
21.00
21.1
21.25
3.40
3.35
3.30
若温度差出现一组数据与其他数据差距很大,应当舍去!
实验探究——中和反应反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
(4)实验数据处理
为了计算简便,盐酸、氢氧化钠稀溶液的密度近似地认为都是1 g·cm-3,反应后生成的溶液的比热容c=4.18 J/(g·℃)。该实验中盐酸和NaOH溶液反应放出的热量是_______________,生成1mol H2O时放出的热量为 。
0.418(t2 - t1)kJ
0.418(t2 - t1)/ 0.025 kJ
计算: ( m1+m2 ) × c ×( t2 - t1 )/0.025
= (50+50)×4.18×3.35÷ 0.025
= 56.012 kJ
3.中和热的定义
在稀溶液中 酸碱中和生成 1mol水的反应热。
大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液在稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
HCl
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
×
×
×
1.用50mL0.55mol/LNaOH溶液,而不用50mL0.50mol/LNaOH溶液,为什么?
【提示】可以保证盐酸完全反应,使测得的中和热数值会更加准确。
2.实验中能否用铜制搅拌器代替玻璃搅拌器?为什么?
【提示】不能。因为铜制搅拌器易导热,使热量损失较大
交流与思考
3.酸、碱混合时,为何要把量筒中NaOH溶液一次倒入而不能缓缓倒入?
【提示】减少热量损失
2. 实验中是否可以更换温度计?
不能,会存在仪器误差
3. 能否测完酸后直接测量碱的温度?那如何操作?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干再测别的溶液。
4. 能否将NaOH分多次倒入热量计中?
不能,操作时动作要快,尽量减少热量的散失
5. 玻璃搅拌棒能否用金属搅拌棒代替?
不能。原因是金属质搅拌器易导热,造成热量损失。
1. 能否用浓硫酸代替盐酸?对结果会产生什么影响?
不能。浓硫酸溶解于水时放热,所测数值会偏大。
问题和讨论
56.012
kJ
57.3
kJ
VS
你测的数据
资料上的数据
为什么误差这么大?
×
数据
实验过程中有哪些因素会造成实验误差?
①装置本身缺陷:
②实验操作:
③数据处理:
如 动作慢,造成热量损失
保温性能差
酸碱溶液的比热容和密度均大于水
采用近似值计算,
【误差分析】
等压
反应热
(焓变)
体系
内能改变
产生
反应热
化学反应中为什么会产生反应热
1.内能(符号为U):体系内物质的各种能量的总和,受 、 、和 等的影响。
2.焓(符号为 ):与 有关的物理量。
3.焓变:在等压条件下进行的化学反应(严格地说,对反应体系做功有限定,中学阶段一般不考虑),其反应热等于反应的 ,符号:________,单位:________ (或________ )。
ΔH
kJ / mol
kJ·mol-1
反应热与焓变
H
内能
焓变
温度
压强
物质的聚集状态
[例1]在25℃和101 kPa下,1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= -184.6 kJ/mol
[例2]在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
注意:①ΔH必须带有 + 或 - ②ΔH单位 kJ/mol 必须标出。
ΔH<0时, ΔH越小,放出热量越多。
ΔH>0时, ΔH越大,吸收热量越多。
放热反应 ΔH<0
反应物与生成物总能量变化(宏观)
焓(H)
反应物
生成物
反应进程
焓(H)
生成物
反应物
反应进程
ΔH=生成物总能量(H生) - 反应物总能量(H反)
吸热反应 ΔH>0
化学反应中能量变化由反应物和生成物的总能量不同决定。
五、反应热的实质
化学键的键能变化(微观)
化学反应的实质:旧键的断裂(吸热),新键的形成(放热)。
能量
反应进程
反应物
生成物
E吸
E放
能量
反应进程
生成物
反应物
E放
E吸
放热反应 ΔH<0
吸热反应 ΔH>0
五、反应热的实质
H2(g)+Cl2(g)=2HCl(g)反应的能量变化示意图
计算
断键吸收能量:
436 KJ + 243 kJ = 679 kJ
成键放出能量:
431 kJ + 431 kJ = 862 kJ
ΔH = -183 kJ/mol
实验测得:ΔH= -184.6 kJ/mol
H=反应物的总键能(E吸) - 生成物的总键能(E放)
化学反应中能量变化的主要原因:化学键断裂和形成时的能量变化。
计算反应热的三种方法:
H=
E(生成物的总能量)- E(反应物的总能量)
H=
E(反应物断键时所吸收的总能量)-E(生成物成键时所释放的总能量)
H=
E(反应物的总键能)- E(生成物的总键能)
【例1】:下列过程中能量变化与图像不相符的是( )
练一练
D
2、反应A+B → C (ΔH<0)分两步进行:
①A+B → X(ΔH>0); ②X → C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是 ( )
A
练一练
3、断开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1 mol N2生成NH3的反应热为 ,
则1 mol H2生成NH3的反应热为 。
-92.0 kJ/mol
-30.67 kJ/mol
练一练
练一练
4、N4 分子结构为正四面体(如图)。已知:断裂 N4 (g) 中 1mol N-N 键吸收 193 kJ 能量,形成 N2 (g) 中1mol N N键放出 941 kJ 能量。下列说法正确的是( )
A. N4 (g) 比 N2 (g) 更稳定
B. N4 (g) = 2 N2 (g) ΔH = + 724 kJ·mol-1
C. 形成 1 mol N4 (g) 中的化学键放出 193 kJ 的能量
D. 1 mol N2 (g) 完全转化为 N4 (g),体系的能量增加 362 kJ
N4
D
(1)物质总能量越低,物质越稳定
(2)化学键能越高,物质越稳定
3、 C (石墨,s) = C (金刚石,s) ΔH = +1.9 kJ/mol,
石墨、金刚石哪个更稳定?试分析物质稳定性与键能的关系。
H > 0,吸热反应,石墨键能大,总能量低,更稳定。
练一练
课堂小结
第1节 反应热
第1课时:反应热 焓变
第一章
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
放热反应
①所有的燃烧反应;
②大多数的化合反应;
③酸碱中和反应;
④金属与酸或水反应置换出氢气;
⑤缓慢的氧化反应;
⑥铝热反应
吸热反应
①大多数的分解反应;
②盐类的水解
③ Ba(OH)2·8H2O与NH4Cl反应;
④以C、CO、H2为还原剂一些高温反应
如何定量描述化学化学反应过程中释放或吸收的热量呢?
环境
体系
与体系相互影响的其他部分。
研究的对象。
一、反应热
试管等
盐酸、 NaOH溶液、发生的反应
物质交换/热量交换
以HCl溶液和NaOH溶液反应为例
2.在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
体系
热量
环境
物质三态变化所吸收/释放的能量是不是反应热?
不是!
量热计
简易量热计示意图
如何测定反应放出的热量?
二、中和反应反应热的测定
以HCl溶液和NaOH溶液反应为例
(2)测量工具:简易量热计
(1)测量原理:
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热
Q = c · m ·Δt
Q:中和反应放出的热量
m:体系的质量
C:体系的比热容
Δt:反应前后体系温度的差值
50 mL 0.50 mol/L的盐酸
50 mL 0.55 mol/L氢氧化钠溶液
简易量热计、量筒 (50 mL)两个、
温度计、玻璃搅拌器
实验药品:
实验仪器:
实验原理:
Q = C m Δt
Q:中和反应放出的热量 m:反应混合液的质量
C:反应混合液的比热容 Δt:反应前后溶液温度的差值
实验探究——中和反应反应热的测定
实验步骤
——减少热量损失
——用稀盐酸、稀氢氧化钠溶液
——测反应混合液的最高温度
——减少实验误差
实验探究——中和反应反应热的测定
【数据处理】
(1)取盐酸温度和NaOH溶液温度的__________记为反应前体系的温度(t1) 。计算温度差(t2 - t1),将数据填入下表。
平均值
次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
盐酸 NaOH 溶液 平均值 1 21.0 21.0 24.3
2 21.1 21.1 24.5
3 21.2 21.3 24.6
21.00
21.1
21.25
3.40
3.35
3.30
若温度差出现一组数据与其他数据差距很大,应当舍去!
实验探究——中和反应反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
(4)实验数据处理
为了计算简便,盐酸、氢氧化钠稀溶液的密度近似地认为都是1 g·cm-3,反应后生成的溶液的比热容c=4.18 J/(g·℃)。该实验中盐酸和NaOH溶液反应放出的热量是_______________,生成1mol H2O时放出的热量为 。
0.418(t2 - t1)kJ
0.418(t2 - t1)/ 0.025 kJ
计算: ( m1+m2 ) × c ×( t2 - t1 )/0.025
= (50+50)×4.18×3.35÷ 0.025
= 56.012 kJ
3.中和热的定义
在稀溶液中 酸碱中和生成 1mol水的反应热。
大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液在稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
HCl
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
×
×
×
1.用50mL0.55mol/LNaOH溶液,而不用50mL0.50mol/LNaOH溶液,为什么?
【提示】可以保证盐酸完全反应,使测得的中和热数值会更加准确。
2.实验中能否用铜制搅拌器代替玻璃搅拌器?为什么?
【提示】不能。因为铜制搅拌器易导热,使热量损失较大
交流与思考
3.酸、碱混合时,为何要把量筒中NaOH溶液一次倒入而不能缓缓倒入?
【提示】减少热量损失
2. 实验中是否可以更换温度计?
不能,会存在仪器误差
3. 能否测完酸后直接测量碱的温度?那如何操作?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干再测别的溶液。
4. 能否将NaOH分多次倒入热量计中?
不能,操作时动作要快,尽量减少热量的散失
5. 玻璃搅拌棒能否用金属搅拌棒代替?
不能。原因是金属质搅拌器易导热,造成热量损失。
1. 能否用浓硫酸代替盐酸?对结果会产生什么影响?
不能。浓硫酸溶解于水时放热,所测数值会偏大。
问题和讨论
56.012
kJ
57.3
kJ
VS
你测的数据
资料上的数据
为什么误差这么大?
×
数据
实验过程中有哪些因素会造成实验误差?
①装置本身缺陷:
②实验操作:
③数据处理:
如 动作慢,造成热量损失
保温性能差
酸碱溶液的比热容和密度均大于水
采用近似值计算,
【误差分析】
等压
反应热
(焓变)
体系
内能改变
产生
反应热
化学反应中为什么会产生反应热
1.内能(符号为U):体系内物质的各种能量的总和,受 、 、和 等的影响。
2.焓(符号为 ):与 有关的物理量。
3.焓变:在等压条件下进行的化学反应(严格地说,对反应体系做功有限定,中学阶段一般不考虑),其反应热等于反应的 ,符号:________,单位:________ (或________ )。
ΔH
kJ / mol
kJ·mol-1
反应热与焓变
H
内能
焓变
温度
压强
物质的聚集状态
[例1]在25℃和101 kPa下,1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= -184.6 kJ/mol
[例2]在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
注意:①ΔH必须带有 + 或 - ②ΔH单位 kJ/mol 必须标出。
ΔH<0时, ΔH越小,放出热量越多。
ΔH>0时, ΔH越大,吸收热量越多。
放热反应 ΔH<0
反应物与生成物总能量变化(宏观)
焓(H)
反应物
生成物
反应进程
焓(H)
生成物
反应物
反应进程
ΔH=生成物总能量(H生) - 反应物总能量(H反)
吸热反应 ΔH>0
化学反应中能量变化由反应物和生成物的总能量不同决定。
五、反应热的实质
化学键的键能变化(微观)
化学反应的实质:旧键的断裂(吸热),新键的形成(放热)。
能量
反应进程
反应物
生成物
E吸
E放
能量
反应进程
生成物
反应物
E放
E吸
放热反应 ΔH<0
吸热反应 ΔH>0
五、反应热的实质
H2(g)+Cl2(g)=2HCl(g)反应的能量变化示意图
计算
断键吸收能量:
436 KJ + 243 kJ = 679 kJ
成键放出能量:
431 kJ + 431 kJ = 862 kJ
ΔH = -183 kJ/mol
实验测得:ΔH= -184.6 kJ/mol
H=反应物的总键能(E吸) - 生成物的总键能(E放)
化学反应中能量变化的主要原因:化学键断裂和形成时的能量变化。
计算反应热的三种方法:
H=
E(生成物的总能量)- E(反应物的总能量)
H=
E(反应物断键时所吸收的总能量)-E(生成物成键时所释放的总能量)
H=
E(反应物的总键能)- E(生成物的总键能)
【例1】:下列过程中能量变化与图像不相符的是( )
练一练
D
2、反应A+B → C (ΔH<0)分两步进行:
①A+B → X(ΔH>0); ②X → C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是 ( )
A
练一练
3、断开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1 mol N2生成NH3的反应热为 ,
则1 mol H2生成NH3的反应热为 。
-92.0 kJ/mol
-30.67 kJ/mol
练一练
练一练
4、N4 分子结构为正四面体(如图)。已知:断裂 N4 (g) 中 1mol N-N 键吸收 193 kJ 能量,形成 N2 (g) 中1mol N N键放出 941 kJ 能量。下列说法正确的是( )
A. N4 (g) 比 N2 (g) 更稳定
B. N4 (g) = 2 N2 (g) ΔH = + 724 kJ·mol-1
C. 形成 1 mol N4 (g) 中的化学键放出 193 kJ 的能量
D. 1 mol N2 (g) 完全转化为 N4 (g),体系的能量增加 362 kJ
N4
D
(1)物质总能量越低,物质越稳定
(2)化学键能越高,物质越稳定
3、 C (石墨,s) = C (金刚石,s) ΔH = +1.9 kJ/mol,
石墨、金刚石哪个更稳定?试分析物质稳定性与键能的关系。
H > 0,吸热反应,石墨键能大,总能量低,更稳定。
练一练
课堂小结
