人教版选择性必修一2.2 化学平衡常数课件(21张)
文档属性
| 名称 | 人教版选择性必修一2.2 化学平衡常数课件(21张) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 08:04:07 | ||
图片预览








文档简介
(共21张PPT)
化学平衡常数及其计算
一、课堂导入
这些成语都在描述了一个共同的问题:
程度的大小
箭矢如雨、无边无际、深不可测、入木三分
用什么来描述热的程度有多大呢?
温度
用什么来描述车速快到什么程度呢?
速度
化学平衡:指在该条件下,化学反应能达到的最大限度。
我们如何来衡量一个化学反应进行的程度大小呢?
化学平衡常数
起始时各物质的浓度 (mol/L) 457.6℃ 平衡时时各物质的浓度 (mol/L) 457.6℃
H2 I2 HI H2 I2 HI
1.197*10-2 6.944*10-2 0 5.617*10-3 5.936*10-4 1.270*10-2 48.38
1.228*10-2 9.964*10-3 0 3.841*10-3 1.524*10-3 1.687*10-2 48.61
1.201*10-2 8.403*10-3 0 4.580*10-3 9.733*10-4 1.486*10-2 49.54
0 0 1.520*10-2 1.696*10-3 1.696*10-3 1.181*10-2 48.48
0 0 1.287*10-2 1.433*10-3 1.433*10-3 1.000*10-2 48.71
0 0 3.777*10-2 4.213*10-3 4.213*10-3 2.934*10-2 48.81
平均值 48.74
平衡常数
化学平衡常数
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数
——化学平衡常数(K)
看表说话
I2(g) + H2(g) 2HI(g)
当在一定温度下达到平衡时,其平衡常数表达式为:
mA(g) + nB(g) pC(g) + qD(g)
对于一般可逆反应:
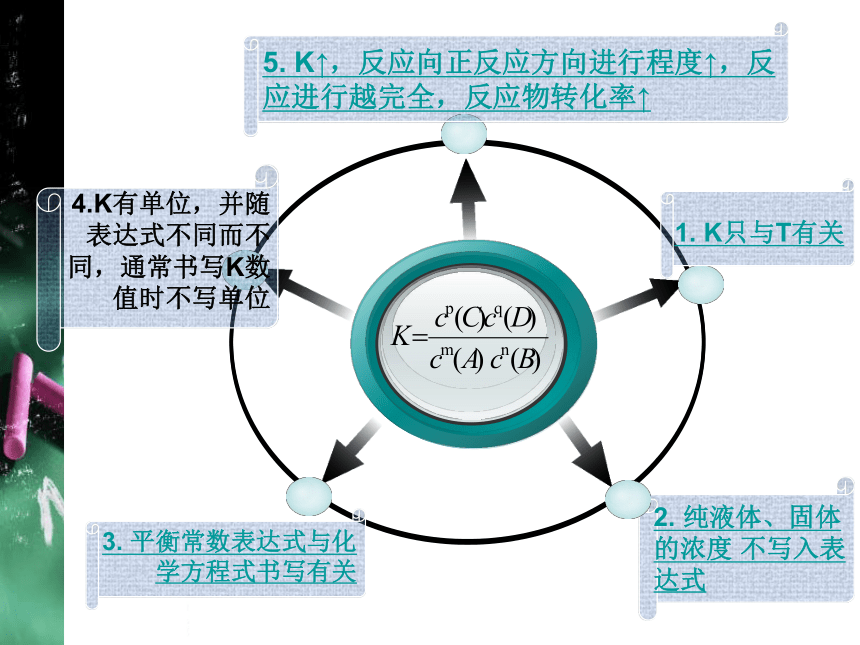
2. 纯液体、固体的浓度 不写入表达式
5. K↑,反应向正反应方向进行程度↑,反应进行越完全,反应物转化率↑
3. 平衡常数表达式与化学方程式书写有关
1. K只与T有关
4.K有单位,并随表达式不同而不同,通常书写K数值时不写单位
【课堂练习1】
写出下列化学方程式的化学平衡常数表达式
(1)CO(g)+O2(g) CO2(g)
(2)2CO2(g) 2CO(g)+O2(g)
(3)C(s)+2H2(g) CH4(g)
(4) CO2(g)+H2(g) CO(g)+H2O(l)
(5)As2O5(s)+3H2O(g) 2H3AsO4(s)
1、平衡常数K与温度有关,与浓度无关,
由K随温度的变化可推断正反应是吸热反应还是放热。
若正反应是吸热反应,升高温度,K 增大;若正反应是放热反应,升高温度,K 减少;
练习:试写出下列反应的浓度平衡常数的数学表达式:
2SO2(g)+O2(g) 2SO3 (g)
C(s)+H2O(g) CO(g)+H2(g)
催化剂
注意:
2.反应中的固体或纯溶剂不列入平衡常数的表达式中!
3、同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
例:N2O4(g) 2NO2(g)
Kc = [NO2]2/[N2O4]
1/2N2O4(g) NO2(g)
Kc = [NO2]/[N2O4]1/2
1/3N2O4(g) 2/3NO2(g)
Kc = [NO2]2/3/[N2O4]1/3
5. a 平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。因为平衡状态是反应进行的最大限度。如: N2(g)+O2(g) 2NO(g)
Kc=1×10-30(298K)
这意味着298K时,N2和O2基本上没有进行反应,反之NO分解的逆反应在该温度下将几乎完全进行,平衡时NO实际上全部分解为N2和O2。
意义
b 平衡常数K值的大小,可推断反应进行的程度。
K值越大,表示反应进行的程度越大,反应物的转化率越大;K值越小,表示反应进行的程度越小,反应物的转化率越小。
c 反应的平衡常数与反应可能进行的程度。一般来说,反应的平衡常数KC≥105,认为正反应进行得较完全;KC ≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。
2、三段式计算平衡常数
课本P35
3、浓度商
定义:某一时刻生成物浓度幂之积与反应物浓度幂之积的比值,
用符号 Q表示。
注意:这里的浓度是某时刻的浓度而不是平衡浓度
应用:判断某时刻平衡进行的方向或V正 与V逆的相对大小
Q < K:反应向正反应方向进行 、V正 > V逆
Q > K:反应向逆反应方向进行、V正 < V逆
Q = K:反应处于平衡状态、V正 = V逆
【课堂练习3】
(1)该反应的化学方程式是: .
(3) 在500℃下该反应 K= 0.6 ,在体积为1L容器中充入1mol N2
3mol H2某时刻检测到N2浓度为0.7mol/L则此时反应往
反应方向进行,V正 V逆(选填“>”“<”或“=”)。
N2(g) + 3H2(g) = 2NH3(g)
正
>
【课堂练习3】
温度/℃ 700 800 830 1000 1200
K 1.67 1.11 1.00 0.6 0.38
CO(g) + H2O(g) = CO2(g) + H2(g)
1000 ℃
>
1、25℃时,向容器a充入1mol的A和1mol的B,
向容器b中充入2mol的A和1mol的B,发生反应
mA(g) + nB(g) = pC(g) + qD(g)反应达到平衡时
平衡常数分别为 K1、K2,则 K1 K2(填“
大于”“小于”“等于”)
【课堂练习2】
等于
【课堂练习2】
2、已知反应2CO2(g) 2CO(g)+O2(g) 正反应速率为V正和
逆反应速率为V逆受温度影响下列说法正确的是( )
D
4、补充:多重平衡规则
若干方程式相加(减),则总反应的平衡
常数等于分步平衡常数之乘积(商)
例1: 2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K = K1 K2
例2:
C (s) + CO2(g) 2CO(g) K
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/K2
Thank you!
化学平衡常数及其计算
一、课堂导入
这些成语都在描述了一个共同的问题:
程度的大小
箭矢如雨、无边无际、深不可测、入木三分
用什么来描述热的程度有多大呢?
温度
用什么来描述车速快到什么程度呢?
速度
化学平衡:指在该条件下,化学反应能达到的最大限度。
我们如何来衡量一个化学反应进行的程度大小呢?
化学平衡常数
起始时各物质的浓度 (mol/L) 457.6℃ 平衡时时各物质的浓度 (mol/L) 457.6℃
H2 I2 HI H2 I2 HI
1.197*10-2 6.944*10-2 0 5.617*10-3 5.936*10-4 1.270*10-2 48.38
1.228*10-2 9.964*10-3 0 3.841*10-3 1.524*10-3 1.687*10-2 48.61
1.201*10-2 8.403*10-3 0 4.580*10-3 9.733*10-4 1.486*10-2 49.54
0 0 1.520*10-2 1.696*10-3 1.696*10-3 1.181*10-2 48.48
0 0 1.287*10-2 1.433*10-3 1.433*10-3 1.000*10-2 48.71
0 0 3.777*10-2 4.213*10-3 4.213*10-3 2.934*10-2 48.81
平均值 48.74
平衡常数
化学平衡常数
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数
——化学平衡常数(K)
看表说话
I2(g) + H2(g) 2HI(g)
当在一定温度下达到平衡时,其平衡常数表达式为:
mA(g) + nB(g) pC(g) + qD(g)
对于一般可逆反应:
2. 纯液体、固体的浓度 不写入表达式
5. K↑,反应向正反应方向进行程度↑,反应进行越完全,反应物转化率↑
3. 平衡常数表达式与化学方程式书写有关
1. K只与T有关
4.K有单位,并随表达式不同而不同,通常书写K数值时不写单位
【课堂练习1】
写出下列化学方程式的化学平衡常数表达式
(1)CO(g)+O2(g) CO2(g)
(2)2CO2(g) 2CO(g)+O2(g)
(3)C(s)+2H2(g) CH4(g)
(4) CO2(g)+H2(g) CO(g)+H2O(l)
(5)As2O5(s)+3H2O(g) 2H3AsO4(s)
1、平衡常数K与温度有关,与浓度无关,
由K随温度的变化可推断正反应是吸热反应还是放热。
若正反应是吸热反应,升高温度,K 增大;若正反应是放热反应,升高温度,K 减少;
练习:试写出下列反应的浓度平衡常数的数学表达式:
2SO2(g)+O2(g) 2SO3 (g)
C(s)+H2O(g) CO(g)+H2(g)
催化剂
注意:
2.反应中的固体或纯溶剂不列入平衡常数的表达式中!
3、同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
例:N2O4(g) 2NO2(g)
Kc = [NO2]2/[N2O4]
1/2N2O4(g) NO2(g)
Kc = [NO2]/[N2O4]1/2
1/3N2O4(g) 2/3NO2(g)
Kc = [NO2]2/3/[N2O4]1/3
5. a 平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。因为平衡状态是反应进行的最大限度。如: N2(g)+O2(g) 2NO(g)
Kc=1×10-30(298K)
这意味着298K时,N2和O2基本上没有进行反应,反之NO分解的逆反应在该温度下将几乎完全进行,平衡时NO实际上全部分解为N2和O2。
意义
b 平衡常数K值的大小,可推断反应进行的程度。
K值越大,表示反应进行的程度越大,反应物的转化率越大;K值越小,表示反应进行的程度越小,反应物的转化率越小。
c 反应的平衡常数与反应可能进行的程度。一般来说,反应的平衡常数KC≥105,认为正反应进行得较完全;KC ≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。
2、三段式计算平衡常数
课本P35
3、浓度商
定义:某一时刻生成物浓度幂之积与反应物浓度幂之积的比值,
用符号 Q表示。
注意:这里的浓度是某时刻的浓度而不是平衡浓度
应用:判断某时刻平衡进行的方向或V正 与V逆的相对大小
Q < K:反应向正反应方向进行 、V正 > V逆
Q > K:反应向逆反应方向进行、V正 < V逆
Q = K:反应处于平衡状态、V正 = V逆
【课堂练习3】
(1)该反应的化学方程式是: .
(3) 在500℃下该反应 K= 0.6 ,在体积为1L容器中充入1mol N2
3mol H2某时刻检测到N2浓度为0.7mol/L则此时反应往
反应方向进行,V正 V逆(选填“>”“<”或“=”)。
N2(g) + 3H2(g) = 2NH3(g)
正
>
【课堂练习3】
温度/℃ 700 800 830 1000 1200
K 1.67 1.11 1.00 0.6 0.38
CO(g) + H2O(g) = CO2(g) + H2(g)
1000 ℃
>
1、25℃时,向容器a充入1mol的A和1mol的B,
向容器b中充入2mol的A和1mol的B,发生反应
mA(g) + nB(g) = pC(g) + qD(g)反应达到平衡时
平衡常数分别为 K1、K2,则 K1 K2(填“
大于”“小于”“等于”)
【课堂练习2】
等于
【课堂练习2】
2、已知反应2CO2(g) 2CO(g)+O2(g) 正反应速率为V正和
逆反应速率为V逆受温度影响下列说法正确的是( )
D
4、补充:多重平衡规则
若干方程式相加(减),则总反应的平衡
常数等于分步平衡常数之乘积(商)
例1: 2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K = K1 K2
例2:
C (s) + CO2(g) 2CO(g) K
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/K2
Thank you!
