【单元检测】2022-2023学年上学期浙教版九年级科学卷(一)第一章 物质及其变化(综合A)【word,含答案】
文档属性
| 名称 | 【单元检测】2022-2023学年上学期浙教版九年级科学卷(一)第一章 物质及其变化(综合A)【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 557.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-11-04 09:55:24 | ||
图片预览




文档简介
第一章 物质及其变化(综合A)
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.如图食品、调味品的制作过程中,没有发生化学变化的是( )
A.豆腐发酵制臭豆腐 B.黄豆酿酱油 C.粮食酿酒 D.水果榨果汁
2.下列化学反应中,属于复分解反应的是( )
A.2H2+O22H20 B.NaCl+AgNO3=AgC1↓+NaNO3
C.Mg+2HCl=MgCl2+H2↑ D.H2CO3H2O+CO2↑
3.盐酸先生闯迷宫(如图),请你帮它选择行进路线(不发生化学反应)( )
4.衣服沾上铁锈(主要成分是Fe2O3),直接用水很难洗净。要除去白色衬衣上的铁锈,你认为比较适宜的液体是( )
A.白醋 B.酱油 C.酒精 D.洗洁精
5.氢氧化铯是一种可溶性碱,其分子式是CsOH,则下列叙述中正确的是( )
A.CsOH溶液能使紫色的石蕊变成红色
B.CsOH在水中的电离方程式为:CsOH=Cs2++20H-
C.CsOH溶液能使无色的酚酞试液变红色
D.CsOH与硫酸反应生成的盐的化学式为CsSO4
6.久置于空气中的石灰水,其表面会形成白膜。此时溶液的pH与变化前溶液的pH相比( )
A.偏大 B.偏小 C.一样 D.无法比较
7.为区别稀盐酸和稀硫酸,小强同学设计如图所示的实验方案:在每组的两支试管中分别盛放稀盐酸和稀硫酸,向同组的两支试管各滴加同种试剂。其中能达到实验目的的是( )
A B C D
8.如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是( )
A.反应结束时溶液的pH=7 B.反应前后元素的种类没有变化
C.氢氧化钠溶液中存在的粒子是Na+和OH- D.该反应的实质是H+和OH-结合生成H2O
9.对下列实验过程的评价,不正确的是( )
A.某固体加入稀盐酸,产生无色气体,该固体可能含有CO
B.某无色溶液滴入酚酞试液显红色,该溶液一定是碱性溶液
C.某溶液中滴加BaCl2溶液产生不溶于稀HNO3的白色沉淀,该溶液中不一定含有SO
D.验证烧碱部分变质,先加少量氯化钡溶液产生白色沉淀,再加无色酚酞试液呈红色
10.向H2SO4和CuS04的混合溶液中不断加入NaOH溶液,下列图像能正确表示对应关系的是( )
A B C D
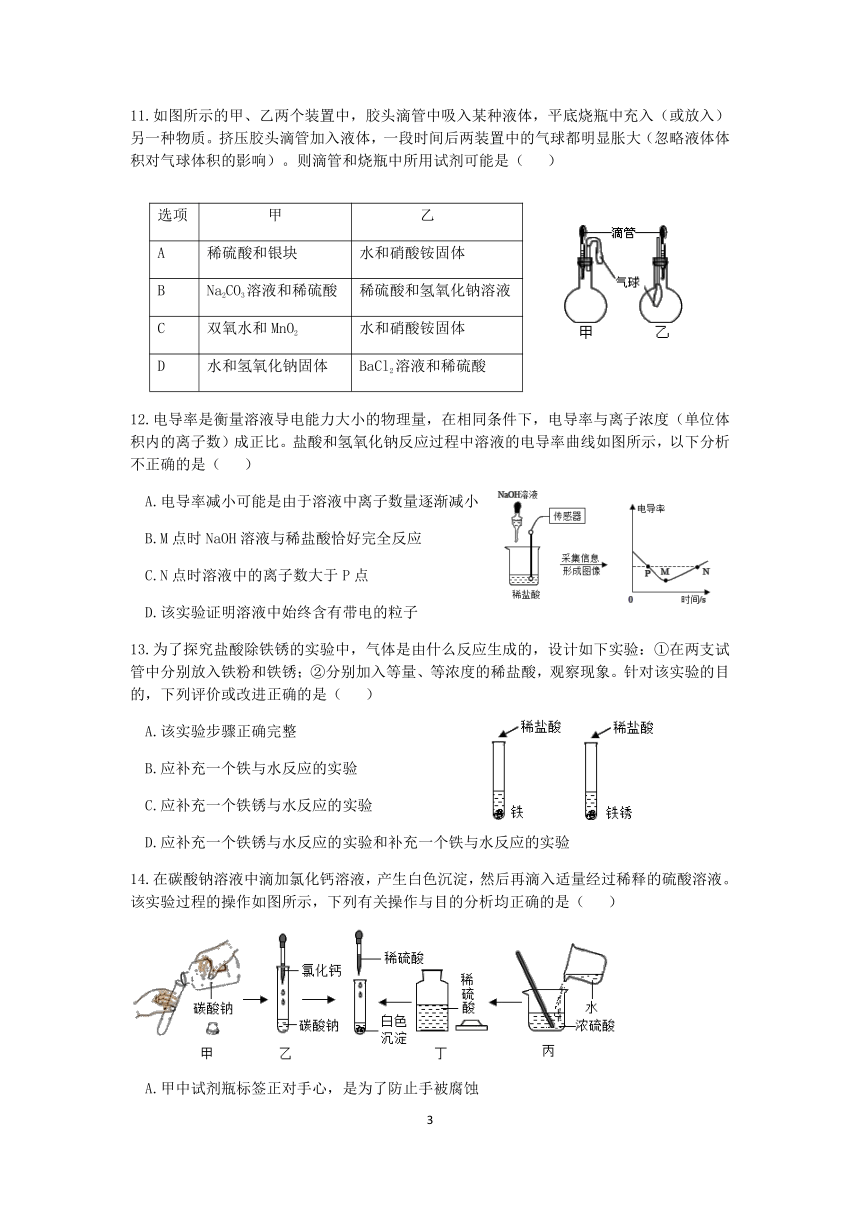
11.如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质。挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响)。则滴管和烧瓶中所用试剂可能是( )
选项 甲 乙
A 稀硫酸和银块 水和硝酸铵固体
B Na2CO3溶液和稀硫酸 稀硫酸和氢氧化钠溶液
C 双氧水和MnO2 水和硝酸铵固体
D 水和氢氧化钠固体 BaCl2溶液和稀硫酸
12.电导率是衡量溶液导电能力大小的物理量,在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比。盐酸和氢氧化钠反应过程中溶液的电导率曲线如图所示,以下分析不正确的是( )
A.电导率减小可能是由于溶液中离子数量逐渐减小
B.M点时NaOH溶液与稀盐酸恰好完全反应
C.N点时溶液中的离子数大于P点
D.该实验证明溶液中始终含有带电的粒子
13.为了探究盐酸除铁锈的实验中,气体是由什么反应生成的,设计如下实验:①在两支试管中分别放入铁粉和铁锈;②分别加入等量、等浓度的稀盐酸,观察现象。针对该实验的目的,下列评价或改进正确的是( )
A.该实验步骤正确完整
B.应补充一个铁与水反应的实验
C.应补充一个铁锈与水反应的实验
D.应补充一个铁锈与水反应的实验和补充一个铁与水反应的实验
14.在碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液。该实验过程的操作如图所示,下列有关操作与目的分析均正确的是( )
A.甲中试剂瓶标签正对手心,是为了防止手被腐蚀
B.乙中将滴管伸入试管内,是为了防止试剂滴落到试管外
C.丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染
D.丙中将水缓缓倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅
15.将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
A.N点时,所得溶液的pH=7
B.Q点时,所得溶液中的溶质只含有BaCl2
C.0至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O
D.P至Q段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O
16.下列各组物质能在同一溶液中大量共存的是( )
A.NaCl HCl MgSO4 Cu(NO3)2 B.AgNO3 NaCl Mg(NO3)2 NaOH
C.Ca(OH)2 NaNO3 Na2CO3 NH4CL D.HCI K2SO4 NaOH NaNO3
17.物质X与氢氧化钠溶液发生反应的化学方程式为:X+2NaOH=Y+Cu(OH)2↓,下列说法正确的是( )
A.X可能是酸 B.X和Y的相对分子质量之差为18
C.X可能是CuCl2 D.Y可能是水
18.向盛有HC1和CuCl2的混合溶液中逐滴加入NaOH溶液至过量,下列4个图像能正确反应烧杯内的某些物理量变化趋势的是( )
A.①③ B.①②④ C.②④ D.①②③
19.为探究久置氢氧化钠固体的变质情况。某小组同学进行了如图所示实验,并得出部分变质的结论。下列分析正确的是( )
A.甲溶液可以选择稀盐酸或BaCl2溶液
B.D物质可能是气体,也可能是沉淀
C.溶液B中的溶质一定只含有NaOH和甲
D.步骤Ⅲ中溶液变成红色
20.向一定质量的氯化镁溶液中滴加氢氧化钠溶液,一段时间后,改为滴加稀硫酸,所得沉淀质量随加人试剂总体积的变化趋势如图所示。下列有关说法不正确的是( )
A.a点时溶液中一定不存在Mg2+
B.b点时所加试剂一定是稀硫酸
C.c点时溶液中的溶质都是盐
D.加入试剂总体积为V1时,溶液中不存在NaOH
二、填空题(共26分)
21.(3分)归纳总结是学习化学的一种方法。莉莉整理的氢氧化钠的化学性质如图。结合此图回答下列问题。
(1)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为 。所以要密封保存。实验室须密封保存的物质还有 (填名称)。
(2)为验证X与氢氧化钠溶液的反应,应该选择的物质是 (填序号)。
A.CO2 B.HCl C.FeCl3 D.Na2CO3
22.(3分)世界是由物质组成的,请选择下列物质的序号填空:
A.干冰; B.酒精; C.消石灰; D.碳酸钠;
(1)用作中和酸性土壤的是 。
(2)用于人工降雨的是 。
(3)“侯氏联合制碱法”中的“碱”是 。
23.(4分)在我市经济开发的进程中,要坚持“开发与环保并重”。某化学课外活动小组在调查一化工厂时发现,该厂有甲、乙两个车间,排出的废水都澄清透明,经分析分别含有三种不同离子,共有K+、Ba2+、Cu2+、OH-、NO3-、CO六种离子。
(1)已知甲车间的废水明显呈碱性,则乙车间废水中含有的阴离子是 。
(2)将甲、乙两车间的废水按适当比例混合,可以变废为宝,既能使废水中的Ba2+、Cu2+、OH-、CO等离子转化为沉淀除去,又可以用上层清液来浇灌农田。清液中含有的溶质主要是 (填化学式)。
24.(4分)某同学为探究氢氧化钙的性质,进行如图甲所示实验。实验后,他向反应后的溶液中逐滴滴加Na2CO3溶液,溶液的pH值变化如图乙所示。请回答下列问题:
甲 乙
(1)m点的溶质是 (填化学式)
(2)图乙中m到n的反应过程中可观察到的现象是 。
25.(6分)有一包粉末,是CaCO3、NaOH、FeCl3、Na2CO3中的一种或几种。为确定其组成,现进行以下实验,各步骤均已充分反应。
①取一定质量的粉末,加足量水搅拌后过滤,得到白色沉淀和无色溶液。
②向步骤①得到的溶液中加入足量稀盐酸,得到无色气体和无色溶液。
(1)固体粉末中一定存在 ,一定不存在 。
(2)为确定可能含有的物质,还需做哪些实验: 。(写出简要操作、现象、结论)
26.(6分)用传感器探究氢氧化钠溶液与稀硫酸发生酸碱中和过程中温度和pH的变化,实验测定结果如图甲、乙所示。请回答:
(1)图甲表明酸和碱的反应是 反应(填“吸热”或“放热”)。
(2)图乙表明实验时将 (填“酸溶液滴入碱溶液”或“碱溶液滴人酸溶液”)中。
(3)在反应50s时的溶液中滴加酚酞试液,可观察到实验现象是 。
三、实验探究题(每空2分,共22分)
27.(10分)小红利用底部有一小孔的大试管,如图甲所示装配成一个制取CO2气体的装置。
(1)实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到 ,则说明装置气密性良好。
(2)小红将CO2通入盛有NaOH溶液的试管中,观察不到明显现象。那么CO2与NaOH是否发生反应?为此又做了实验:在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶盖振荡,发现瓶变瘪,于是认为CO2与NaOH发生了反应。小衢提出质疑,认为导致软塑料瓶变瘪的原因还有可能是 。
(3)小红从变瘪的软塑料瓶中取出少量试液置于试管中,滴入 溶液(填一种盐),观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生。
(4)要证明CO2与NaOH的反应确实已经发生,还可以加入 [物质类别与第(3)题不同的物质],并写出相应的化学方程式: 。
28.(6分)如图所示是为了验证稀硫酸化学性质所做的三个实验,回答下列问题。
(1)A实验最终能观察到的现象是___________。
(2)C实验中发生反应的化学方程式为___________。
(3)若要证明C实验所加的BaCl2溶液过量,小明的实验操作及现象是:取少量C中上层清液于试管中,滴加AgNO3溶液,如果产生白色沉淀,则证明C实验所加BaCl2溶液过量。你认为该同学的做法对吗?请你作出判断并说明理由。___________。
29.(6分)为测定石灰石样品中碳酸钙含量,某小组同学在一定质最的样品中加入足量稀盐酸,利用生成CO2的质量来测定(忽略稀盐酸挥发的影响)。
(1)小科用图甲装置实验,通过测定反应前后D装置质量的变化来得到CO2质量。为了避免水蒸气对实验的影响,使测最结果更准确,装置C中应装入______(填试剂名称)。
(2)小明用图乙装置实验,通过测定反应前后装置总质量的变化来得到CO2质量。他用碱石灰做干燥剂,请判断这种做法是否合理并说明理由。______
(3)实验时。正确选择干燥剂后,两装置均可通过左侧导管鼓入某种气体一段时间,来进一步减小误差。下列操作可行的是______。
选项 实验装置 反应开始前鼓入的气体 反应结束后鼓入的气体
A 甲 氮气 氮气
B 甲 干燥空气 干燥空气
C 乙 氮气 氮气
D 乙 干燥空气 干燥空气
四、计算题(共8分)
30.(4分)某实验中学在市场上买了一箱含一定量NaCl的烧碱用于学生实验,周晓同学取该烧碱样品10.3g完全溶于89.7g水中,再向所得溶液中慢慢滴入溶质质量分数为7.3%的稀盐酸,在实验过程中,溶液的pH与滴入稀盐酸的质量关系如图所示。
(1)该烧碱样品中,NaCl的质量分数为 (结果精确到0.1%)。
(2)b点时,溶液中含有的溶质是 。
(3)求a点时,溶液中溶质的质量分数。(写出计算过程)
31.(4分)向含有CuCl2和HCI的100克混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液200克,参加反应的NaOH溶液质量与生成沉淀Cu(OH)2的质量关系如图,据图回答:
(1)P点溶液中的溶质是 。
(2)m1为多少克?(列式计算)
(3)混合溶液与NaOH溶液恰好完全反应时,溶液中的溶质质量分数是多少?(保留小数点后一位)
参考答案
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.D 2.B 3.B 4.A 5.C 6.B 7.D 8.C 9.D 10.D
11.C 12.A 13.B 14.C 15.C 16.A 17.B 18.B 19.D 20.A
二、填空题(共26分)
21.(3分)(1)2NaOH+CO2=Na2CO3+H2O;浓盐酸(或浓硫酸、氢氧化钙、氧化钙等);
(2)C
22.(3分)(1)C; (2)A; (3)D
23.(4分)(1)NO3-; (2)KNO3
24.(4分)(1)CaCl2和NaCl; (2)有白色沉淀生成
25.(6分)(1)碳酸钙和碳酸钠;氯化铁;
(2)向步骤①得到的溶液中加入足量氯化钙,静置,取上层清液滴加酚酞,溶液变红色,说明含有氢氧化钠,溶液不变色,说明不含氢氧化钠
26.(6分)(1)放热; (2)碱溶液滴入酸溶液; (3)溶液变红色
三、实验探究题(每空2分,共22分)
27.(10分)(1)试管底部有气泡逸出; (2)二氧化碳溶于水;
(3)氯化钙(合理即可); (4)HCl; Na2CO3+2HCl=2NaCl+H2O+CO2↑
28.(6分)溶液呈蓝色 H2SO4+BaCl2=BaSO4↓+2HCl 错误,生成的HCl也能与AgNO3反应生成沉淀
29.(6分)浓硫酸 不合理,因为碱石灰也或吸收二氧化碳 ACD
四、计算题(共8分)
30.(4分)(1)22.3%; (2)NaCl 、HCl;
(3)×100%=7%
31.(4分)(1)NaCl和CuCl2;
(2)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量z。
CuCl2 + 2NaOH = Cu(OH)2 ↓+ 2NaCl
80 98 117
x×10% 9.8g z
x = 80g , z=11.7g。
氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以m1=40g+80g=120g
(3)M点溶液的溶质质量分数是 ≈ 8.3%
【单元检测】科学九年级(上册)测试卷(一)
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.如图食品、调味品的制作过程中,没有发生化学变化的是( )
A.豆腐发酵制臭豆腐 B.黄豆酿酱油 C.粮食酿酒 D.水果榨果汁
2.下列化学反应中,属于复分解反应的是( )
A.2H2+O22H20 B.NaCl+AgNO3=AgC1↓+NaNO3
C.Mg+2HCl=MgCl2+H2↑ D.H2CO3H2O+CO2↑
3.盐酸先生闯迷宫(如图),请你帮它选择行进路线(不发生化学反应)( )
4.衣服沾上铁锈(主要成分是Fe2O3),直接用水很难洗净。要除去白色衬衣上的铁锈,你认为比较适宜的液体是( )
A.白醋 B.酱油 C.酒精 D.洗洁精
5.氢氧化铯是一种可溶性碱,其分子式是CsOH,则下列叙述中正确的是( )
A.CsOH溶液能使紫色的石蕊变成红色
B.CsOH在水中的电离方程式为:CsOH=Cs2++20H-
C.CsOH溶液能使无色的酚酞试液变红色
D.CsOH与硫酸反应生成的盐的化学式为CsSO4
6.久置于空气中的石灰水,其表面会形成白膜。此时溶液的pH与变化前溶液的pH相比( )
A.偏大 B.偏小 C.一样 D.无法比较
7.为区别稀盐酸和稀硫酸,小强同学设计如图所示的实验方案:在每组的两支试管中分别盛放稀盐酸和稀硫酸,向同组的两支试管各滴加同种试剂。其中能达到实验目的的是( )
A B C D
8.如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是( )
A.反应结束时溶液的pH=7 B.反应前后元素的种类没有变化
C.氢氧化钠溶液中存在的粒子是Na+和OH- D.该反应的实质是H+和OH-结合生成H2O
9.对下列实验过程的评价,不正确的是( )
A.某固体加入稀盐酸,产生无色气体,该固体可能含有CO
B.某无色溶液滴入酚酞试液显红色,该溶液一定是碱性溶液
C.某溶液中滴加BaCl2溶液产生不溶于稀HNO3的白色沉淀,该溶液中不一定含有SO
D.验证烧碱部分变质,先加少量氯化钡溶液产生白色沉淀,再加无色酚酞试液呈红色
10.向H2SO4和CuS04的混合溶液中不断加入NaOH溶液,下列图像能正确表示对应关系的是( )
A B C D
11.如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质。挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响)。则滴管和烧瓶中所用试剂可能是( )
选项 甲 乙
A 稀硫酸和银块 水和硝酸铵固体
B Na2CO3溶液和稀硫酸 稀硫酸和氢氧化钠溶液
C 双氧水和MnO2 水和硝酸铵固体
D 水和氢氧化钠固体 BaCl2溶液和稀硫酸
12.电导率是衡量溶液导电能力大小的物理量,在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比。盐酸和氢氧化钠反应过程中溶液的电导率曲线如图所示,以下分析不正确的是( )
A.电导率减小可能是由于溶液中离子数量逐渐减小
B.M点时NaOH溶液与稀盐酸恰好完全反应
C.N点时溶液中的离子数大于P点
D.该实验证明溶液中始终含有带电的粒子
13.为了探究盐酸除铁锈的实验中,气体是由什么反应生成的,设计如下实验:①在两支试管中分别放入铁粉和铁锈;②分别加入等量、等浓度的稀盐酸,观察现象。针对该实验的目的,下列评价或改进正确的是( )
A.该实验步骤正确完整
B.应补充一个铁与水反应的实验
C.应补充一个铁锈与水反应的实验
D.应补充一个铁锈与水反应的实验和补充一个铁与水反应的实验
14.在碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液。该实验过程的操作如图所示,下列有关操作与目的分析均正确的是( )
A.甲中试剂瓶标签正对手心,是为了防止手被腐蚀
B.乙中将滴管伸入试管内,是为了防止试剂滴落到试管外
C.丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染
D.丙中将水缓缓倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅
15.将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是( )
A.N点时,所得溶液的pH=7
B.Q点时,所得溶液中的溶质只含有BaCl2
C.0至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O
D.P至Q段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O
16.下列各组物质能在同一溶液中大量共存的是( )
A.NaCl HCl MgSO4 Cu(NO3)2 B.AgNO3 NaCl Mg(NO3)2 NaOH
C.Ca(OH)2 NaNO3 Na2CO3 NH4CL D.HCI K2SO4 NaOH NaNO3
17.物质X与氢氧化钠溶液发生反应的化学方程式为:X+2NaOH=Y+Cu(OH)2↓,下列说法正确的是( )
A.X可能是酸 B.X和Y的相对分子质量之差为18
C.X可能是CuCl2 D.Y可能是水
18.向盛有HC1和CuCl2的混合溶液中逐滴加入NaOH溶液至过量,下列4个图像能正确反应烧杯内的某些物理量变化趋势的是( )
A.①③ B.①②④ C.②④ D.①②③
19.为探究久置氢氧化钠固体的变质情况。某小组同学进行了如图所示实验,并得出部分变质的结论。下列分析正确的是( )
A.甲溶液可以选择稀盐酸或BaCl2溶液
B.D物质可能是气体,也可能是沉淀
C.溶液B中的溶质一定只含有NaOH和甲
D.步骤Ⅲ中溶液变成红色
20.向一定质量的氯化镁溶液中滴加氢氧化钠溶液,一段时间后,改为滴加稀硫酸,所得沉淀质量随加人试剂总体积的变化趋势如图所示。下列有关说法不正确的是( )
A.a点时溶液中一定不存在Mg2+
B.b点时所加试剂一定是稀硫酸
C.c点时溶液中的溶质都是盐
D.加入试剂总体积为V1时,溶液中不存在NaOH
二、填空题(共26分)
21.(3分)归纳总结是学习化学的一种方法。莉莉整理的氢氧化钠的化学性质如图。结合此图回答下列问题。
(1)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为 。所以要密封保存。实验室须密封保存的物质还有 (填名称)。
(2)为验证X与氢氧化钠溶液的反应,应该选择的物质是 (填序号)。
A.CO2 B.HCl C.FeCl3 D.Na2CO3
22.(3分)世界是由物质组成的,请选择下列物质的序号填空:
A.干冰; B.酒精; C.消石灰; D.碳酸钠;
(1)用作中和酸性土壤的是 。
(2)用于人工降雨的是 。
(3)“侯氏联合制碱法”中的“碱”是 。
23.(4分)在我市经济开发的进程中,要坚持“开发与环保并重”。某化学课外活动小组在调查一化工厂时发现,该厂有甲、乙两个车间,排出的废水都澄清透明,经分析分别含有三种不同离子,共有K+、Ba2+、Cu2+、OH-、NO3-、CO六种离子。
(1)已知甲车间的废水明显呈碱性,则乙车间废水中含有的阴离子是 。
(2)将甲、乙两车间的废水按适当比例混合,可以变废为宝,既能使废水中的Ba2+、Cu2+、OH-、CO等离子转化为沉淀除去,又可以用上层清液来浇灌农田。清液中含有的溶质主要是 (填化学式)。
24.(4分)某同学为探究氢氧化钙的性质,进行如图甲所示实验。实验后,他向反应后的溶液中逐滴滴加Na2CO3溶液,溶液的pH值变化如图乙所示。请回答下列问题:
甲 乙
(1)m点的溶质是 (填化学式)
(2)图乙中m到n的反应过程中可观察到的现象是 。
25.(6分)有一包粉末,是CaCO3、NaOH、FeCl3、Na2CO3中的一种或几种。为确定其组成,现进行以下实验,各步骤均已充分反应。
①取一定质量的粉末,加足量水搅拌后过滤,得到白色沉淀和无色溶液。
②向步骤①得到的溶液中加入足量稀盐酸,得到无色气体和无色溶液。
(1)固体粉末中一定存在 ,一定不存在 。
(2)为确定可能含有的物质,还需做哪些实验: 。(写出简要操作、现象、结论)
26.(6分)用传感器探究氢氧化钠溶液与稀硫酸发生酸碱中和过程中温度和pH的变化,实验测定结果如图甲、乙所示。请回答:
(1)图甲表明酸和碱的反应是 反应(填“吸热”或“放热”)。
(2)图乙表明实验时将 (填“酸溶液滴入碱溶液”或“碱溶液滴人酸溶液”)中。
(3)在反应50s时的溶液中滴加酚酞试液,可观察到实验现象是 。
三、实验探究题(每空2分,共22分)
27.(10分)小红利用底部有一小孔的大试管,如图甲所示装配成一个制取CO2气体的装置。
(1)实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到 ,则说明装置气密性良好。
(2)小红将CO2通入盛有NaOH溶液的试管中,观察不到明显现象。那么CO2与NaOH是否发生反应?为此又做了实验:在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶盖振荡,发现瓶变瘪,于是认为CO2与NaOH发生了反应。小衢提出质疑,认为导致软塑料瓶变瘪的原因还有可能是 。
(3)小红从变瘪的软塑料瓶中取出少量试液置于试管中,滴入 溶液(填一种盐),观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生。
(4)要证明CO2与NaOH的反应确实已经发生,还可以加入 [物质类别与第(3)题不同的物质],并写出相应的化学方程式: 。
28.(6分)如图所示是为了验证稀硫酸化学性质所做的三个实验,回答下列问题。
(1)A实验最终能观察到的现象是___________。
(2)C实验中发生反应的化学方程式为___________。
(3)若要证明C实验所加的BaCl2溶液过量,小明的实验操作及现象是:取少量C中上层清液于试管中,滴加AgNO3溶液,如果产生白色沉淀,则证明C实验所加BaCl2溶液过量。你认为该同学的做法对吗?请你作出判断并说明理由。___________。
29.(6分)为测定石灰石样品中碳酸钙含量,某小组同学在一定质最的样品中加入足量稀盐酸,利用生成CO2的质量来测定(忽略稀盐酸挥发的影响)。
(1)小科用图甲装置实验,通过测定反应前后D装置质量的变化来得到CO2质量。为了避免水蒸气对实验的影响,使测最结果更准确,装置C中应装入______(填试剂名称)。
(2)小明用图乙装置实验,通过测定反应前后装置总质量的变化来得到CO2质量。他用碱石灰做干燥剂,请判断这种做法是否合理并说明理由。______
(3)实验时。正确选择干燥剂后,两装置均可通过左侧导管鼓入某种气体一段时间,来进一步减小误差。下列操作可行的是______。
选项 实验装置 反应开始前鼓入的气体 反应结束后鼓入的气体
A 甲 氮气 氮气
B 甲 干燥空气 干燥空气
C 乙 氮气 氮气
D 乙 干燥空气 干燥空气
四、计算题(共8分)
30.(4分)某实验中学在市场上买了一箱含一定量NaCl的烧碱用于学生实验,周晓同学取该烧碱样品10.3g完全溶于89.7g水中,再向所得溶液中慢慢滴入溶质质量分数为7.3%的稀盐酸,在实验过程中,溶液的pH与滴入稀盐酸的质量关系如图所示。
(1)该烧碱样品中,NaCl的质量分数为 (结果精确到0.1%)。
(2)b点时,溶液中含有的溶质是 。
(3)求a点时,溶液中溶质的质量分数。(写出计算过程)
31.(4分)向含有CuCl2和HCI的100克混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液200克,参加反应的NaOH溶液质量与生成沉淀Cu(OH)2的质量关系如图,据图回答:
(1)P点溶液中的溶质是 。
(2)m1为多少克?(列式计算)
(3)混合溶液与NaOH溶液恰好完全反应时,溶液中的溶质质量分数是多少?(保留小数点后一位)
参考答案
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.D 2.B 3.B 4.A 5.C 6.B 7.D 8.C 9.D 10.D
11.C 12.A 13.B 14.C 15.C 16.A 17.B 18.B 19.D 20.A
二、填空题(共26分)
21.(3分)(1)2NaOH+CO2=Na2CO3+H2O;浓盐酸(或浓硫酸、氢氧化钙、氧化钙等);
(2)C
22.(3分)(1)C; (2)A; (3)D
23.(4分)(1)NO3-; (2)KNO3
24.(4分)(1)CaCl2和NaCl; (2)有白色沉淀生成
25.(6分)(1)碳酸钙和碳酸钠;氯化铁;
(2)向步骤①得到的溶液中加入足量氯化钙,静置,取上层清液滴加酚酞,溶液变红色,说明含有氢氧化钠,溶液不变色,说明不含氢氧化钠
26.(6分)(1)放热; (2)碱溶液滴入酸溶液; (3)溶液变红色
三、实验探究题(每空2分,共22分)
27.(10分)(1)试管底部有气泡逸出; (2)二氧化碳溶于水;
(3)氯化钙(合理即可); (4)HCl; Na2CO3+2HCl=2NaCl+H2O+CO2↑
28.(6分)溶液呈蓝色 H2SO4+BaCl2=BaSO4↓+2HCl 错误,生成的HCl也能与AgNO3反应生成沉淀
29.(6分)浓硫酸 不合理,因为碱石灰也或吸收二氧化碳 ACD
四、计算题(共8分)
30.(4分)(1)22.3%; (2)NaCl 、HCl;
(3)×100%=7%
31.(4分)(1)NaCl和CuCl2;
(2)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量z。
CuCl2 + 2NaOH = Cu(OH)2 ↓+ 2NaCl
80 98 117
x×10% 9.8g z
x = 80g , z=11.7g。
氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以m1=40g+80g=120g
(3)M点溶液的溶质质量分数是 ≈ 8.3%
【单元检测】科学九年级(上册)测试卷(一)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
