11.1 生活中常见的盐(学案)-初中化学人教版九年级下册(有答案)
文档属性
| 名称 | 11.1 生活中常见的盐(学案)-初中化学人教版九年级下册(有答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 91.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-03 00:00:00 | ||
图片预览


文档简介
第十一单元 盐 化肥
课题1 生活中常见的盐
学习目标
1.知道氯化钠、碳酸钠、碳酸氢钠和碳酸钙的性质及主要用途。
2.学会粗盐提纯和鉴定碳酸根离子的方法。
3.知道复分解反应的特点,会根据发生复分解反应的条件判断酸、碱、盐间能否发生复分解反应。
学习要点
1.重点:
(1)对碳酸盐的特性的认识。
(2)复分解反应概念的形成。
(3)粗盐的提纯
2.难点:复分解反应发生条件的判断。
基础梳理
一、氯化钠(食盐)
1、 食盐氯化钠的用途、分布
通过阅读课本P72掌握下列内容:
(1)化学中的盐是指一类组成里含有 离子和 离子的化合物。
(2)氯化钠是盐的一种,它的俗名是 ,是一种 色颗粒状的固体,有 味,易溶于水。
(3)氯化钠的用途:
生活方面, ;
医疗方面, ;
工业方面, ;
农业方面, 。
(4)氯化钠的分布:在自然界中分布很广,除海水外, 、 、
也是氯化钠的来源。
2、海水晒盐
海水 粗盐
3、粗盐提纯
思考:怎样将粗盐中的不溶性杂质(泥沙)除去,达到提纯的目的呢
(1)实验中需要的仪器有 。
(2)操作步骤是 。
(3)反思交流:在溶解、过滤、蒸发、转移中都用到了玻璃棒,它的作用分别是什么
。
二、几种常见的盐
1、碳酸钙
(1)用途: 。
(2)性质
①物理性质: 。
②化学性质:
a. 。
b. 。
2、碳酸钠和碳酸氢钠
结合课本P73,完成下表
活动一:认识碳酸钠和碳酸氢钠的用途
碳酸钠 碳酸氢钠
化学式
俗名
用途
活动二:探究碳酸钠、碳酸氢钠的性质
(1)探究碳酸钠和碳酸氢钠是否与盐酸发生反应
阅读课本P74,小组内完成【实验11-1】,并填写下表。
碳酸钠+盐酸 碳酸氢钠+盐酸
现象
分析
结论
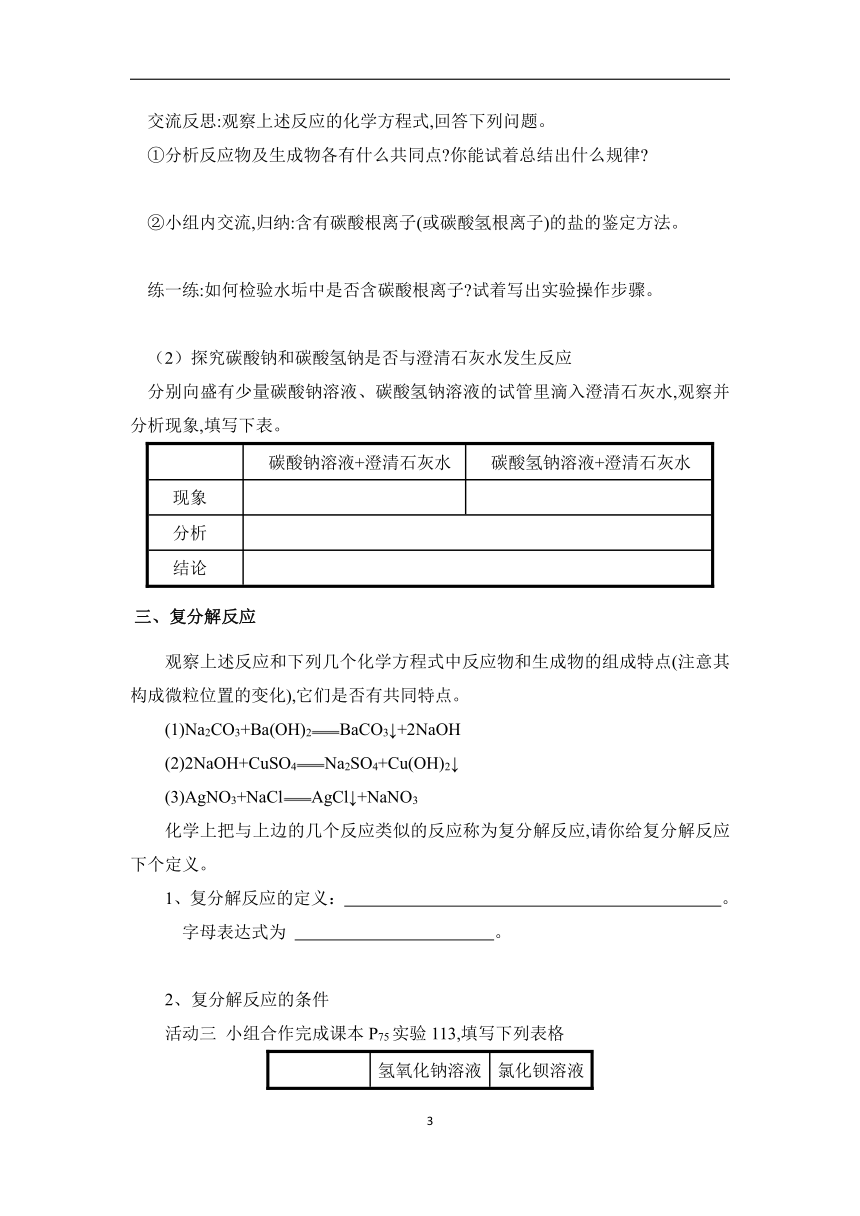
交流反思:观察上述反应的化学方程式,回答下列问题。
①分析反应物及生成物各有什么共同点 你能试着总结出什么规律
②小组内交流,归纳:含有碳酸根离子(或碳酸氢根离子)的盐的鉴定方法。
练一练:如何检验水垢中是否含碳酸根离子 试着写出实验操作步骤。
(2)探究碳酸钠和碳酸氢钠是否与澄清石灰水发生反应
分别向盛有少量碳酸钠溶液、碳酸氢钠溶液的试管里滴入澄清石灰水,观察并分析现象,填写下表。
碳酸钠溶液+澄清石灰水 碳酸氢钠溶液+澄清石灰水
现象
分析
结论
三、复分解反应
观察上述反应和下列几个化学方程式中反应物和生成物的组成特点(注意其构成微粒位置的变化),它们是否有共同特点。
(1)Na2CO3+Ba(OH)2BaCO3↓+2NaOH
(2)2NaOH+CuSO4Na2SO4+Cu(OH)2↓
(3)AgNO3+NaClAgCl↓+NaNO3
化学上把与上边的几个反应类似的反应称为复分解反应,请你给复分解反应下个定义。
1、复分解反应的定义: 。
字母表达式为 。
2、复分解反应的条件
活动三 小组合作完成课本P75实验113,填写下列表格
氢氧化钠溶液 氯化钡溶液
现象
化学方程式
请你判断:结合P114附录Ⅰ《部分酸、碱和盐的溶解性表》判断下列酸、碱、盐之间是否发生反应 并设计实验验证。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
3、盐的化学性质
活动四 小组交流,回顾总结盐都有哪些化学性质
[拓展延伸]
物质的分类
请将下列物质按照一定的分类标准进行分类。
空气、溶液、氧气、碳、铁、铝、二氧化碳、一氧化碳、水、盐酸、硫酸、氢氧化钠、氢氧化钙、氯化钠、碳酸钠
参考答案
基础梳理
一、1、(1)金属 酸根
(2)食盐 白 咸
(3)调味品、腌制食物 配制生理盐水 制取碳酸钠、氢氧化钠、氯气和盐酸 用氯化钠溶液来选种
(4)盐湖 盐井 盐矿
2、蒸发
3、(1)烧杯、玻璃棒、漏斗、蒸发皿、酒精灯、铁架台
(2)溶解、沉淀、过滤、蒸发
(3)①溶解时用玻璃棒搅拌,加速固体的溶解;
②过滤时用玻璃棒引流;
③蒸发时用玻璃棒搅拌,防止液体受热不均匀,引起液滴飞溅;
④转移固体时用玻璃棒将提纯后的食盐转移到纸上
二、
1、(1)作建筑材料、补钙剂等
(2)①白色固体,难溶于水
②a.与稀盐酸反应:CaCO3+2HClCaCl2+H2O+CO2↑
B.高温分解:CaCO3CaO+CO2↑
2、活动一:
碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
用途 工业上广泛用于玻璃、造纸、纺织和洗涤剂的生产等 焙制糕点所用的发酵粉的主要成分之一,治疗胃酸过多症的药剂,干粉灭火器的主要成分
活动二:(1)探究碳酸钠和碳酸氢钠是否与盐酸发生反应
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 固体溶解,产生大量气泡,澄清石灰水变浑浊
分析 它们都能和盐酸反应生成CO2
结论 Na2CO3+2HCl2NaCl+H2O+CO2↑NaHCO3+HClNaCl+H2O+CO2↑
交流反思:
①都是碳酸盐或碳酸氢盐跟酸的反应,都生成了二氧化碳。
②向少量样品中加入稀盐酸,有气体产生,将生成的气体通入澄清石灰水中,澄清石灰水变浑浊,则该盐含碳酸根离子(或碳酸氢根离子)。
练一练:将少量水垢放入试管中,并加入5 mL稀盐酸,将生成的气体通入澄清石灰水,观察现象。
(2)探究碳酸钠和碳酸氢钠是否与澄清石灰水发生反应
碳酸钠溶液+澄清石灰水 碳酸氢钠溶液+澄清石灰水
现象 产生白色沉淀 无现象
分析 可溶性碳酸盐与澄清石灰水反应产生白色沉淀
结论 Na2CO3+Ca(OH)2CaCO3↓+2NaOH
三、
1、在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应,叫复分解反应
AB+CDAD+CB
2、
氢氧化钠溶液 氯化钡溶液
现象 产生蓝色沉淀 产生白色沉淀
化学方程式 CuSO4+2NaOHNa2SO4+Cu(OH)2↓ CuSO4+BaCl2CuCl2+BaSO4↓
请你判断:
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸 能 不能 能 能
判断依据 生成水 没有生成水、气体或沉淀 生成气体 生成沉淀
3、(1)与金属反应,如Fe+CuSO4Cu+FeSO4;
(2)与酸反应,如CaCO3+2HClCaCl2+CO2↑+H2O;
(3)与碱溶液反应,如CuSO4+2NaOHNa2SO4+Cu(OH)2↓;
(4)与盐溶液反应,如Na2CO3+CaCl22NaCl+CaCO3↓等。
[拓展延伸]混合物:空气、溶液 单质:氧气、碳、铁、铝
氧化物:二氧化碳、一氧化碳、水 酸:盐酸、硫酸
碱:氢氧化钠、氢氧化钙 盐:氯化钠、碳酸钠
2
课题1 生活中常见的盐
学习目标
1.知道氯化钠、碳酸钠、碳酸氢钠和碳酸钙的性质及主要用途。
2.学会粗盐提纯和鉴定碳酸根离子的方法。
3.知道复分解反应的特点,会根据发生复分解反应的条件判断酸、碱、盐间能否发生复分解反应。
学习要点
1.重点:
(1)对碳酸盐的特性的认识。
(2)复分解反应概念的形成。
(3)粗盐的提纯
2.难点:复分解反应发生条件的判断。
基础梳理
一、氯化钠(食盐)
1、 食盐氯化钠的用途、分布
通过阅读课本P72掌握下列内容:
(1)化学中的盐是指一类组成里含有 离子和 离子的化合物。
(2)氯化钠是盐的一种,它的俗名是 ,是一种 色颗粒状的固体,有 味,易溶于水。
(3)氯化钠的用途:
生活方面, ;
医疗方面, ;
工业方面, ;
农业方面, 。
(4)氯化钠的分布:在自然界中分布很广,除海水外, 、 、
也是氯化钠的来源。
2、海水晒盐
海水 粗盐
3、粗盐提纯
思考:怎样将粗盐中的不溶性杂质(泥沙)除去,达到提纯的目的呢
(1)实验中需要的仪器有 。
(2)操作步骤是 。
(3)反思交流:在溶解、过滤、蒸发、转移中都用到了玻璃棒,它的作用分别是什么
。
二、几种常见的盐
1、碳酸钙
(1)用途: 。
(2)性质
①物理性质: 。
②化学性质:
a. 。
b. 。
2、碳酸钠和碳酸氢钠
结合课本P73,完成下表
活动一:认识碳酸钠和碳酸氢钠的用途
碳酸钠 碳酸氢钠
化学式
俗名
用途
活动二:探究碳酸钠、碳酸氢钠的性质
(1)探究碳酸钠和碳酸氢钠是否与盐酸发生反应
阅读课本P74,小组内完成【实验11-1】,并填写下表。
碳酸钠+盐酸 碳酸氢钠+盐酸
现象
分析
结论
交流反思:观察上述反应的化学方程式,回答下列问题。
①分析反应物及生成物各有什么共同点 你能试着总结出什么规律
②小组内交流,归纳:含有碳酸根离子(或碳酸氢根离子)的盐的鉴定方法。
练一练:如何检验水垢中是否含碳酸根离子 试着写出实验操作步骤。
(2)探究碳酸钠和碳酸氢钠是否与澄清石灰水发生反应
分别向盛有少量碳酸钠溶液、碳酸氢钠溶液的试管里滴入澄清石灰水,观察并分析现象,填写下表。
碳酸钠溶液+澄清石灰水 碳酸氢钠溶液+澄清石灰水
现象
分析
结论
三、复分解反应
观察上述反应和下列几个化学方程式中反应物和生成物的组成特点(注意其构成微粒位置的变化),它们是否有共同特点。
(1)Na2CO3+Ba(OH)2BaCO3↓+2NaOH
(2)2NaOH+CuSO4Na2SO4+Cu(OH)2↓
(3)AgNO3+NaClAgCl↓+NaNO3
化学上把与上边的几个反应类似的反应称为复分解反应,请你给复分解反应下个定义。
1、复分解反应的定义: 。
字母表达式为 。
2、复分解反应的条件
活动三 小组合作完成课本P75实验113,填写下列表格
氢氧化钠溶液 氯化钡溶液
现象
化学方程式
请你判断:结合P114附录Ⅰ《部分酸、碱和盐的溶解性表》判断下列酸、碱、盐之间是否发生反应 并设计实验验证。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
3、盐的化学性质
活动四 小组交流,回顾总结盐都有哪些化学性质
[拓展延伸]
物质的分类
请将下列物质按照一定的分类标准进行分类。
空气、溶液、氧气、碳、铁、铝、二氧化碳、一氧化碳、水、盐酸、硫酸、氢氧化钠、氢氧化钙、氯化钠、碳酸钠
参考答案
基础梳理
一、1、(1)金属 酸根
(2)食盐 白 咸
(3)调味品、腌制食物 配制生理盐水 制取碳酸钠、氢氧化钠、氯气和盐酸 用氯化钠溶液来选种
(4)盐湖 盐井 盐矿
2、蒸发
3、(1)烧杯、玻璃棒、漏斗、蒸发皿、酒精灯、铁架台
(2)溶解、沉淀、过滤、蒸发
(3)①溶解时用玻璃棒搅拌,加速固体的溶解;
②过滤时用玻璃棒引流;
③蒸发时用玻璃棒搅拌,防止液体受热不均匀,引起液滴飞溅;
④转移固体时用玻璃棒将提纯后的食盐转移到纸上
二、
1、(1)作建筑材料、补钙剂等
(2)①白色固体,难溶于水
②a.与稀盐酸反应:CaCO3+2HClCaCl2+H2O+CO2↑
B.高温分解:CaCO3CaO+CO2↑
2、活动一:
碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
用途 工业上广泛用于玻璃、造纸、纺织和洗涤剂的生产等 焙制糕点所用的发酵粉的主要成分之一,治疗胃酸过多症的药剂,干粉灭火器的主要成分
活动二:(1)探究碳酸钠和碳酸氢钠是否与盐酸发生反应
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 固体溶解,产生大量气泡,澄清石灰水变浑浊
分析 它们都能和盐酸反应生成CO2
结论 Na2CO3+2HCl2NaCl+H2O+CO2↑NaHCO3+HClNaCl+H2O+CO2↑
交流反思:
①都是碳酸盐或碳酸氢盐跟酸的反应,都生成了二氧化碳。
②向少量样品中加入稀盐酸,有气体产生,将生成的气体通入澄清石灰水中,澄清石灰水变浑浊,则该盐含碳酸根离子(或碳酸氢根离子)。
练一练:将少量水垢放入试管中,并加入5 mL稀盐酸,将生成的气体通入澄清石灰水,观察现象。
(2)探究碳酸钠和碳酸氢钠是否与澄清石灰水发生反应
碳酸钠溶液+澄清石灰水 碳酸氢钠溶液+澄清石灰水
现象 产生白色沉淀 无现象
分析 可溶性碳酸盐与澄清石灰水反应产生白色沉淀
结论 Na2CO3+Ca(OH)2CaCO3↓+2NaOH
三、
1、在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应,叫复分解反应
AB+CDAD+CB
2、
氢氧化钠溶液 氯化钡溶液
现象 产生蓝色沉淀 产生白色沉淀
化学方程式 CuSO4+2NaOHNa2SO4+Cu(OH)2↓ CuSO4+BaCl2CuCl2+BaSO4↓
请你判断:
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸 能 不能 能 能
判断依据 生成水 没有生成水、气体或沉淀 生成气体 生成沉淀
3、(1)与金属反应,如Fe+CuSO4Cu+FeSO4;
(2)与酸反应,如CaCO3+2HClCaCl2+CO2↑+H2O;
(3)与碱溶液反应,如CuSO4+2NaOHNa2SO4+Cu(OH)2↓;
(4)与盐溶液反应,如Na2CO3+CaCl22NaCl+CaCO3↓等。
[拓展延伸]混合物:空气、溶液 单质:氧气、碳、铁、铝
氧化物:二氧化碳、一氧化碳、水 酸:盐酸、硫酸
碱:氢氧化钠、氢氧化钙 盐:氯化钠、碳酸钠
2
同课章节目录
