5.1 质量守恒定律 第1课时课件—2022-2023学年九年级化学人教版上册(23张PPT)
文档属性
| 名称 | 5.1 质量守恒定律 第1课时课件—2022-2023学年九年级化学人教版上册(23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 07:19:22 | ||
图片预览







文档简介
九年级化学上册第五单元
第五单元 化学方程式
课题1 质量守恒定律
科学小故事
英国化学家波义耳的实验(1673年):
在空气中加热灼烧8两锡,等到反应停止时停止加热;
冷却后称重发现总质量增加2两。
实验结论:化学变化中物质质量会增大。
任务:探究反应前后物质的质量关系
自主学习
阅读方案一,思考下列问题:
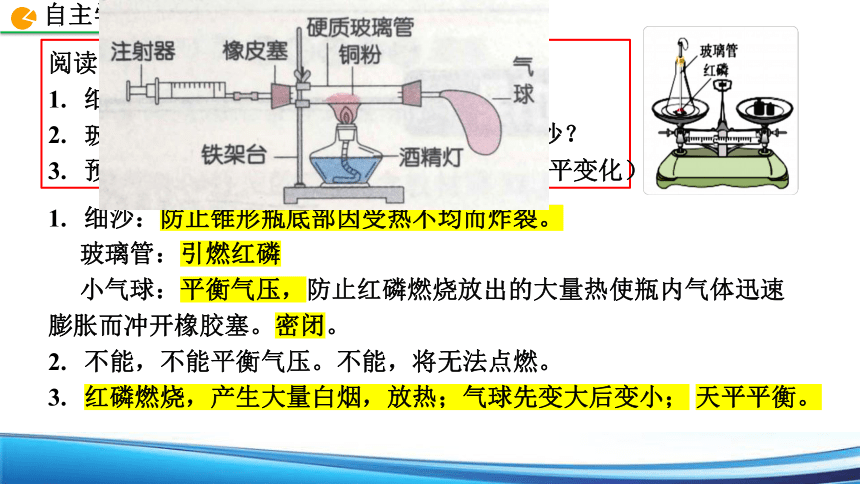
细沙、玻璃管、小气球的作用?
玻璃管能否换成玻璃棒?能否用水代替细沙?
预测实验现象(燃烧现象+气球变化+天平变化)
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)在锥形瓶口的橡胶塞上安装一根玻璃管,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
自主学习
阅读方案一,思考下列问题:
细沙、玻璃管、小气球的作用?
玻璃管能否换成玻璃棒?能否用水代替细沙?
预测实验现象? (燃烧现象+气球变化+天平变化)
细沙:防止锥形瓶底部因受热不均而炸裂。
玻璃管:引燃红磷
小气球:平衡气压,防止红磷燃烧放出的大量热使瓶内气体迅速 膨胀而冲开橡胶塞。密闭。
不能,不能平衡气压。不能,将无法点燃。
红磷燃烧,产生大量白烟,放热;气球先变大后变小; 天平平衡。
托盘天平使用注意事项
(1)称量干燥的固体药品前,应在两个托盘上各放一张干净的大小相同的纸片,后把药品放在纸片上称量;
(2)易潮解或有腐蚀性(氢氧化钠)的药品,必须放在玻璃器皿(如小烧杯、表面皿)里称量。
交流讨论
谁的质量发生了改变?
反应前称量的物质?反应后称量的物质?
反应物(红磷、氧气)的质量减少;生成物(五氧化二磷)的质量增大。
反应前称量的物质
反应后称量的物质
仪器
细沙
红磷
氧气
空气中的其他气体
仪器
细沙
五氧化二磷
剩余的红磷或氧气
空气中的其他气体
=
参加反应的红磷
参加反应的氧气
剩余的红磷或氧气
实验结论
参加反应的红磷和氧气的质量总和等于反应后生成的五氧化二磷的质量
五氧化二磷
氧气
磷
探究新知
知识点 1
质量守恒定律
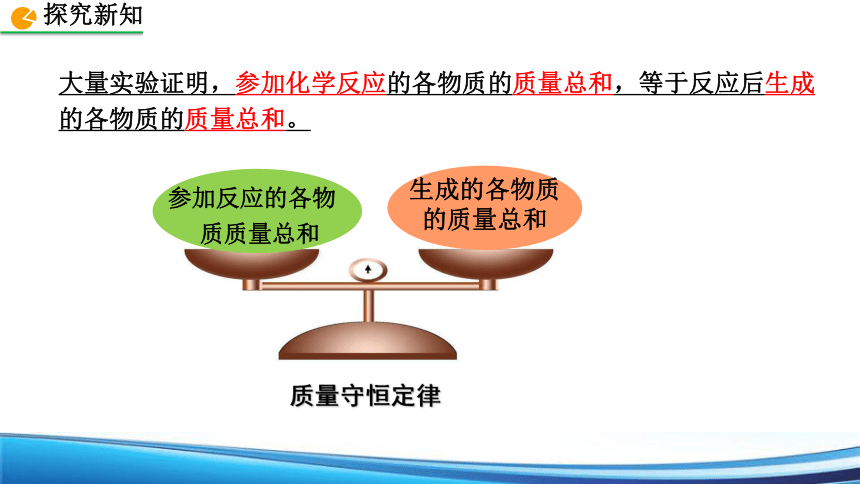
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
生成的各物质
的质量总和
参加反应的各物质质量总和
反思评价
2. 误差分析
1. 若不等装置冷却就放在天平上称量,m1和m2的大小关系?
m2<m1。因为气球受热膨胀会受到向上的浮力。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}因素
m1、m2的关系
红磷量不足
红磷过量
装置漏气
m2= m1
m2= m1
m2> m1
在波义耳实验的104年后,拉瓦锡用精确的仪器,并利用汞、密闭曲颈瓶、空气进行实验, 并通过加热, 得到红棕色固体; 然后对红棕色固体进行加热, 又变回银白色汞和一种新气体, 1977 年, 拉瓦锡将这种气体正式命名为“氧气”。在整个漫长的实验过程中, 他发现前后质量变化无法察觉, 得出化学反应前后总质量保持不变。
【设计思路】测定反应前物质总质量m1→测定反应后物质总质量m2→比较m1和m2的大小→得出结论。
课堂小结
定性→定量
探究新知
方案2
铁钉与硫酸铜溶液反应
1.实验目的:
探究反应前后物质的质量关系
2.实验原理:
3.实验装置:
铁+硫酸铜→铜+硫酸亚铁
铁:银白色s
硫酸铜:溶液呈蓝色
铜:紫红色s
硫酸亚铁:溶液呈浅绿色
探究新知
4.实验步骤:
1)在锥形瓶中加入适量稀硫酸铜溶液,塞好橡胶塞。
2)将几根铁钉用砂纸打磨干净,将盛有硫酸铜溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称的质量m1。
3)将铁钉浸到硫酸铜溶液中,观察实验现象。
4)待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和铁钉的锥形瓶放在托盘天平上称量,记录所称的质量m2。
5)比较反应前后的质量。
方案2
铁钉与硫酸铜溶液反应
砂纸:除去铁锈和杂质。
注意观察:
1.铁钉表面和溶液颜色的变化情况
2.化学反应前后质量的变化情况。
探究新知
5.实验现象:
方案2
铁钉与硫酸铜溶液反应
铁钉表面有红色固体析出,溶液由蓝色变为浅绿色;天平平衡
6.分析与结论:
反应前称量的物质
反应后称量的物质
仪器
铁钉
硫酸铜
水
空气
仪器
铜
硫酸亚铁
剩余的铁
水
=
参加反应的铁
参加反应的硫酸铜
剩余的铁
剩余的硫酸铜
剩余的硫酸铜
空气
实验结论
参加反应的铁和硫酸铜的质量总和等于反应后生成的铜和硫酸亚铁的质量
铜、硫酸亚铁
硫酸铜
铁
探究新知
知识点 1
质量守恒定律
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
生成的各物质
的质量总和
参加反应的各物质质量总和
概念分析
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
Q1:10g水受热蒸发为水蒸气,质量也为10g。这个过程是否符合质量守恒定律?
不符合,质量守恒定律适用于所有的化学反应,不适用于物理变化
Q2:4g氢气在36g氧气中燃烧生成水后,剩余4g氧气未反应,则生成水的质量为?
4g+36g-4g=32g
“参加化学反应的物质”,未参加反应的物质(剩余、杂质、催化剂)不计算在内。
学以致用
点燃ag氢气和bg氧气的混合气体,生成水的质量________(a+b)g
bg石蜡在空气中充分燃烧,生成水和二氧化碳的质量之和_______b g。
加热ag氯酸钾和bg二氧化锰一段时间,最后得到cg固体,产生氧气的质量是_____________
某化学变化可以用A+B→C+D表示,试回答下列问题:
(1)假设反应前有12g A和8g B,反应后生成10g C,A完全消耗,B剩余2g,则生成D ________g。
(2) 根据(1),欲使B完全反应,必须再加入A________g。
≤
>
(a+b-c)g
8
4
做题方法:
1.写出反应表达式
2.标出参加反应的质量
微观解释
Q:为什么所有的反应都遵守质量守恒定律?以H2+O2点燃H2O为例,分析原子种类数目质量、元素种类质量、物质质量是否改变?分子种类、物质种类是否改变?
?
原
子
种类
数目
质量
不变
元
素
种类
质量
不变
物质的总质量不变
(化学反应中)
质量守恒定律的微观解释
挑战:分子的数目、元素的化合价如何变化?
归纳总结
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
物质总质量
1.AgNO3固体见光或受热分解,故保存在棕色瓶中,AgNO3见光分解时产生一种有刺激性气味的气体,该气体可能是( )
A.H2S B.SO2 C.N2 D.NO2
2.某物质在纯氧中燃烧生成了氮气和水蒸气,该物质一定含有的元素是_____,可能含有的元素是_____。
化学反应中:
6不变,2变,2可能变
D
N、H
O
做题方法:
1.写出反应表达式,未知物写为X
2.标出反应前后的元素
依据:化学变化中,元素种类不变。
巩固练习
依据:化学变化中,元素种类、质量不变。
3.把一定质量的纯净物A和40g的氧气在一定条件下充分反应,当氧气反应完时,可生成44g二氧化碳和9g水。
(1)参加反应的A物质的质量是_____;
(2)A物质由___________元素组成,各元素的质量比为_____。
13g
碳、氢
12:1
做题方法:
1.写出反应表达式
2.标出参加反应的质量
课堂小结
质量守恒定律
What
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和
Who
Why
参加化学反应的各物质和反应后生成的各物质
原子的种类、数目、质量都不变
科学方法:定性→定性+定量
基本观念:守恒观
思维方式:宏观辨识与微观探析
第五单元 化学方程式
课题1 质量守恒定律
科学小故事
英国化学家波义耳的实验(1673年):
在空气中加热灼烧8两锡,等到反应停止时停止加热;
冷却后称重发现总质量增加2两。
实验结论:化学变化中物质质量会增大。
任务:探究反应前后物质的质量关系
自主学习
阅读方案一,思考下列问题:
细沙、玻璃管、小气球的作用?
玻璃管能否换成玻璃棒?能否用水代替细沙?
预测实验现象(燃烧现象+气球变化+天平变化)
1)在底部铺有细沙的锥形瓶中放一小堆干燥的红磷;
2)在锥形瓶口的橡胶塞上安装一根玻璃管,在导管上端系一气球,使玻璃管下端能与红磷接触;
3)将锥形瓶和玻璃管放在托盘天平上称量,记录所称的质量m1;
4)取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,将红磷引燃;
5)待锥形瓶冷却后,再将其放在天平上称量,记录所称的质量m2。
自主学习
阅读方案一,思考下列问题:
细沙、玻璃管、小气球的作用?
玻璃管能否换成玻璃棒?能否用水代替细沙?
预测实验现象? (燃烧现象+气球变化+天平变化)
细沙:防止锥形瓶底部因受热不均而炸裂。
玻璃管:引燃红磷
小气球:平衡气压,防止红磷燃烧放出的大量热使瓶内气体迅速 膨胀而冲开橡胶塞。密闭。
不能,不能平衡气压。不能,将无法点燃。
红磷燃烧,产生大量白烟,放热;气球先变大后变小; 天平平衡。
托盘天平使用注意事项
(1)称量干燥的固体药品前,应在两个托盘上各放一张干净的大小相同的纸片,后把药品放在纸片上称量;
(2)易潮解或有腐蚀性(氢氧化钠)的药品,必须放在玻璃器皿(如小烧杯、表面皿)里称量。
交流讨论
谁的质量发生了改变?
反应前称量的物质?反应后称量的物质?
反应物(红磷、氧气)的质量减少;生成物(五氧化二磷)的质量增大。
反应前称量的物质
反应后称量的物质
仪器
细沙
红磷
氧气
空气中的其他气体
仪器
细沙
五氧化二磷
剩余的红磷或氧气
空气中的其他气体
=
参加反应的红磷
参加反应的氧气
剩余的红磷或氧气
实验结论
参加反应的红磷和氧气的质量总和等于反应后生成的五氧化二磷的质量
五氧化二磷
氧气
磷
探究新知
知识点 1
质量守恒定律
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
生成的各物质
的质量总和
参加反应的各物质质量总和
反思评价
2. 误差分析
1. 若不等装置冷却就放在天平上称量,m1和m2的大小关系?
m2<m1。因为气球受热膨胀会受到向上的浮力。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}因素
m1、m2的关系
红磷量不足
红磷过量
装置漏气
m2= m1
m2= m1
m2> m1
在波义耳实验的104年后,拉瓦锡用精确的仪器,并利用汞、密闭曲颈瓶、空气进行实验, 并通过加热, 得到红棕色固体; 然后对红棕色固体进行加热, 又变回银白色汞和一种新气体, 1977 年, 拉瓦锡将这种气体正式命名为“氧气”。在整个漫长的实验过程中, 他发现前后质量变化无法察觉, 得出化学反应前后总质量保持不变。
【设计思路】测定反应前物质总质量m1→测定反应后物质总质量m2→比较m1和m2的大小→得出结论。
课堂小结
定性→定量
探究新知
方案2
铁钉与硫酸铜溶液反应
1.实验目的:
探究反应前后物质的质量关系
2.实验原理:
3.实验装置:
铁+硫酸铜→铜+硫酸亚铁
铁:银白色s
硫酸铜:溶液呈蓝色
铜:紫红色s
硫酸亚铁:溶液呈浅绿色
探究新知
4.实验步骤:
1)在锥形瓶中加入适量稀硫酸铜溶液,塞好橡胶塞。
2)将几根铁钉用砂纸打磨干净,将盛有硫酸铜溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称的质量m1。
3)将铁钉浸到硫酸铜溶液中,观察实验现象。
4)待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和铁钉的锥形瓶放在托盘天平上称量,记录所称的质量m2。
5)比较反应前后的质量。
方案2
铁钉与硫酸铜溶液反应
砂纸:除去铁锈和杂质。
注意观察:
1.铁钉表面和溶液颜色的变化情况
2.化学反应前后质量的变化情况。
探究新知
5.实验现象:
方案2
铁钉与硫酸铜溶液反应
铁钉表面有红色固体析出,溶液由蓝色变为浅绿色;天平平衡
6.分析与结论:
反应前称量的物质
反应后称量的物质
仪器
铁钉
硫酸铜
水
空气
仪器
铜
硫酸亚铁
剩余的铁
水
=
参加反应的铁
参加反应的硫酸铜
剩余的铁
剩余的硫酸铜
剩余的硫酸铜
空气
实验结论
参加反应的铁和硫酸铜的质量总和等于反应后生成的铜和硫酸亚铁的质量
铜、硫酸亚铁
硫酸铜
铁
探究新知
知识点 1
质量守恒定律
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
生成的各物质
的质量总和
参加反应的各物质质量总和
概念分析
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
Q1:10g水受热蒸发为水蒸气,质量也为10g。这个过程是否符合质量守恒定律?
不符合,质量守恒定律适用于所有的化学反应,不适用于物理变化
Q2:4g氢气在36g氧气中燃烧生成水后,剩余4g氧气未反应,则生成水的质量为?
4g+36g-4g=32g
“参加化学反应的物质”,未参加反应的物质(剩余、杂质、催化剂)不计算在内。
学以致用
点燃ag氢气和bg氧气的混合气体,生成水的质量________(a+b)g
bg石蜡在空气中充分燃烧,生成水和二氧化碳的质量之和_______b g。
加热ag氯酸钾和bg二氧化锰一段时间,最后得到cg固体,产生氧气的质量是_____________
某化学变化可以用A+B→C+D表示,试回答下列问题:
(1)假设反应前有12g A和8g B,反应后生成10g C,A完全消耗,B剩余2g,则生成D ________g。
(2) 根据(1),欲使B完全反应,必须再加入A________g。
≤
>
(a+b-c)g
8
4
做题方法:
1.写出反应表达式
2.标出参加反应的质量
微观解释
Q:为什么所有的反应都遵守质量守恒定律?以H2+O2点燃H2O为例,分析原子种类数目质量、元素种类质量、物质质量是否改变?分子种类、物质种类是否改变?
?
原
子
种类
数目
质量
不变
元
素
种类
质量
不变
物质的总质量不变
(化学反应中)
质量守恒定律的微观解释
挑战:分子的数目、元素的化合价如何变化?
归纳总结
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
物质总质量
1.AgNO3固体见光或受热分解,故保存在棕色瓶中,AgNO3见光分解时产生一种有刺激性气味的气体,该气体可能是( )
A.H2S B.SO2 C.N2 D.NO2
2.某物质在纯氧中燃烧生成了氮气和水蒸气,该物质一定含有的元素是_____,可能含有的元素是_____。
化学反应中:
6不变,2变,2可能变
D
N、H
O
做题方法:
1.写出反应表达式,未知物写为X
2.标出反应前后的元素
依据:化学变化中,元素种类不变。
巩固练习
依据:化学变化中,元素种类、质量不变。
3.把一定质量的纯净物A和40g的氧气在一定条件下充分反应,当氧气反应完时,可生成44g二氧化碳和9g水。
(1)参加反应的A物质的质量是_____;
(2)A物质由___________元素组成,各元素的质量比为_____。
13g
碳、氢
12:1
做题方法:
1.写出反应表达式
2.标出参加反应的质量
课堂小结
质量守恒定律
What
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和
Who
Why
参加化学反应的各物质和反应后生成的各物质
原子的种类、数目、质量都不变
科学方法:定性→定性+定量
基本观念:守恒观
思维方式:宏观辨识与微观探析
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
