5.1 质量守恒定律 第2课时课件—2022-2023学年九年级化学人教版上册(共20张PPT)
文档属性
| 名称 | 5.1 质量守恒定律 第2课时课件—2022-2023学年九年级化学人教版上册(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 07:20:08 | ||
图片预览







文档简介
(共20张PPT)
九年级化学上册第五单元
第五单元 化学方程式
课题1 质量守恒定律
探究新知
1.实验目的:
验证质量守恒定律
2.实验原理:
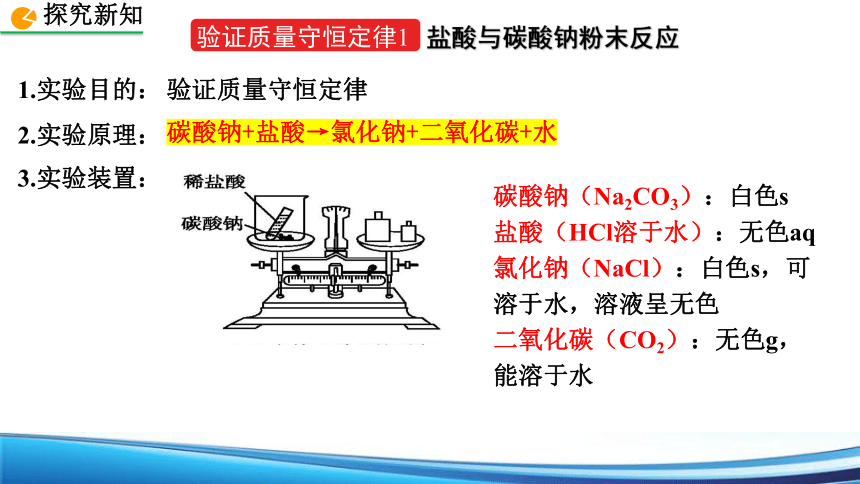
验证质量守恒定律1
盐酸与碳酸钠粉末反应
3.实验装置:
碳酸钠+盐酸→氯化钠+二氧化碳+水
碳酸钠(Na2CO3):白色s
盐酸(HCl溶于水):无色aq
氯化钠(NaCl):白色s,可溶于水,溶液呈无色
二氧化碳(CO2):无色g,能溶于水
探究新知
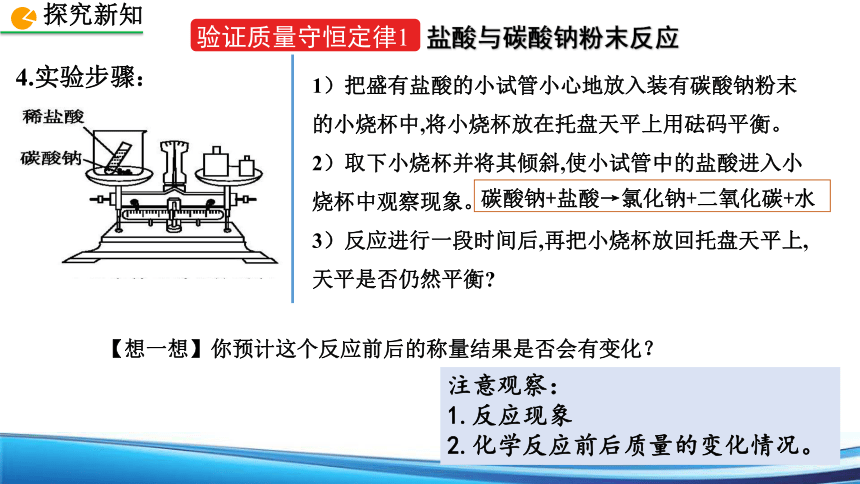
1)把盛有盐酸的小试管小心地放入装有碳酸钠粉末的小烧杯中,将小烧杯放在托盘天平上用砝码平衡。
2)取下小烧杯并将其倾斜,使小试管中的盐酸进入小烧杯中观察现象。
3)反应进行一段时间后,再把小烧杯放回托盘天平上,天平是否仍然平衡
验证质量守恒定律1
盐酸与碳酸钠粉末反应
4.实验步骤:
【想一想】你预计这个反应前后的称量结果是否会有变化?
碳酸钠+盐酸→氯化钠+二氧化碳+水
注意观察:
1.反应现象
2.化学反应前后质量的变化情况。
探究新知
1)把盛有盐酸的小试管小心地放入装有碳酸钠粉末的小烧杯中,将小烧杯放在托盘天平上用砝码平衡。
2)取下小烧杯并将其倾斜,使小试管中的盐酸进入小烧杯中观察现象。
3)反应进行一段时间后,再把小烧杯放回托盘天平上,天平是否仍然平衡
产生大量气泡,质量变小。
验证质量守恒定律1
盐酸与碳酸钠粉末反应
Q2:若装置不变,如何改变反应原理以验证质量守恒定律?
遵守。不能,产生的气体会逸散到空气中。
4.实验步骤:
Q1:该反应遵守质量守恒定律吗?该实验可以验证质量守恒定律吗?为什么
Q3:若反应原理不变,如何改进实验装置以验证质量守恒定律?
碳酸钠+盐酸→氯化钠+二氧化碳+水
铁+硫酸铜→铜+硫酸亚铁
形成密闭体系。
探究新知
待完全反应后,将装置置于天平上称量,所得数据较反应前的小。若整个操作过程无差错,可能原因是什么?
气球变大后,受到竖直向上的浮力。
反应现象:
验证质量守恒定律1
盐酸与碳酸钠粉末反应
锥形瓶内产生大量气泡,气球变大
5.装置改进
思路:形成密闭体系。
碳酸钠
探究新知
1.实验目的:
验证质量守恒定律
2.实验原理:
验证质量守恒定律2
镁条燃烧
3.实验装置:
银白色,s 白色,固体
镁 + 氧气 氧化镁
点燃
注意观察:
1.燃烧现象(3方面)
2.化学反应前后质量的变化情况。
探究新知
1)取一根用砂纸打磨干净的长镁条和1个石棉网,将它们一起放在托盘天平上称量,记录所称的质量。
2)在石棉网上方将镁条点燃,观察现象。
3)将镁条燃烧后的产物与石棉网一起放在托盘天平上称量,比较反应前后的质量。
镁条燃烧,发出耀眼白光,放热,生成白色固体。质量变大。
验证质量守恒定律2
镁条燃烧
遵守。不能,参加反应的气体没有计算在内。
4.实验步骤:
Q:该反应遵守质量守恒定律吗?该实验可以验证质量守恒定律吗?为什么?
挑战:该实验会不会出现其他结果,为什么?
有氧气参与,质量增加;生成白烟,质量减少。
探究新知
化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1) 同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。你认为出现这样实验结果的原因可能是:___________________________________。
(2)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作:____________________________________________________________________
现象与结论:____________________________________________________________________【反思与交流】空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_______________________________________________________
反应生成的氧化镁部分扩散到空气中
氧气比氮气活泼。
取适量黄色固体于试管中,向试管中加入适量水,在试管口放湿润的红色石蕊试纸
湿润的红色石蕊试纸变蓝色,说明黄色固体是氮化镁
探究新知
1.探究质量守恒定律的一般思路:测定反应前物质总质量m1→测定反应后物质总质量m2→比较m1和m2的大小→得出结论。
2.设计实验验证质量守恒定律时,若反应中有气体参加或生成,必须在密闭容器中进行;无气体参加或生成的反应可以在密闭容器中进行,也可以在敞口容器中进行。
小结
巩固练习
(判断未知物质的元素组成)某纯净物在9.6g氧气中恰好完全燃烧,生成8.8g CO2和5.4g H2O,下列说法正确的是( )
该纯净物只含有两种元素
该纯净物中一定含有碳、氢元素,可能含有氧元素
该纯净物中一定含有碳、氢、氧元素
无法确定
C
探究新知
Q1:如何表示反应:氢气和氧气点燃生成水?可提供哪些信息?能否反映质量守恒定律?
反应物、生成物、反应条件,不能反映质量守恒定律。
文字表达式: 氢气+氧气水; 符号表达式:H2+O2H2O
化学
Q2:化学可提供哪些信息?如何读?
反应物:氢气氧气;生成物:水;反应条件:点燃
分子个数比——氢分子个数:氧分子个数:水分子个数=2:1:2
物质质量比——氢气质量:氧气质量:水质量=4:32:36=1:8:9
探究新知
Q2:化学可提供哪些信息?如何读?
反应物:氢气氧气;生成物:水;反应条件:点燃
分子个数比——氢分子个数:氧分子个数:水分子个数=2:1:2
物质质量比——氢气质量:氧气质量:水质量=4:32:36=1:8:9
氢气与氧气在点燃的条件下反应生成水
2个氢分子和1个氧分子反应生成2个水分子
每4份质量的氢气与32份质量的氧气完全反应,生成 36份质量的水
探究新知
知识点
化学方程式
1.定义:
用化学式来表示化学反应的式子(等号两边原子个数、种类相等)
3.读法:
2.意义:
碳与氧气在点燃的条件下反应生成二氧化碳(宏观)
1个碳原子和1个氧分子反应生成1个二氧化碳分子(微观)
每12份质量的碳与32份质量的氧气完全反应,生成 44份质量的二氧化碳(质量)
表明反应物、生成物、反应条件
表明各粒子个数比(系数比)
表明各物质的质量比(系数×Mr或Ar)
“+”读“和”;“=”读“反应生成”;宏观时反应条件要读出。
学以致用
2.关于化学方程式的描述正确的是( )
A: 甲烷加氧气在点燃等于二氧化碳和水
B: 1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C: 1个甲烷分子和2个氧气分子反应生成1个二氧化碳分子和2个水分子
D: 1份质量的甲烷和2份质量的氧气在点燃条件下,生成1份质量的二氧化碳和2份质量的水
E:甲烷、氧气、二氧化碳、水的质量比为16:32:44:18
1.从化学方程式可知反应条件是________,反应物为________ ;还可知物质的质量比,即________份质量的铁与________份质量的氧气恰好完全反应,生成________份质量的四氧化三铁。
点燃
铁和氧气
168
64
232
C
学以致用
3.根据化学方程式的描述正确的是( )
水是由氢元素和氧元素组成的
水是由氧气和氢气组成的
反应前后氢元素的化合价没有发生变化
反应前后氧原子和氢原子的数目没有变化
反应前后氧原子的质子数不变
水分子是由两个氢原子和一个氧原子构成的
反应前后物质的总质量不变
参加反应的水和生成氧气的微粒数目之比是2:1
ADEGH
学以致用
B
4. (质量守恒定律在化学方程式中的应用)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该反应的化学方程式为C2H8N2 + 2N2O4 == 2X↑+ 3N2↑+ 4H2O↑,下列说法正确的( )
A.X的化学式为CO B.偏二甲肼中氮元素的质量分数46.7%
C.该反应属于分解反应 D.生成N2和 H2O的质量比为14:9
学以致用
B
5. (质量守恒定律在化学方程式中的应用)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该反应的化学方程式为C2H8N2 + 2N2O4 == 2X↑+ 3N2↑+ 4H2O↑,下列说法正确的( )
A.X的化学式为CO B.偏二甲肼中氮元素的质量分数46.7%
C.该反应属于分解反应 D.生成N2和 H2O的质量比为14:9
4. (质量守恒定律在化学方程式中的应用)交警通常用一种“酒精检测仪”检查司机呼出的气体中的酒精含量是否超标,其反应原理为C2H5OH + 4CrO3 + 6H2SO4 == 2X + 2CO2↑+ 9H2O,反应中红色的CrO3 转变为绿色的化合物X,则X的化学式为__________
Cr2(SO4)3
默写内容
写出下列化学方程式:①红磷燃烧②铁和硫酸铜溶液反应③碳酸钠和盐酸反应④镁燃烧
以①为原理探究质量守恒定律的实验中:①气球的作用②细沙的作用③玻璃管的作用④实验现象
以②为原理探究质量守恒定律的实验中:①铁钉使用前要____,目的是____。②实验现象
质量守恒定律的①内容②微观解释③622
以③为原理验证质量守恒定律的实验中:①实验现象②____(“能”或“不能”)验证质量守恒定律,原因是_______
以④为原理验证质量守恒定律的实验中:①实验现象②____(“能”或“不能”)验证质量守恒定律,原因是_______
按顺序说出的三种读法
九年级化学上册第五单元
第五单元 化学方程式
课题1 质量守恒定律
探究新知
1.实验目的:
验证质量守恒定律
2.实验原理:
验证质量守恒定律1
盐酸与碳酸钠粉末反应
3.实验装置:
碳酸钠+盐酸→氯化钠+二氧化碳+水
碳酸钠(Na2CO3):白色s
盐酸(HCl溶于水):无色aq
氯化钠(NaCl):白色s,可溶于水,溶液呈无色
二氧化碳(CO2):无色g,能溶于水
探究新知
1)把盛有盐酸的小试管小心地放入装有碳酸钠粉末的小烧杯中,将小烧杯放在托盘天平上用砝码平衡。
2)取下小烧杯并将其倾斜,使小试管中的盐酸进入小烧杯中观察现象。
3)反应进行一段时间后,再把小烧杯放回托盘天平上,天平是否仍然平衡
验证质量守恒定律1
盐酸与碳酸钠粉末反应
4.实验步骤:
【想一想】你预计这个反应前后的称量结果是否会有变化?
碳酸钠+盐酸→氯化钠+二氧化碳+水
注意观察:
1.反应现象
2.化学反应前后质量的变化情况。
探究新知
1)把盛有盐酸的小试管小心地放入装有碳酸钠粉末的小烧杯中,将小烧杯放在托盘天平上用砝码平衡。
2)取下小烧杯并将其倾斜,使小试管中的盐酸进入小烧杯中观察现象。
3)反应进行一段时间后,再把小烧杯放回托盘天平上,天平是否仍然平衡
产生大量气泡,质量变小。
验证质量守恒定律1
盐酸与碳酸钠粉末反应
Q2:若装置不变,如何改变反应原理以验证质量守恒定律?
遵守。不能,产生的气体会逸散到空气中。
4.实验步骤:
Q1:该反应遵守质量守恒定律吗?该实验可以验证质量守恒定律吗?为什么
Q3:若反应原理不变,如何改进实验装置以验证质量守恒定律?
碳酸钠+盐酸→氯化钠+二氧化碳+水
铁+硫酸铜→铜+硫酸亚铁
形成密闭体系。
探究新知
待完全反应后,将装置置于天平上称量,所得数据较反应前的小。若整个操作过程无差错,可能原因是什么?
气球变大后,受到竖直向上的浮力。
反应现象:
验证质量守恒定律1
盐酸与碳酸钠粉末反应
锥形瓶内产生大量气泡,气球变大
5.装置改进
思路:形成密闭体系。
碳酸钠
探究新知
1.实验目的:
验证质量守恒定律
2.实验原理:
验证质量守恒定律2
镁条燃烧
3.实验装置:
银白色,s 白色,固体
镁 + 氧气 氧化镁
点燃
注意观察:
1.燃烧现象(3方面)
2.化学反应前后质量的变化情况。
探究新知
1)取一根用砂纸打磨干净的长镁条和1个石棉网,将它们一起放在托盘天平上称量,记录所称的质量。
2)在石棉网上方将镁条点燃,观察现象。
3)将镁条燃烧后的产物与石棉网一起放在托盘天平上称量,比较反应前后的质量。
镁条燃烧,发出耀眼白光,放热,生成白色固体。质量变大。
验证质量守恒定律2
镁条燃烧
遵守。不能,参加反应的气体没有计算在内。
4.实验步骤:
Q:该反应遵守质量守恒定律吗?该实验可以验证质量守恒定律吗?为什么?
挑战:该实验会不会出现其他结果,为什么?
有氧气参与,质量增加;生成白烟,质量减少。
探究新知
化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1) 同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。你认为出现这样实验结果的原因可能是:___________________________________。
(2)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作:____________________________________________________________________
现象与结论:____________________________________________________________________【反思与交流】空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_______________________________________________________
反应生成的氧化镁部分扩散到空气中
氧气比氮气活泼。
取适量黄色固体于试管中,向试管中加入适量水,在试管口放湿润的红色石蕊试纸
湿润的红色石蕊试纸变蓝色,说明黄色固体是氮化镁
探究新知
1.探究质量守恒定律的一般思路:测定反应前物质总质量m1→测定反应后物质总质量m2→比较m1和m2的大小→得出结论。
2.设计实验验证质量守恒定律时,若反应中有气体参加或生成,必须在密闭容器中进行;无气体参加或生成的反应可以在密闭容器中进行,也可以在敞口容器中进行。
小结
巩固练习
(判断未知物质的元素组成)某纯净物在9.6g氧气中恰好完全燃烧,生成8.8g CO2和5.4g H2O,下列说法正确的是( )
该纯净物只含有两种元素
该纯净物中一定含有碳、氢元素,可能含有氧元素
该纯净物中一定含有碳、氢、氧元素
无法确定
C
探究新知
Q1:如何表示反应:氢气和氧气点燃生成水?可提供哪些信息?能否反映质量守恒定律?
反应物、生成物、反应条件,不能反映质量守恒定律。
文字表达式: 氢气+氧气水; 符号表达式:H2+O2H2O
化学
Q2:化学可提供哪些信息?如何读?
反应物:氢气氧气;生成物:水;反应条件:点燃
分子个数比——氢分子个数:氧分子个数:水分子个数=2:1:2
物质质量比——氢气质量:氧气质量:水质量=4:32:36=1:8:9
探究新知
Q2:化学可提供哪些信息?如何读?
反应物:氢气氧气;生成物:水;反应条件:点燃
分子个数比——氢分子个数:氧分子个数:水分子个数=2:1:2
物质质量比——氢气质量:氧气质量:水质量=4:32:36=1:8:9
氢气与氧气在点燃的条件下反应生成水
2个氢分子和1个氧分子反应生成2个水分子
每4份质量的氢气与32份质量的氧气完全反应,生成 36份质量的水
探究新知
知识点
化学方程式
1.定义:
用化学式来表示化学反应的式子(等号两边原子个数、种类相等)
3.读法:
2.意义:
碳与氧气在点燃的条件下反应生成二氧化碳(宏观)
1个碳原子和1个氧分子反应生成1个二氧化碳分子(微观)
每12份质量的碳与32份质量的氧气完全反应,生成 44份质量的二氧化碳(质量)
表明反应物、生成物、反应条件
表明各粒子个数比(系数比)
表明各物质的质量比(系数×Mr或Ar)
“+”读“和”;“=”读“反应生成”;宏观时反应条件要读出。
学以致用
2.关于化学方程式的描述正确的是( )
A: 甲烷加氧气在点燃等于二氧化碳和水
B: 1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C: 1个甲烷分子和2个氧气分子反应生成1个二氧化碳分子和2个水分子
D: 1份质量的甲烷和2份质量的氧气在点燃条件下,生成1份质量的二氧化碳和2份质量的水
E:甲烷、氧气、二氧化碳、水的质量比为16:32:44:18
1.从化学方程式可知反应条件是________,反应物为________ ;还可知物质的质量比,即________份质量的铁与________份质量的氧气恰好完全反应,生成________份质量的四氧化三铁。
点燃
铁和氧气
168
64
232
C
学以致用
3.根据化学方程式的描述正确的是( )
水是由氢元素和氧元素组成的
水是由氧气和氢气组成的
反应前后氢元素的化合价没有发生变化
反应前后氧原子和氢原子的数目没有变化
反应前后氧原子的质子数不变
水分子是由两个氢原子和一个氧原子构成的
反应前后物质的总质量不变
参加反应的水和生成氧气的微粒数目之比是2:1
ADEGH
学以致用
B
4. (质量守恒定律在化学方程式中的应用)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该反应的化学方程式为C2H8N2 + 2N2O4 == 2X↑+ 3N2↑+ 4H2O↑,下列说法正确的( )
A.X的化学式为CO B.偏二甲肼中氮元素的质量分数46.7%
C.该反应属于分解反应 D.生成N2和 H2O的质量比为14:9
学以致用
B
5. (质量守恒定律在化学方程式中的应用)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该反应的化学方程式为C2H8N2 + 2N2O4 == 2X↑+ 3N2↑+ 4H2O↑,下列说法正确的( )
A.X的化学式为CO B.偏二甲肼中氮元素的质量分数46.7%
C.该反应属于分解反应 D.生成N2和 H2O的质量比为14:9
4. (质量守恒定律在化学方程式中的应用)交警通常用一种“酒精检测仪”检查司机呼出的气体中的酒精含量是否超标,其反应原理为C2H5OH + 4CrO3 + 6H2SO4 == 2X + 2CO2↑+ 9H2O,反应中红色的CrO3 转变为绿色的化合物X,则X的化学式为__________
Cr2(SO4)3
默写内容
写出下列化学方程式:①红磷燃烧②铁和硫酸铜溶液反应③碳酸钠和盐酸反应④镁燃烧
以①为原理探究质量守恒定律的实验中:①气球的作用②细沙的作用③玻璃管的作用④实验现象
以②为原理探究质量守恒定律的实验中:①铁钉使用前要____,目的是____。②实验现象
质量守恒定律的①内容②微观解释③622
以③为原理验证质量守恒定律的实验中:①实验现象②____(“能”或“不能”)验证质量守恒定律,原因是_______
以④为原理验证质量守恒定律的实验中:①实验现象②____(“能”或“不能”)验证质量守恒定律,原因是_______
按顺序说出的三种读法
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
