2022-2023学年高一上学期高中化学人教版(2019)必修第一册1.1物质的分类(宏观)教学课件(19张ppt)
文档属性
| 名称 | 2022-2023学年高一上学期高中化学人教版(2019)必修第一册1.1物质的分类(宏观)教学课件(19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 850.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 10:22:13 | ||
图片预览





文档简介
(共25张PPT)
如何学习化学
1.学会从实验观察探究,结合实验现象进行推理
例1:小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2 .不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2.你认为小明的实验操作是___________________________。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是。他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释___________________________。
取少量沉淀于试管中,加入足量水
镁和水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行
实验一
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀、小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并伴随生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素。___________________________
取沉淀洗涤干净后,加足量稀硝酸溶解,再加硝酸银,若有白色沉淀则证明沉淀中含有氯元素
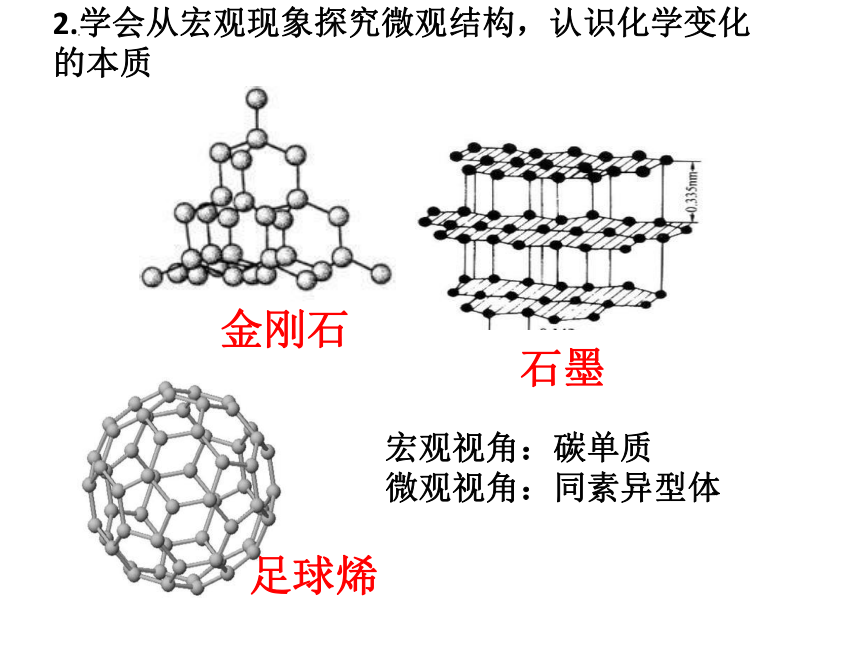
金刚石
足球烯
石墨
宏观视角:碳单质
微观视角:同素异型体
2.学会从宏观现象探究微观结构,认识化学变化的本质
3.学会用符号描述、表征
①元素符号 ②化合价 ③化学式(分子式)
4.从分类和价态的角度研究化学物质
分类
任务一:认识物质的分类
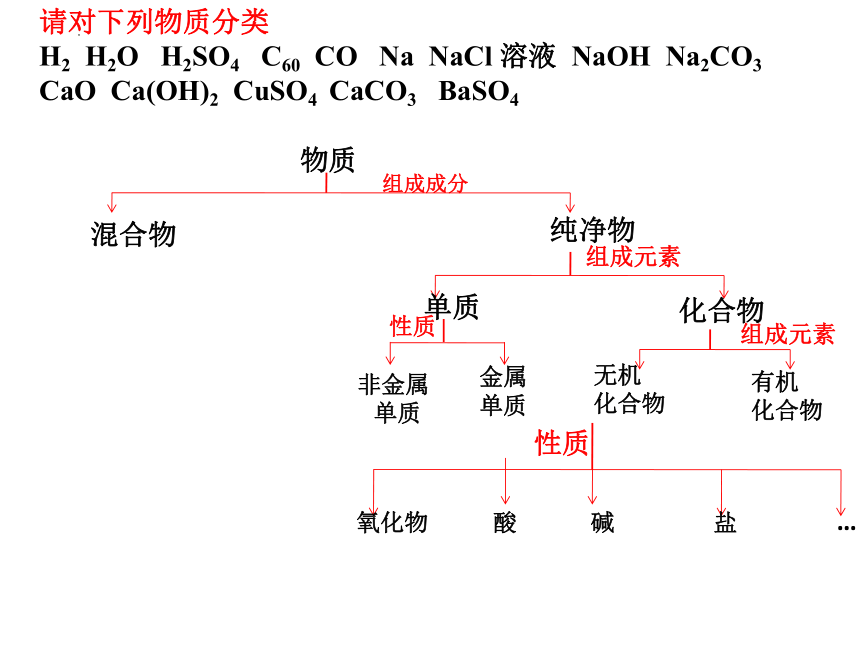
请对下列物质分类
H2 H2O H2SO4 C60 CO Na NaCl 溶液 NaOH Na2CO3 CaO Ca(OH)2 CuSO4 CaCO3 BaSO4
组成成分
物质
混合物
纯净物
单质
化合物
组成元素
性质
非金属
单质
金属
单质
无机
化合物
有机
化合物
组成元素
氧化物
酸
碱
盐
…
性质
活动1:运用分类思想将氧化物再分类
组成元素
金属氧化物
非金属氧化物
性质
不成盐氧化物
两性氧化物
酸性氧化物
碱性氧化物
氧化物
…
列举几种不同的氧化物,写出化学式?
根据氧化物组成元素及性质的差异,如何分类?
练习1:预测陌生物质的化学性质:
①SiO2是酸性氧化物,写出它可能发生的化学反应?
②Al2O3是两性氧化物,写出它可能发生的化学反应?
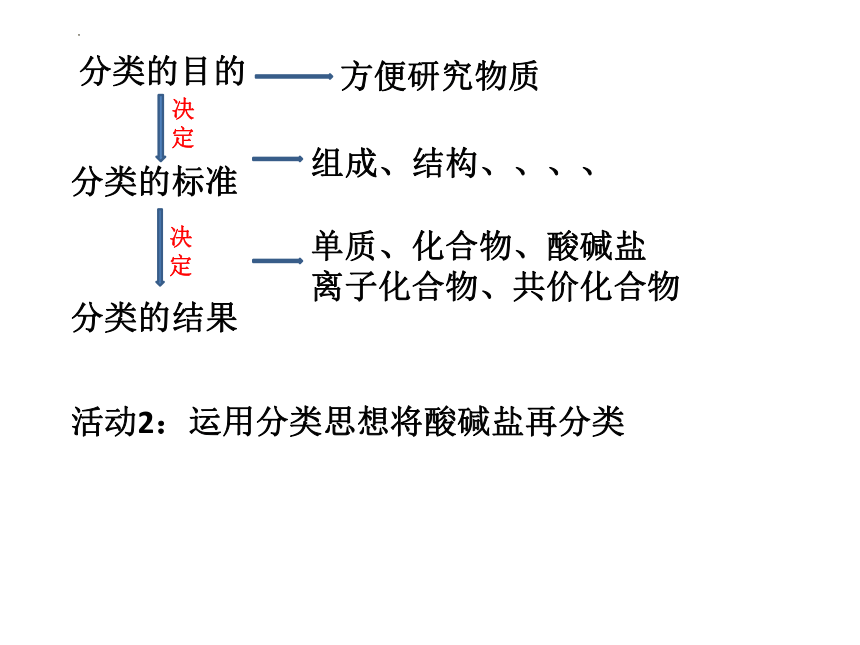
活动2:运用分类思想将酸碱盐再分类
分类的目的
方便研究物质
分类的标准
决定
分类的结果
决定
组成、结构、、、、
单质、化合物、酸碱盐
离子化合物、共价化合物
酸
含氧酸、无氧酸
是否含氧元素
一元酸、二元酸、 、、、、
可电离的H+
可溶性酸、难溶性酸
是否可溶
强酸、弱酸
是否完全电离
氧化性酸、还原性酸
化合价
例1:
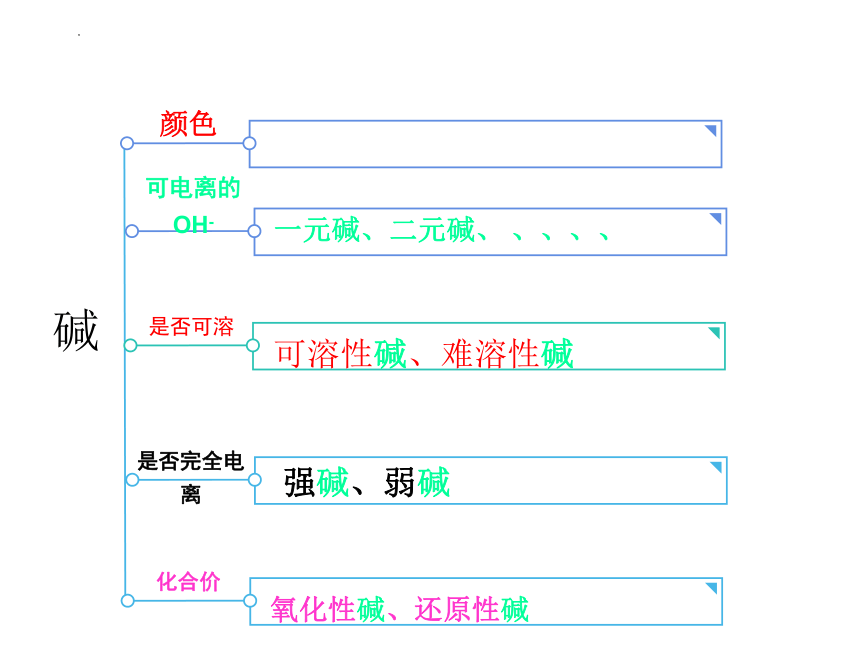
碱
一元碱、二元碱、 、、、、
可电离的OH-
可溶性碱、难溶性碱
是否可溶
强碱、弱碱
是否完全电离
氧化性碱、还原性碱
化合价
颜色
盐
含氧盐、无氧盐
是否含氧元素
酸式盐、碱式盐 、正盐、、、
可溶性盐、难溶性盐
是否可溶
钠盐、碳酸盐
阳离子
阴离子
氧化性盐、还原性盐
化合价
结合分类知识对下列盐类分类:Na2CO3、 Na2SO4、 CaCO3、 Na2SiO3、 CaSO4
例2:
活动3:“价一类”二维图可以表示元素化合价与物质类碳元素化合食别之间的关系,图中的a、b、c、d、e代表常见的含碳物质,下列说法错误的是( )
A.b和氧气反应生成c
B. c和水反应生成d
C. e可能难溶于水
D. 由a得到e至少要经过
三步反应
D
含碳化合物分类
1.类别:单质→氧化物→含氧酸→盐
2.化合价:-4→+2→+4
活动4:亚硫酸钠(Na2SO3)常用作织物的漂白剂,在食品工业上也是常见的疏松剂和氧化剂,但亚硫酸钠(Na2SO3)在空气中容易氧化,因此自然界中几乎没有稳定存在的(Na2SO3),只能通过制备来获得
任务一:寻找原料
Na2SO3
Na S O
元素组成
类别
盐
1:基于物质类别预测物质性质
含
Na
物
质
Na
Na2O
NaOH
Na2CO3
含
S
物
质
S
SO2、SO3
K2SO3 K2SO4
H2SO3、H2SO4
基于物质转化关系设计合成路线
写出以Na为原料合成Na2SO3的化学反应
任务二:认识物质的转化关系
物质制备的一般思路
原料
元素组成
物质类别
产物
元素组成
物质类别
核心元素的传递
元素种类不变,
反应规律
物质类别的转化
实际 综合考量原料来源、价格、环保、能耗、反应条件等
活动:工业上如何制备NaOH?
如何根据物质的组成对物质进行分类?
物质
混合物
纯净物
单质
化合物
非金属
单质
金属
单质
无机
化合物
有机
化合物
氧化物
酸
碱
盐
…
组成成分
组成元素
性质
性质
组成元素
性质
两性氧化物
酸性氧化物
碱性
化合
物
不成盐氧化物
性质
含氧酸、无氧酸
一元酸、二元酸
可溶性酸、不溶性酸
氧化性酸、还原性、、
组成
…
气态
固态
液态
状态
分散系粒子大小
浊液
胶体
溶液
组成成分
物质
混合物
纯净物
单质
化合物
组成元素
性质
非金属
单质
金属
单质
无机
化合物
有机
化合物
组成元素
氧化物
酸
碱
盐
…
性质
气态
固态
液态
状态
分散系粒子大小
浊液
胶体
溶液
混合物:由一种物质分散到另一种物质中形成
分散系:化学上把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中形成的混合物
10-9
10-7
单位:m
分散质颗粒大小
溶液
胶体
浊液
活动1
观察比较1:将饱和FeCl3溶液分别滴入到沸水、冷水、氢氧化钠溶液,比较溶液的变化
观察比较2:用激光笔照射上述分散系
1.胶体分散系与其他分散系本质的区别是
A.分散质粒子直径的大小
B.是否有顶达尔现象
C.能否稳定存在 D.是否透明
2下列说法不正确的是
A. FeCl3可用作净水剂,是因为氢氧化铁胶体具有吸附性
B.氢氧化铁胶粒直径在10-9 ~10-7m之间
C. FeCl3溶液转变成氢氧化铁胶体是化学变化,
氢氧化铁胶体转变成氢氧化铁沉淀是物理变化
D.氢氧化铁胶体的分散质是氢氧化铁分子,分散剂是水
学习评价
一:胶体
1.定义:分散质粒子的直径在
10-9∽10-7m的分散系
2:性质:发生丁达尔现象;表面吸附
思考1:如果胶体中胶粒不断长大,会发生怎样的变化?
沉淀
(均一稳定的混合物)
思考2:怎样的物质才能形成胶体?
分散质难溶于分散剂
任务三:认识胶体
3. 胶体的分类:
Fe(OH)3
AgI胶体
淀粉胶体
雾、云、烟
有色玻璃
Fe(OH)3
AgI胶体
混合物
气体-气体
固体-固体
液体-液体
状态
固体-液体
分散系
分散质
分散剂
10-9
10-7
单位:m
分散质颗粒大小
溶液
胶体
浊液
归纳
例3:下列各组物质中,前者是纯净物,后者是混合物的是
A 水煤气、空气 B 盐酸、甲烷
C 硫酸铜晶体、石油
D 草木灰、含铁为70%的氧化物
例4:下列说法中正确的是
A 非金属氧化物都是酸性氧化物
B 凡是酸性氧化物都可以直接和水反应生成对应的酸
C碱性氧化物都是金属氧化物
D 金属氧化物都是碱性氧化物
铜
氧化铜
氢氧化铜
碳酸铜
硫酸铜
……..
单质
氧化物
碱
盐
氯气
-------
盐酸
氯化钠
氯化钡
…..
单质
氧化物
酸
盐
有哪些反应规律
任务四:学习评价
1.写出产物中有氯化铜生成的化学反应
相互转化条件
相互转化条件
无酸条件下,反应物必须均可溶
用方程式表达CO2能发生的化学反应
实验室制取氢气
练习:金属Na长期露置空气中最后变质为Na2CO3发生的化学反应方程式
归纳:
化学是什么
如何学习化学
1.学会从实验观察探究,结合实验现象进行推理
2.学会从宏观现象探究微观结构,认识化学变化的本质
3.学会用符号描述、表征
4.从分类和价态的角度研究化学物质
在原子、分子水平上研究物质的组成、 结构、性质、转化及其应用的基础自然科学
如何学习化学
1.学会从实验观察探究,结合实验现象进行推理
例1:小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2 .不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2.你认为小明的实验操作是___________________________。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是。他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释___________________________。
取少量沉淀于试管中,加入足量水
镁和水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行
实验一
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀、小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并伴随生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素。___________________________
取沉淀洗涤干净后,加足量稀硝酸溶解,再加硝酸银,若有白色沉淀则证明沉淀中含有氯元素
金刚石
足球烯
石墨
宏观视角:碳单质
微观视角:同素异型体
2.学会从宏观现象探究微观结构,认识化学变化的本质
3.学会用符号描述、表征
①元素符号 ②化合价 ③化学式(分子式)
4.从分类和价态的角度研究化学物质
分类
任务一:认识物质的分类
请对下列物质分类
H2 H2O H2SO4 C60 CO Na NaCl 溶液 NaOH Na2CO3 CaO Ca(OH)2 CuSO4 CaCO3 BaSO4
组成成分
物质
混合物
纯净物
单质
化合物
组成元素
性质
非金属
单质
金属
单质
无机
化合物
有机
化合物
组成元素
氧化物
酸
碱
盐
…
性质
活动1:运用分类思想将氧化物再分类
组成元素
金属氧化物
非金属氧化物
性质
不成盐氧化物
两性氧化物
酸性氧化物
碱性氧化物
氧化物
…
列举几种不同的氧化物,写出化学式?
根据氧化物组成元素及性质的差异,如何分类?
练习1:预测陌生物质的化学性质:
①SiO2是酸性氧化物,写出它可能发生的化学反应?
②Al2O3是两性氧化物,写出它可能发生的化学反应?
活动2:运用分类思想将酸碱盐再分类
分类的目的
方便研究物质
分类的标准
决定
分类的结果
决定
组成、结构、、、、
单质、化合物、酸碱盐
离子化合物、共价化合物
酸
含氧酸、无氧酸
是否含氧元素
一元酸、二元酸、 、、、、
可电离的H+
可溶性酸、难溶性酸
是否可溶
强酸、弱酸
是否完全电离
氧化性酸、还原性酸
化合价
例1:
碱
一元碱、二元碱、 、、、、
可电离的OH-
可溶性碱、难溶性碱
是否可溶
强碱、弱碱
是否完全电离
氧化性碱、还原性碱
化合价
颜色
盐
含氧盐、无氧盐
是否含氧元素
酸式盐、碱式盐 、正盐、、、
可溶性盐、难溶性盐
是否可溶
钠盐、碳酸盐
阳离子
阴离子
氧化性盐、还原性盐
化合价
结合分类知识对下列盐类分类:Na2CO3、 Na2SO4、 CaCO3、 Na2SiO3、 CaSO4
例2:
活动3:“价一类”二维图可以表示元素化合价与物质类碳元素化合食别之间的关系,图中的a、b、c、d、e代表常见的含碳物质,下列说法错误的是( )
A.b和氧气反应生成c
B. c和水反应生成d
C. e可能难溶于水
D. 由a得到e至少要经过
三步反应
D
含碳化合物分类
1.类别:单质→氧化物→含氧酸→盐
2.化合价:-4→+2→+4
活动4:亚硫酸钠(Na2SO3)常用作织物的漂白剂,在食品工业上也是常见的疏松剂和氧化剂,但亚硫酸钠(Na2SO3)在空气中容易氧化,因此自然界中几乎没有稳定存在的(Na2SO3),只能通过制备来获得
任务一:寻找原料
Na2SO3
Na S O
元素组成
类别
盐
1:基于物质类别预测物质性质
含
Na
物
质
Na
Na2O
NaOH
Na2CO3
含
S
物
质
S
SO2、SO3
K2SO3 K2SO4
H2SO3、H2SO4
基于物质转化关系设计合成路线
写出以Na为原料合成Na2SO3的化学反应
任务二:认识物质的转化关系
物质制备的一般思路
原料
元素组成
物质类别
产物
元素组成
物质类别
核心元素的传递
元素种类不变,
反应规律
物质类别的转化
实际 综合考量原料来源、价格、环保、能耗、反应条件等
活动:工业上如何制备NaOH?
如何根据物质的组成对物质进行分类?
物质
混合物
纯净物
单质
化合物
非金属
单质
金属
单质
无机
化合物
有机
化合物
氧化物
酸
碱
盐
…
组成成分
组成元素
性质
性质
组成元素
性质
两性氧化物
酸性氧化物
碱性
化合
物
不成盐氧化物
性质
含氧酸、无氧酸
一元酸、二元酸
可溶性酸、不溶性酸
氧化性酸、还原性、、
组成
…
气态
固态
液态
状态
分散系粒子大小
浊液
胶体
溶液
组成成分
物质
混合物
纯净物
单质
化合物
组成元素
性质
非金属
单质
金属
单质
无机
化合物
有机
化合物
组成元素
氧化物
酸
碱
盐
…
性质
气态
固态
液态
状态
分散系粒子大小
浊液
胶体
溶液
混合物:由一种物质分散到另一种物质中形成
分散系:化学上把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中形成的混合物
10-9
10-7
单位:m
分散质颗粒大小
溶液
胶体
浊液
活动1
观察比较1:将饱和FeCl3溶液分别滴入到沸水、冷水、氢氧化钠溶液,比较溶液的变化
观察比较2:用激光笔照射上述分散系
1.胶体分散系与其他分散系本质的区别是
A.分散质粒子直径的大小
B.是否有顶达尔现象
C.能否稳定存在 D.是否透明
2下列说法不正确的是
A. FeCl3可用作净水剂,是因为氢氧化铁胶体具有吸附性
B.氢氧化铁胶粒直径在10-9 ~10-7m之间
C. FeCl3溶液转变成氢氧化铁胶体是化学变化,
氢氧化铁胶体转变成氢氧化铁沉淀是物理变化
D.氢氧化铁胶体的分散质是氢氧化铁分子,分散剂是水
学习评价
一:胶体
1.定义:分散质粒子的直径在
10-9∽10-7m的分散系
2:性质:发生丁达尔现象;表面吸附
思考1:如果胶体中胶粒不断长大,会发生怎样的变化?
沉淀
(均一稳定的混合物)
思考2:怎样的物质才能形成胶体?
分散质难溶于分散剂
任务三:认识胶体
3. 胶体的分类:
Fe(OH)3
AgI胶体
淀粉胶体
雾、云、烟
有色玻璃
Fe(OH)3
AgI胶体
混合物
气体-气体
固体-固体
液体-液体
状态
固体-液体
分散系
分散质
分散剂
10-9
10-7
单位:m
分散质颗粒大小
溶液
胶体
浊液
归纳
例3:下列各组物质中,前者是纯净物,后者是混合物的是
A 水煤气、空气 B 盐酸、甲烷
C 硫酸铜晶体、石油
D 草木灰、含铁为70%的氧化物
例4:下列说法中正确的是
A 非金属氧化物都是酸性氧化物
B 凡是酸性氧化物都可以直接和水反应生成对应的酸
C碱性氧化物都是金属氧化物
D 金属氧化物都是碱性氧化物
铜
氧化铜
氢氧化铜
碳酸铜
硫酸铜
……..
单质
氧化物
碱
盐
氯气
-------
盐酸
氯化钠
氯化钡
…..
单质
氧化物
酸
盐
有哪些反应规律
任务四:学习评价
1.写出产物中有氯化铜生成的化学反应
相互转化条件
相互转化条件
无酸条件下,反应物必须均可溶
用方程式表达CO2能发生的化学反应
实验室制取氢气
练习:金属Na长期露置空气中最后变质为Na2CO3发生的化学反应方程式
归纳:
化学是什么
如何学习化学
1.学会从实验观察探究,结合实验现象进行推理
2.学会从宏观现象探究微观结构,认识化学变化的本质
3.学会用符号描述、表征
4.从分类和价态的角度研究化学物质
在原子、分子水平上研究物质的组成、 结构、性质、转化及其应用的基础自然科学
