3.3.3 影响盐类水解的主要因素 课件 2022-2023学年高二上学期化学人教版(2019)选择性必修1(23张)
文档属性
| 名称 | 3.3.3 影响盐类水解的主要因素 课件 2022-2023学年高二上学期化学人教版(2019)选择性必修1(23张) |  | |
| 格式 | pptx | ||
| 文件大小 | 50.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 10:26:03 | ||
图片预览






文档简介
(共23张PPT)
第三章 水溶液中的离子反应与平衡
3.3 影响盐类水解的主要因素
学习目标:
1、了解影响盐类水解平衡的因素
2、能多角度分析外界条件对盐类水解平衡的影响
核心素养:
科学探究与创新意识:能多角度分析外界条件对盐类水解平衡的影响。
能发现和提出有关盐类水解的问题,并设计探究方案,进行实验探究。
【思考1】为什么用纯碱溶液去油污而不用小苏打呢?
【思考2】为什么热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
生活中,我们常用用纯碱溶液清洗油污时,同时热的溶液还可增强去污力,这是为什么?
情景引入
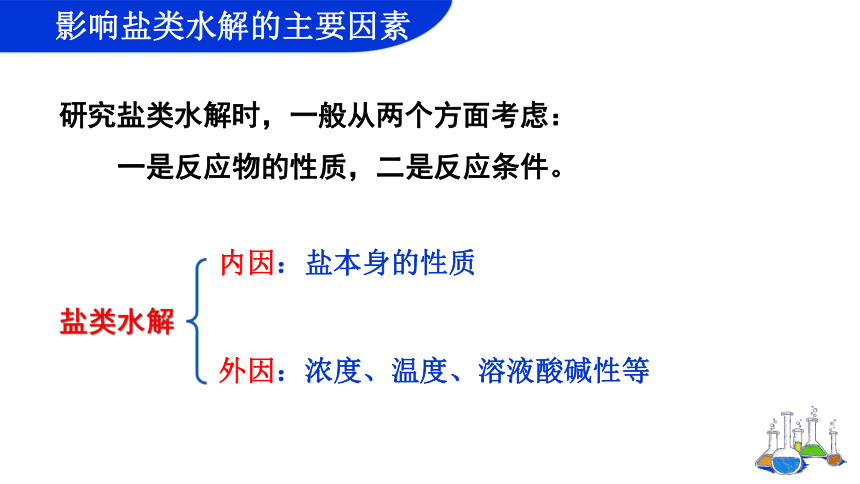
研究盐类水解时,一般从两个方面考虑:
一是反应物的性质,二是反应条件。
盐类水解
内因:盐本身的性质
外因:浓度、温度、溶液酸碱性等
影响盐类水解的主要因素
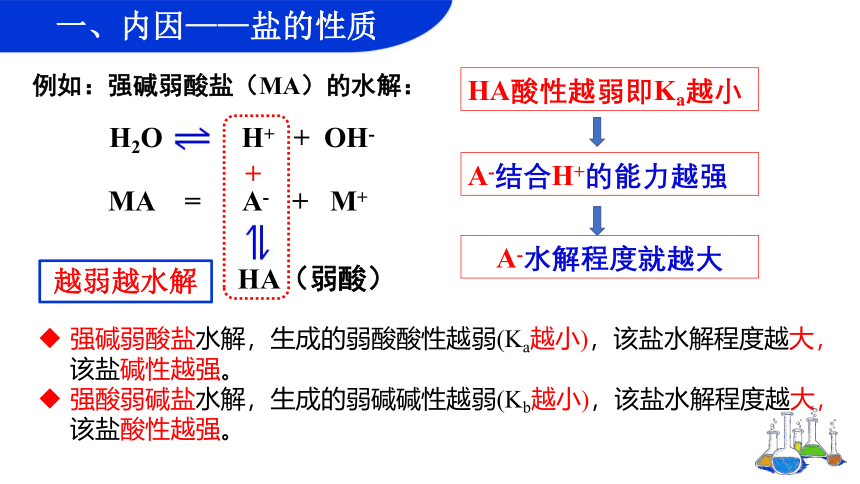
例如:强碱弱酸盐(MA)的水解:
MA = A- + M+
H2O H+ + OH-
HA(弱酸)
+
A-结合H+的能力越强
HA酸性越弱即Ka越小
A-水解程度就越大
强碱弱酸盐水解,生成的弱酸酸性越弱(Ka越小),该盐水解程度越大,该盐碱性越强。
强酸弱碱盐水解,生成的弱碱碱性越弱(Kb越小),该盐水解程度越大,该盐酸性越强。
越弱越水解
一、内因——盐的性质
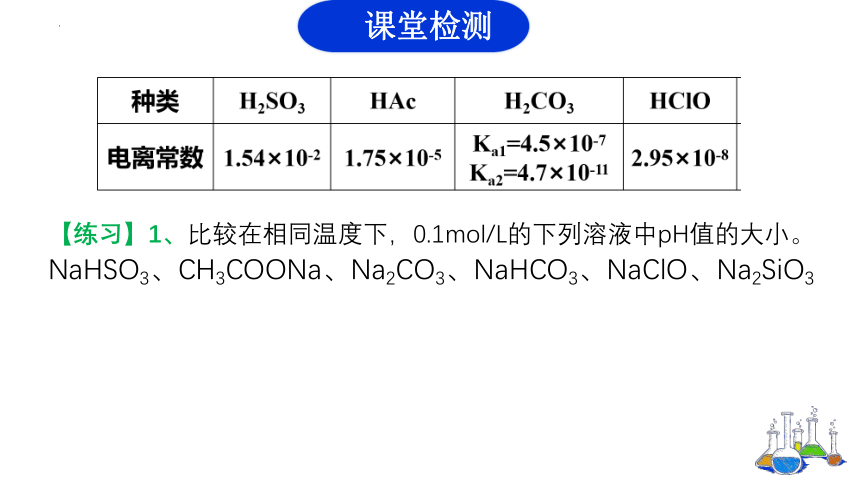
【练习】1、比较在相同温度下,0.1mol/L的下列溶液中pH值的大小。
NaHSO3、CH3COONa、Na2CO3、NaHCO3、NaClO、Na2SiO3
课堂检测
【练习】2、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
B
课堂检测
P75探究: 反应条件对FeCl3水解平衡的影响
[提出问题]
⑴FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
⑵从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
二、外因
呈酸性
Fe3+ + 3H2O Fe(OH)3 + 3H+
温度、浓度(反应物/生成物)
二、外因
实验探究1:温度对FeCl3水解平衡的影响
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
怎样设计实验?
[设计实验] [预测现象]
[解释原因]
Fe3+ + 3H2O Fe(OH)3 + 3H+
实验探究1:温度对FeCl3水解平衡的影响
加热
常温
加热
常温
【现象】FeCl3溶液加热后:颜色加深,pH值减小
【结论】温度升高,平衡向FeCl3水解的方向移动,溶液酸性增强
二、外因
实验探究1:温度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
越热越水解
二、外因
实验探究2:反应物浓度对FeCl3水解平衡的影响
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
怎样设计实验?
[设计实验] [预测现象]
[解释原因]
Fe3+ + 3H2O Fe(OH)3 + 3H+
实验探究2:反应物浓度对FeCl3水解平衡的影响
加FeCl3晶体
【现象】增大FeCl3浓度:颜色加深,pH值减小
【结论】增大盐的浓度,平衡向盐的水解方向移动
二、外因
实验探究2:反应物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
【操作】向0.1 mol/L FeCl3溶液中加水稀释10倍,pH?
0.1 mol/L FeCl3溶液
0.01 mol/L FeCl3溶液
【结论】加水稀释,促进盐的水解,水解程度增大
二、外因
实验探究2:反应物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
越稀越水解
二、外因
实验探究3:生成物浓度对FeCl3水解平衡的影响
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
怎样设计实验?
[设计实验] [预测现象]
[解释原因]
Fe3+ + 3H2O Fe(OH)3 + 3H+
实验探究3:生成物浓度对FeCl3水解平衡的影响
【实验步骤】向两支5mL0.1mol/LFeCl3溶液中分别加入1 mL盐酸和蒸馏水 ?
加盐酸
加蒸馏水
向FeCl3溶液中加盐酸,颜色变浅
【结论】加酸,增大c(H+),FeCl3的水解平衡逆向移动,抑制Fe3+水解
二、外因
实验探究3:生成物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液 ?
溶液颜色加深
【结论】
加碱,减小c(H+),FeCl3的水解平衡正向移动,促进Fe3+水解
二、外因
实验探究3:生成物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入少量AlCl3固体 ?
溶液颜色变浅
【结论】加入与盐水解性质相反的盐会促进盐的水解,
加入与盐水解性质相同的盐会相互抑制水解。
加入少量NaCl固体 ?
加入少量NaHCO3固体 ?
二、外因
实验探究4:外加盐对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
升高温度,向水解方向移动(盐的水解吸热)
②浓度
a. 加水稀释,促进水解,水解程度增大
③同离子效应
向能水解的盐溶液中加入与水解产物相同的离子,水解被抑制;
若水解产物被消耗,则促进水解
①温度:
越热越水解
b. 加溶质(增大浓度),促进水解,水解程度减小
越稀越水解
——符合勒夏特列原理
水解程度增大
水解程度减小
二、外因
1、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A.加热 B.通入HCl
C.加入少量Na2SO4(s) D.加入NaCl溶液
D
2、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
A
课堂检测
改变条件 平衡移动 c(H+) pH 水解程度 现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐↓无色↑
颜色变浅
红褐↓
在0.01mol/LFeCl3溶液中:Fe3++3H2O Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
总结
第三章 水溶液中的离子反应与平衡
3.3 影响盐类水解的主要因素
学习目标:
1、了解影响盐类水解平衡的因素
2、能多角度分析外界条件对盐类水解平衡的影响
核心素养:
科学探究与创新意识:能多角度分析外界条件对盐类水解平衡的影响。
能发现和提出有关盐类水解的问题,并设计探究方案,进行实验探究。
【思考1】为什么用纯碱溶液去油污而不用小苏打呢?
【思考2】为什么热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
生活中,我们常用用纯碱溶液清洗油污时,同时热的溶液还可增强去污力,这是为什么?
情景引入
研究盐类水解时,一般从两个方面考虑:
一是反应物的性质,二是反应条件。
盐类水解
内因:盐本身的性质
外因:浓度、温度、溶液酸碱性等
影响盐类水解的主要因素
例如:强碱弱酸盐(MA)的水解:
MA = A- + M+
H2O H+ + OH-
HA(弱酸)
+
A-结合H+的能力越强
HA酸性越弱即Ka越小
A-水解程度就越大
强碱弱酸盐水解,生成的弱酸酸性越弱(Ka越小),该盐水解程度越大,该盐碱性越强。
强酸弱碱盐水解,生成的弱碱碱性越弱(Kb越小),该盐水解程度越大,该盐酸性越强。
越弱越水解
一、内因——盐的性质
【练习】1、比较在相同温度下,0.1mol/L的下列溶液中pH值的大小。
NaHSO3、CH3COONa、Na2CO3、NaHCO3、NaClO、Na2SiO3
课堂检测
【练习】2、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
B
课堂检测
P75探究: 反应条件对FeCl3水解平衡的影响
[提出问题]
⑴FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
⑵从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
二、外因
呈酸性
Fe3+ + 3H2O Fe(OH)3 + 3H+
温度、浓度(反应物/生成物)
二、外因
实验探究1:温度对FeCl3水解平衡的影响
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
怎样设计实验?
[设计实验] [预测现象]
[解释原因]
Fe3+ + 3H2O Fe(OH)3 + 3H+
实验探究1:温度对FeCl3水解平衡的影响
加热
常温
加热
常温
【现象】FeCl3溶液加热后:颜色加深,pH值减小
【结论】温度升高,平衡向FeCl3水解的方向移动,溶液酸性增强
二、外因
实验探究1:温度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
越热越水解
二、外因
实验探究2:反应物浓度对FeCl3水解平衡的影响
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
怎样设计实验?
[设计实验] [预测现象]
[解释原因]
Fe3+ + 3H2O Fe(OH)3 + 3H+
实验探究2:反应物浓度对FeCl3水解平衡的影响
加FeCl3晶体
【现象】增大FeCl3浓度:颜色加深,pH值减小
【结论】增大盐的浓度,平衡向盐的水解方向移动
二、外因
实验探究2:反应物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
【操作】向0.1 mol/L FeCl3溶液中加水稀释10倍,pH?
0.1 mol/L FeCl3溶液
0.01 mol/L FeCl3溶液
【结论】加水稀释,促进盐的水解,水解程度增大
二、外因
实验探究2:反应物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
越稀越水解
二、外因
实验探究3:生成物浓度对FeCl3水解平衡的影响
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
怎样设计实验?
[设计实验] [预测现象]
[解释原因]
Fe3+ + 3H2O Fe(OH)3 + 3H+
实验探究3:生成物浓度对FeCl3水解平衡的影响
【实验步骤】向两支5mL0.1mol/LFeCl3溶液中分别加入1 mL盐酸和蒸馏水 ?
加盐酸
加蒸馏水
向FeCl3溶液中加盐酸,颜色变浅
【结论】加酸,增大c(H+),FeCl3的水解平衡逆向移动,抑制Fe3+水解
二、外因
实验探究3:生成物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液 ?
溶液颜色加深
【结论】
加碱,减小c(H+),FeCl3的水解平衡正向移动,促进Fe3+水解
二、外因
实验探究3:生成物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入少量AlCl3固体 ?
溶液颜色变浅
【结论】加入与盐水解性质相反的盐会促进盐的水解,
加入与盐水解性质相同的盐会相互抑制水解。
加入少量NaCl固体 ?
加入少量NaHCO3固体 ?
二、外因
实验探究4:外加盐对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
升高温度,向水解方向移动(盐的水解吸热)
②浓度
a. 加水稀释,促进水解,水解程度增大
③同离子效应
向能水解的盐溶液中加入与水解产物相同的离子,水解被抑制;
若水解产物被消耗,则促进水解
①温度:
越热越水解
b. 加溶质(增大浓度),促进水解,水解程度减小
越稀越水解
——符合勒夏特列原理
水解程度增大
水解程度减小
二、外因
1、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A.加热 B.通入HCl
C.加入少量Na2SO4(s) D.加入NaCl溶液
D
2、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
A
课堂检测
改变条件 平衡移动 c(H+) pH 水解程度 现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐↓无色↑
颜色变浅
红褐↓
在0.01mol/LFeCl3溶液中:Fe3++3H2O Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
总结
