2022-2023学年高一上学期化学人教版(2019)必修第一册第一章第一节 物质的分类及转化 第1课时 课件(21张ppt)
文档属性
| 名称 | 2022-2023学年高一上学期化学人教版(2019)必修第一册第一章第一节 物质的分类及转化 第1课时 课件(21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 10:25:38 | ||
图片预览







文档简介
(共21张PPT)
物质的分类与转化
一、物质的分类
假设你是一个商场的经理,为了要让顾客顺利地找到所需的商品,你会让员工如何摆放商品?
思考:
非均匀混合物
均匀混合物
氧化物
酸
碱
盐
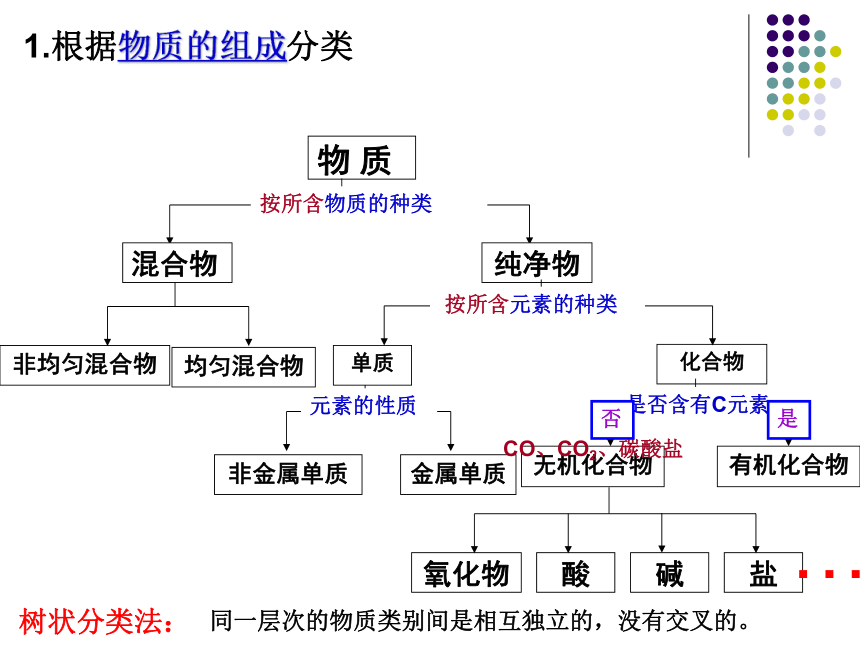
1.根据物质的组成分类
物 质
混合物
纯净物
按所含物质的种类
单质
化合物
按所含元素的种类
非金属单质
金属单质
元素的性质
无机化合物
有机化合物
是否含有C元素
CO、CO2、碳酸盐
否
是
…
树状分类法:
同一层次的物质类别间是相互独立的,没有交叉的。
思考:由同一种元素构成的物质一定是单质吗?
同素异形体
思考:那它们相互之间是什么关系?
由同一种元素形成的几种性质不同的单质。
思考:你还能举出其他同素异形体体的例子吗?
酸
按电离出的H+数
一元酸:HCl、HNO3等
二元酸:H2SO4、H2S等
三元酸:H3PO4等
按酸根是否含氧
无氧酸:HCl、H2S等
含氧酸:HClO4、H2SO4等
按酸性强弱
强酸:HCl、H2SO4、HNO3等
弱酸:CH3COOH、HF等
按有无挥发性
挥发性酸:HNO3、HCl等
难挥发性酸:H2SO4、H3PO4等
酸:电离时生成的阳离子全都是H+的化合物。
碱
按水溶性
可溶性碱:NaOH、KOH、Ba(OH)2 、Ca(OH)2
难溶性碱:Mg(OH)2、Cu(OH)2等
按碱性强弱
强碱:NaOH、Ba(OH)2、KOH等
弱碱:NH3·H2O等
碱:电离时生成的阴离子全都是OH-的化合物。
盐:电离时生成金属阳离子或铵根离子和酸根阴离子的化合物。
盐
溶解性
组成
可溶性盐:KNO3、NaCl
微溶性盐:CaSO4
难溶性盐:BaSO4、CaCO3
复盐:KAl(SO4)2·12H2O等
正 盐
酸式盐
碱式盐
NaCl FeS MgCl2
NaNO3 CuSO4 CaCO3
某酸某
NaHCO3 Ca(HCO3)2
某酸氢某
NaH2PO4
某酸几氢某
Cu2(OH)2CO3 Mg(OH)Cl
碱式某酸某
某化某
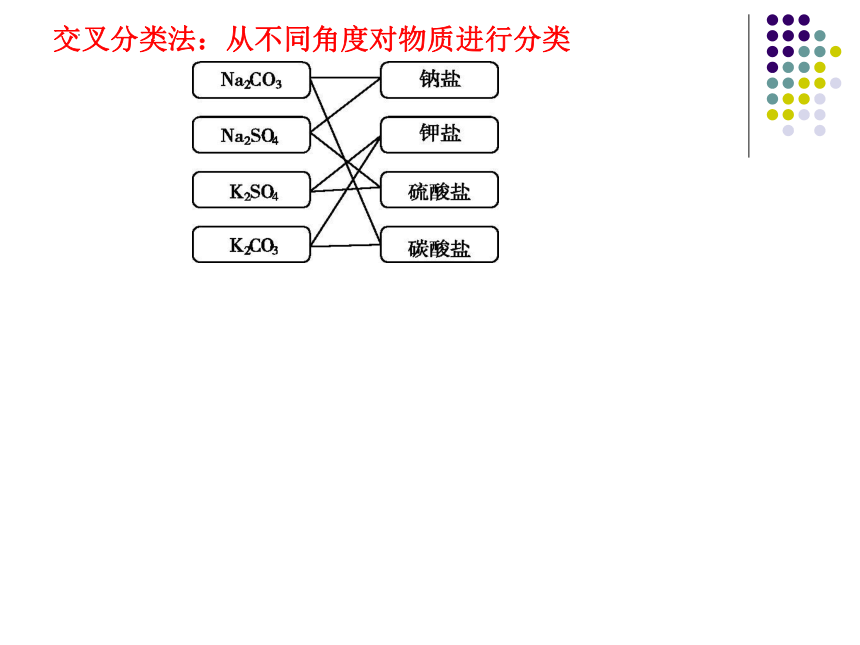
交叉分类法:从不同角度对物质进行分类
氧
化
物
按性质分类
氧
化
物
氧化物:只有两种元素,其中一种是氧元素。
金属氧化物
非金属氧化物
酸性氧化物(CO2、SO3、Mn2O7)
碱性氧化物(Na2O、CaO)
两性氧化物,如Al2O3、ZnO等
不成盐氧化物,如H2O、CO、NO等
特殊氧化物,如Na2O2、K2O2、KO2等
酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3)。
按组成分类
辨析:
1、一种氧化物,它不是酸性氧化物就是碱性氧化物?
如CO(不成盐氧化物)
3、非金属氧化物一定是酸性氧化物?
酸性氧化物一定是非金属氧化物?
2、金属氧化物一定是碱性氧化物?
碱性氧化物一定是金属氧化物?
归纳:
金属氧化物 碱性氧化物
不一定
一定
非金属氧化物 酸性氧化物
不一定
不一定
(如Mn2O7、Na2O2)
(如CO)
(如Mn2O7)
分类的意义?
二、分散系及其分类
1.分散系的概念
化学上把一种(或多种)物质以粒子形式分散到另一种(或多种)
物质中所形成的混合物,叫作分散系。
2.分散系的组成
分散质:被分散成粒子的物质
分散剂:分散被分散物质的物质。
溶液是一种分散系,溶质是分散质,溶剂是分散剂。
溶液和浊液有什么区别?
溶液
胶体
浊液
3.分散系的分类
按分散质粒子的直径大小,可以把分散系分为溶液、胶体、浊液。
最根本的区别
溶液、胶体和浊液分别有什么特点?
三、胶体的概念及性质
1、定义:分散质微粒直径大小在10-9~10-7m之间的分散系。
胶体按分散剂的不同,可分为液溶胶、气溶胶和固溶胶。
液溶胶:豆浆、稀牛奶、血浆、肥皂水等;
气溶胶:云、烟、雾;
固溶胶:有色玻璃、烟水晶等。
如何区别溶液和胶体?
2. Fe(OH)3胶体的制备
用烧杯取一定量的蒸馏水,加热煮沸,然后向沸水中逐滴加入5~6滴 FeCl3饱和溶液。继续煮沸至液体呈红褐色,停止加热,所得液体就是Fe(OH)3胶体。
光线通过硫酸铜溶液
光线通过氢氧化铁胶体
丁达尔现象
3、性质:
(2)胶体表面积大,吸附能力强——用于净水
(1)丁达尔现象——区别胶体和溶液
(3)聚沉现象
日常生活中如何观察丁达尔现象?
物质的分类与转化
二、物质的转化
一、物质的性质
1.酸的主要化学性质
酸的主要化学性质 反应实例(以盐酸为例,写出化学方程式)
(1)与活泼金属的反应
(2)与碱性氧化物反应
(3)与碱反应
(4)与某些盐反应
Zn+2HCl=ZnCl2+H2↑
CuO+2HCl=CuCl2+H2O
HCl+NaOH=NaCl+H2O
2HCl+Na2CO3=2NaCl+CO2↑+H2O
(5)使指示剂变色
从微观角度来看,不同的酸溶液中都含有H+,故酸的化学通性都由H+体现。
2.碱的主要化学性质
(1)与酸反应
(2)与酸性氧化物反应
(3)与某些盐反应
(4)与某些非金属单质反应
(5)试纸试剂变色
从微观角度来看,不同的碱溶液中都含有OH-,故碱的化学通性都由OH-体现。
3.盐的主要化学性质
(1)与酸反应
(2)与碱反应
(3)与某些盐反应
(4)与金属单质反应
从微观角度来看,盐的化学性质由谁决定?
氧化物的化学性质又有哪些?
二、物质的转化
根据物质组成和性质,通过化学变化可以实现物质之间的转化。转化过程中,元素是不会改变的,这是考虑如何实现物质之间转化的最基本的依据
Ca CaO Ca(OH)2 CaCO3
C CO2 H2CO3 CaCO3
上述各步转化的化学方程式及反应类型分别为:
金属
非金属
碱性氧化物
酸性氧化物
碱
酸
盐
盐
⑴
⑵
⑶
⑷
⑸
⑹
盐
盐+水
两种新盐
⑺
⑻
⑼
⑽
碱+盐
酸+盐
⑾
⑿
⒀
⒁
盐+金属
盐+氢气
⒂
⒃
1.转化规律
思考:转化关系图中包含哪几类基本反应?
2.转化类型:
基本类型
化合
分解
置换
复分解反应
元素价态是否变化
氧化还原反应
非氧化还原反应
CuO+CO CO2+Cu
△
3Cu+ 8HNO3 3Cu(NO3 )2+2NO↑+4H2O
△
是什么反应类型?
物质的分类与转化
一、物质的分类
假设你是一个商场的经理,为了要让顾客顺利地找到所需的商品,你会让员工如何摆放商品?
思考:
非均匀混合物
均匀混合物
氧化物
酸
碱
盐
1.根据物质的组成分类
物 质
混合物
纯净物
按所含物质的种类
单质
化合物
按所含元素的种类
非金属单质
金属单质
元素的性质
无机化合物
有机化合物
是否含有C元素
CO、CO2、碳酸盐
否
是
…
树状分类法:
同一层次的物质类别间是相互独立的,没有交叉的。
思考:由同一种元素构成的物质一定是单质吗?
同素异形体
思考:那它们相互之间是什么关系?
由同一种元素形成的几种性质不同的单质。
思考:你还能举出其他同素异形体体的例子吗?
酸
按电离出的H+数
一元酸:HCl、HNO3等
二元酸:H2SO4、H2S等
三元酸:H3PO4等
按酸根是否含氧
无氧酸:HCl、H2S等
含氧酸:HClO4、H2SO4等
按酸性强弱
强酸:HCl、H2SO4、HNO3等
弱酸:CH3COOH、HF等
按有无挥发性
挥发性酸:HNO3、HCl等
难挥发性酸:H2SO4、H3PO4等
酸:电离时生成的阳离子全都是H+的化合物。
碱
按水溶性
可溶性碱:NaOH、KOH、Ba(OH)2 、Ca(OH)2
难溶性碱:Mg(OH)2、Cu(OH)2等
按碱性强弱
强碱:NaOH、Ba(OH)2、KOH等
弱碱:NH3·H2O等
碱:电离时生成的阴离子全都是OH-的化合物。
盐:电离时生成金属阳离子或铵根离子和酸根阴离子的化合物。
盐
溶解性
组成
可溶性盐:KNO3、NaCl
微溶性盐:CaSO4
难溶性盐:BaSO4、CaCO3
复盐:KAl(SO4)2·12H2O等
正 盐
酸式盐
碱式盐
NaCl FeS MgCl2
NaNO3 CuSO4 CaCO3
某酸某
NaHCO3 Ca(HCO3)2
某酸氢某
NaH2PO4
某酸几氢某
Cu2(OH)2CO3 Mg(OH)Cl
碱式某酸某
某化某
交叉分类法:从不同角度对物质进行分类
氧
化
物
按性质分类
氧
化
物
氧化物:只有两种元素,其中一种是氧元素。
金属氧化物
非金属氧化物
酸性氧化物(CO2、SO3、Mn2O7)
碱性氧化物(Na2O、CaO)
两性氧化物,如Al2O3、ZnO等
不成盐氧化物,如H2O、CO、NO等
特殊氧化物,如Na2O2、K2O2、KO2等
酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3)。
按组成分类
辨析:
1、一种氧化物,它不是酸性氧化物就是碱性氧化物?
如CO(不成盐氧化物)
3、非金属氧化物一定是酸性氧化物?
酸性氧化物一定是非金属氧化物?
2、金属氧化物一定是碱性氧化物?
碱性氧化物一定是金属氧化物?
归纳:
金属氧化物 碱性氧化物
不一定
一定
非金属氧化物 酸性氧化物
不一定
不一定
(如Mn2O7、Na2O2)
(如CO)
(如Mn2O7)
分类的意义?
二、分散系及其分类
1.分散系的概念
化学上把一种(或多种)物质以粒子形式分散到另一种(或多种)
物质中所形成的混合物,叫作分散系。
2.分散系的组成
分散质:被分散成粒子的物质
分散剂:分散被分散物质的物质。
溶液是一种分散系,溶质是分散质,溶剂是分散剂。
溶液和浊液有什么区别?
溶液
胶体
浊液
3.分散系的分类
按分散质粒子的直径大小,可以把分散系分为溶液、胶体、浊液。
最根本的区别
溶液、胶体和浊液分别有什么特点?
三、胶体的概念及性质
1、定义:分散质微粒直径大小在10-9~10-7m之间的分散系。
胶体按分散剂的不同,可分为液溶胶、气溶胶和固溶胶。
液溶胶:豆浆、稀牛奶、血浆、肥皂水等;
气溶胶:云、烟、雾;
固溶胶:有色玻璃、烟水晶等。
如何区别溶液和胶体?
2. Fe(OH)3胶体的制备
用烧杯取一定量的蒸馏水,加热煮沸,然后向沸水中逐滴加入5~6滴 FeCl3饱和溶液。继续煮沸至液体呈红褐色,停止加热,所得液体就是Fe(OH)3胶体。
光线通过硫酸铜溶液
光线通过氢氧化铁胶体
丁达尔现象
3、性质:
(2)胶体表面积大,吸附能力强——用于净水
(1)丁达尔现象——区别胶体和溶液
(3)聚沉现象
日常生活中如何观察丁达尔现象?
物质的分类与转化
二、物质的转化
一、物质的性质
1.酸的主要化学性质
酸的主要化学性质 反应实例(以盐酸为例,写出化学方程式)
(1)与活泼金属的反应
(2)与碱性氧化物反应
(3)与碱反应
(4)与某些盐反应
Zn+2HCl=ZnCl2+H2↑
CuO+2HCl=CuCl2+H2O
HCl+NaOH=NaCl+H2O
2HCl+Na2CO3=2NaCl+CO2↑+H2O
(5)使指示剂变色
从微观角度来看,不同的酸溶液中都含有H+,故酸的化学通性都由H+体现。
2.碱的主要化学性质
(1)与酸反应
(2)与酸性氧化物反应
(3)与某些盐反应
(4)与某些非金属单质反应
(5)试纸试剂变色
从微观角度来看,不同的碱溶液中都含有OH-,故碱的化学通性都由OH-体现。
3.盐的主要化学性质
(1)与酸反应
(2)与碱反应
(3)与某些盐反应
(4)与金属单质反应
从微观角度来看,盐的化学性质由谁决定?
氧化物的化学性质又有哪些?
二、物质的转化
根据物质组成和性质,通过化学变化可以实现物质之间的转化。转化过程中,元素是不会改变的,这是考虑如何实现物质之间转化的最基本的依据
Ca CaO Ca(OH)2 CaCO3
C CO2 H2CO3 CaCO3
上述各步转化的化学方程式及反应类型分别为:
金属
非金属
碱性氧化物
酸性氧化物
碱
酸
盐
盐
⑴
⑵
⑶
⑷
⑸
⑹
盐
盐+水
两种新盐
⑺
⑻
⑼
⑽
碱+盐
酸+盐
⑾
⑿
⒀
⒁
盐+金属
盐+氢气
⒂
⒃
1.转化规律
思考:转化关系图中包含哪几类基本反应?
2.转化类型:
基本类型
化合
分解
置换
复分解反应
元素价态是否变化
氧化还原反应
非氧化还原反应
CuO+CO CO2+Cu
△
3Cu+ 8HNO3 3Cu(NO3 )2+2NO↑+4H2O
△
是什么反应类型?
