黑龙江省齐齐哈尔市三立高级中学2022-2023学年高三上学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省齐齐哈尔市三立高级中学2022-2023学年高三上学期期中考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 335.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-04 20:22:53 | ||
图片预览




文档简介
三立高级中学2022-2023学年高三上学期期中考试
化 学
时间 :90分钟 满分: 100分
2022.10
可能用到的相对原子质量:S:32 O:16 Na:23 I:127
一、单项选择题(每小题3分,共60分)
1.中国是瓷器的故乡,钧瓷是宋代五大名窑瓷器之一,以“入窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法正确的是( )
A.高品质的白瓷晶莹剔透,属于纯净物
B.瓷器中含有大量的金属元素,因此陶瓷属于金属材料
C.氮化硅陶瓷属于传统无机非金属材料
D.“窑变”是高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化
2.中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉混合加热至800 ℃左右可制得与黄金相似的鍮石金。则下列说法错误的是( )
A.鍮石金是铜锌合金
B.炉甘石点化鍮石过程包含分解反应、置换反应
C.可用稀盐酸鉴别鍮石金和黄金
D.炉甘石点化鍮石过程不涉及氧化还原反应
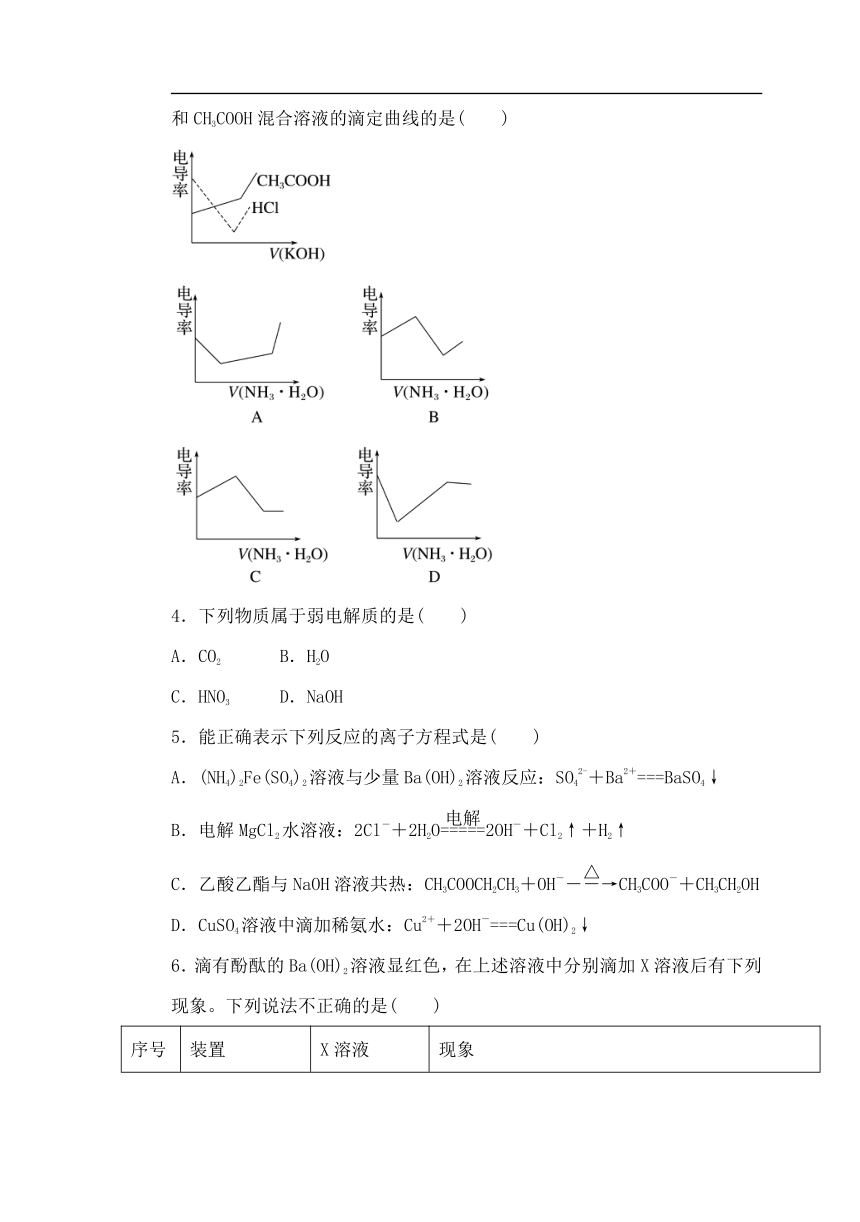
3.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
4.下列物质属于弱电解质的是( )
A.CO2 B.H2O
C.HNO3 D.NaOH
5.能正确表示下列反应的离子方程式是( )
A.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO42-+Ba2+===BaSO4↓
B.电解MgCl2水溶液:2Cl-+2H2O2OH-+Cl2↑+H2↑
C.乙酸乙酯与NaOH溶液共热:CH3COOCH2CH3+OH-CH3COO-+CH3CH2OH
D.CuSO4溶液中滴加稀氨水:Cu2++2OH-===Cu(OH)2↓
6.滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是( )
序号 装置 X溶液 现象
Ⅰ 盐酸 溶液红色褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ Na2SO4溶液 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ H2SO4溶液 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A.实验Ⅰ中溶液红色褪去,说明发生了反应:H++OH-===H2O
B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的Na+与OH-
C.实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
D.将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同
7.一瓶无色澄清的溶液,其中可能含有H+、NH4+、Na+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性 ②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色 ③该溶液的焰色试验没有黄色;根据以上实验结果,下列推断正确的是( )
A.向该溶液中加入BaCl2不一定能观察到白色沉淀
B.可以确定没有Na+、Fe3+、CO32-、AlO2-,不能确定是否有NO3-
C.该溶液可能是NH4NO3与HI的混合
D.一定没有Al3+、CO32-和NO3-
8.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1氨水溶液:Na+、K+、OH-、NO3-
B.0.1 mol·L-1盐酸溶液:Na+、K+、SO42-、SiO32-
C.0.1 mol·L-1KMnO4溶液:NH4+、Na+、NO3-、I-
D.0.1 mol·L-1 AgNO3溶液:NH4+、Mg2+、Cl-、SO42-
9.氢化钠(NaH)是一种固体,能与水反应放出氢气。下列叙述正确的是( )
A.NaH为共价化合物
B.该化合物中氢为+1价
C.NaH中氢离子半径比锂离子半径小
D.NaH中氢离子被氧化为氢气
10. LiAlH4是重要的储氢材料,可与水发生反应:LiAlH4+2H2O===LiAlO2+4H2↑。下列说法正确的是( )
A.氢气既是氧化产物又是还原产物
B.LiAlH4既是氧化剂又是还原剂
C.若生成标准状况下4.48 L H2,则转移0.4 mol电子
D.还原剂与氧化剂的物质的量之比为2∶1
11. 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe2++Cl2===2Fe3++2Cl-
12.关于反应K2H3IO6+9HI===2KI+4I2+6H2O,下列说法正确的是( )
A.K2H3IO6发生氧化反应
B.KI是还原产物
C.生成12.7 g I2时,转移0.1 mol电子
D.还原剂与氧化剂的物质的量之比为7∶1
13.下列事实与胶体性质无关的是( )
①水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
②将植物油倒入水中用力搅拌形成油水混合物
③一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路
④往Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
⑤医院里用血液透析的方法治疗肾功能衰竭等疾病引起的血液中毒
⑥FeCl3溶液和氨水混合会产生红褐色沉淀
⑦同一支钢笔先后吸入不同牌子的墨水易造成钢笔堵塞
A.②④⑥⑦ B.②⑥ C.①②④⑦ D.①③④⑤⑦
14.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol CHCl3含有C—Cl键的数目为3NA
B.1 L 1.0 mol·L-1的盐酸含有阴离子总数为2NA
C.11.2 L NO与11.2 L O2混合后的分子数目为NA
D.23 g Na与足量H2O反应生成的H2分子数目为NA
15.钠是人体必需的常量元素,下列说法正确的是( )
A.钠的相对原子质量为11 g
B.钠原子在化学反应中易失电子
C.钠由液态变为气态,微粒间间隔变小
D.人体缺钠会导致甲状腺疾病
16.观察是研究物质性质的一种基本方法。某同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体,则下列说法正确的是( )
A.①发生氧化还原反应生成了过氧化钠
B.④只发生物理变化
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.②④主要是非氧化还原反应
17.在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是( )
A.NaOH B.NaCl C.NaClO D.Na2CO3
18.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
19.铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )
A.FeO·3Fe2O3 B.2FeO·3Fe2O3 C.FeO·2Fe2O3 D.2FeO·Fe2O3
20.将金属铜、铁置于氯化铁溶液中充分反应,下列对反应情况设想的评价正确的是( )
选项 反应情况设想 评价
A 当铁、铜均不剩余时,溶液中一定有Fe2+、Cu2+,一定无Fe3+ 正确,Fe3+和Fe、Cu均可反应
B 当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+,无Fe3+ 正确,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+,无Fe3+
C 当铜有剩余,铁无剩余时,溶液中一定只有Fe2+,无Cu2+ 正确,Cu有剩余,故无Cu2+
D 当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ 不正确,不可能有Fe剩余而无Cu剩余,因为Fe比Cu优先与Fe3+反应
二、填空题(共40分)
21.(11分)已知还原性:HSO3->I-,氧化性:IO3->I2。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并用单线桥标出电子转移的方向和数目。
NaIO3+NaHSO3===I2+Na2SO4+H2SO4+H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全,推测反应后溶液中的还原产物为__________(填化学式)。
(3)在含5 mol NaHSO3的溶液中逐滴加入NaIO3溶液,加入NaIO3的物质的量和析出I2的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式: ;
当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为__________mol。
22.(6分)Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、K2Cr2O7等试剂测定某工厂废水中Ba2+ 的物质的量浓度。
(1)现需配制250 mL 0.100 0 mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要________。
(2)需准确称取Na2S2O3固体的质量为________g。
(3)另取50.00 mL废水,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO全部转化为Cr2O,再向其中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为Cr2O+6S2O+14H+===2Cr3++3S4O+7H2O。则该工厂废水中Ba2+的物质的量浓度为________。
23.(14分)为探究Fe2+与SCN-能否形成配位化合物,某研究性学习小组进行如图实验:
探究Ⅰ
(1)配制FeSO4溶液应使用________的蒸馏水。
(2)已知溶液颜色越深,色度越大。测得实验i、ii、iii色度数据如表:
实验 i ii iii
色度 0.075 0.049 0.015
实验i的作用是________,甲同学推测实验iii色度比实验ii小的原因可能有:①Mg2+和Fe2+对配合物解离影响不同;②______________________________________________。
探究Ⅱ
(3)X为________,实验iv的红色比实验v深的原因为________。
(4)在探究Ⅰ的基础上进行探究Ⅱ的目的为________________________________________________。
(5)分析可利用KSCN溶液检测Fe2+、Fe3+混合溶液中Fe3+的原因:________。
24.(9分)铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质,回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生H2的体积之比是 。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是____________。
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为 (填字母)。
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
答案
一、单项选择题(每小题2分,共60分)
1. D 2.D 3.D 4. B 5. C 6. D 7. A 8. A
9.D 10.A 11. C 12.D 13.B 14. A 15. B
16. D 17. C 18. C 19. B 20.D
填空题(共40分)
21.
答案 (1)===2I2+7Na2SO4+3H2SO4+2H2O (2)NaI (3)IO+5I-+6H+===3I2+3H2O
22.
答案 (1)250 mL容量瓶、胶头滴管 (2)4.0 (3)0.024 mol·L-1
23.
答案 (1)煮沸冷却
(2)空白实验 Fe2+与SCN-反应形成配合物
(3) 3 mL 4 mol·L-1的KCl溶液 Fe2+与SCN-形成配合物有利于FeCO3向溶解方向移动
(4)可以避免不同离子对配合物解离的影响
(5) Fe3+与SCN-的络合能力比Fe2+与SCN-的强,且Fe2+与SCN-反应形成的配合物无色,不影响Fe(SCN)3红色的观察
24.
答案 (1)1∶1 (2)1∶3 (3)3∶1 (4)A
化 学
时间 :90分钟 满分: 100分
2022.10
可能用到的相对原子质量:S:32 O:16 Na:23 I:127
一、单项选择题(每小题3分,共60分)
1.中国是瓷器的故乡,钧瓷是宋代五大名窑瓷器之一,以“入窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法正确的是( )
A.高品质的白瓷晶莹剔透,属于纯净物
B.瓷器中含有大量的金属元素,因此陶瓷属于金属材料
C.氮化硅陶瓷属于传统无机非金属材料
D.“窑变”是高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化
2.中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉混合加热至800 ℃左右可制得与黄金相似的鍮石金。则下列说法错误的是( )
A.鍮石金是铜锌合金
B.炉甘石点化鍮石过程包含分解反应、置换反应
C.可用稀盐酸鉴别鍮石金和黄金
D.炉甘石点化鍮石过程不涉及氧化还原反应
3.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
4.下列物质属于弱电解质的是( )
A.CO2 B.H2O
C.HNO3 D.NaOH
5.能正确表示下列反应的离子方程式是( )
A.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO42-+Ba2+===BaSO4↓
B.电解MgCl2水溶液:2Cl-+2H2O2OH-+Cl2↑+H2↑
C.乙酸乙酯与NaOH溶液共热:CH3COOCH2CH3+OH-CH3COO-+CH3CH2OH
D.CuSO4溶液中滴加稀氨水:Cu2++2OH-===Cu(OH)2↓
6.滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是( )
序号 装置 X溶液 现象
Ⅰ 盐酸 溶液红色褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ Na2SO4溶液 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ H2SO4溶液 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A.实验Ⅰ中溶液红色褪去,说明发生了反应:H++OH-===H2O
B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的Na+与OH-
C.实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
D.将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同
7.一瓶无色澄清的溶液,其中可能含有H+、NH4+、Na+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性 ②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色 ③该溶液的焰色试验没有黄色;根据以上实验结果,下列推断正确的是( )
A.向该溶液中加入BaCl2不一定能观察到白色沉淀
B.可以确定没有Na+、Fe3+、CO32-、AlO2-,不能确定是否有NO3-
C.该溶液可能是NH4NO3与HI的混合
D.一定没有Al3+、CO32-和NO3-
8.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1氨水溶液:Na+、K+、OH-、NO3-
B.0.1 mol·L-1盐酸溶液:Na+、K+、SO42-、SiO32-
C.0.1 mol·L-1KMnO4溶液:NH4+、Na+、NO3-、I-
D.0.1 mol·L-1 AgNO3溶液:NH4+、Mg2+、Cl-、SO42-
9.氢化钠(NaH)是一种固体,能与水反应放出氢气。下列叙述正确的是( )
A.NaH为共价化合物
B.该化合物中氢为+1价
C.NaH中氢离子半径比锂离子半径小
D.NaH中氢离子被氧化为氢气
10. LiAlH4是重要的储氢材料,可与水发生反应:LiAlH4+2H2O===LiAlO2+4H2↑。下列说法正确的是( )
A.氢气既是氧化产物又是还原产物
B.LiAlH4既是氧化剂又是还原剂
C.若生成标准状况下4.48 L H2,则转移0.4 mol电子
D.还原剂与氧化剂的物质的量之比为2∶1
11. 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe2++Cl2===2Fe3++2Cl-
12.关于反应K2H3IO6+9HI===2KI+4I2+6H2O,下列说法正确的是( )
A.K2H3IO6发生氧化反应
B.KI是还原产物
C.生成12.7 g I2时,转移0.1 mol电子
D.还原剂与氧化剂的物质的量之比为7∶1
13.下列事实与胶体性质无关的是( )
①水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
②将植物油倒入水中用力搅拌形成油水混合物
③一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路
④往Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
⑤医院里用血液透析的方法治疗肾功能衰竭等疾病引起的血液中毒
⑥FeCl3溶液和氨水混合会产生红褐色沉淀
⑦同一支钢笔先后吸入不同牌子的墨水易造成钢笔堵塞
A.②④⑥⑦ B.②⑥ C.①②④⑦ D.①③④⑤⑦
14.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol CHCl3含有C—Cl键的数目为3NA
B.1 L 1.0 mol·L-1的盐酸含有阴离子总数为2NA
C.11.2 L NO与11.2 L O2混合后的分子数目为NA
D.23 g Na与足量H2O反应生成的H2分子数目为NA
15.钠是人体必需的常量元素,下列说法正确的是( )
A.钠的相对原子质量为11 g
B.钠原子在化学反应中易失电子
C.钠由液态变为气态,微粒间间隔变小
D.人体缺钠会导致甲状腺疾病
16.观察是研究物质性质的一种基本方法。某同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体,则下列说法正确的是( )
A.①发生氧化还原反应生成了过氧化钠
B.④只发生物理变化
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.②④主要是非氧化还原反应
17.在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是( )
A.NaOH B.NaCl C.NaClO D.Na2CO3
18.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
19.铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )
A.FeO·3Fe2O3 B.2FeO·3Fe2O3 C.FeO·2Fe2O3 D.2FeO·Fe2O3
20.将金属铜、铁置于氯化铁溶液中充分反应,下列对反应情况设想的评价正确的是( )
选项 反应情况设想 评价
A 当铁、铜均不剩余时,溶液中一定有Fe2+、Cu2+,一定无Fe3+ 正确,Fe3+和Fe、Cu均可反应
B 当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+,无Fe3+ 正确,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+,无Fe3+
C 当铜有剩余,铁无剩余时,溶液中一定只有Fe2+,无Cu2+ 正确,Cu有剩余,故无Cu2+
D 当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ 不正确,不可能有Fe剩余而无Cu剩余,因为Fe比Cu优先与Fe3+反应
二、填空题(共40分)
21.(11分)已知还原性:HSO3->I-,氧化性:IO3->I2。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并用单线桥标出电子转移的方向和数目。
NaIO3+NaHSO3===I2+Na2SO4+H2SO4+H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全,推测反应后溶液中的还原产物为__________(填化学式)。
(3)在含5 mol NaHSO3的溶液中逐滴加入NaIO3溶液,加入NaIO3的物质的量和析出I2的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式: ;
当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为__________mol。
22.(6分)Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、K2Cr2O7等试剂测定某工厂废水中Ba2+ 的物质的量浓度。
(1)现需配制250 mL 0.100 0 mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要________。
(2)需准确称取Na2S2O3固体的质量为________g。
(3)另取50.00 mL废水,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO全部转化为Cr2O,再向其中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为Cr2O+6S2O+14H+===2Cr3++3S4O+7H2O。则该工厂废水中Ba2+的物质的量浓度为________。
23.(14分)为探究Fe2+与SCN-能否形成配位化合物,某研究性学习小组进行如图实验:
探究Ⅰ
(1)配制FeSO4溶液应使用________的蒸馏水。
(2)已知溶液颜色越深,色度越大。测得实验i、ii、iii色度数据如表:
实验 i ii iii
色度 0.075 0.049 0.015
实验i的作用是________,甲同学推测实验iii色度比实验ii小的原因可能有:①Mg2+和Fe2+对配合物解离影响不同;②______________________________________________。
探究Ⅱ
(3)X为________,实验iv的红色比实验v深的原因为________。
(4)在探究Ⅰ的基础上进行探究Ⅱ的目的为________________________________________________。
(5)分析可利用KSCN溶液检测Fe2+、Fe3+混合溶液中Fe3+的原因:________。
24.(9分)铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质,回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生H2的体积之比是 。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是____________。
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为 (填字母)。
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
答案
一、单项选择题(每小题2分,共60分)
1. D 2.D 3.D 4. B 5. C 6. D 7. A 8. A
9.D 10.A 11. C 12.D 13.B 14. A 15. B
16. D 17. C 18. C 19. B 20.D
填空题(共40分)
21.
答案 (1)===2I2+7Na2SO4+3H2SO4+2H2O (2)NaI (3)IO+5I-+6H+===3I2+3H2O
22.
答案 (1)250 mL容量瓶、胶头滴管 (2)4.0 (3)0.024 mol·L-1
23.
答案 (1)煮沸冷却
(2)空白实验 Fe2+与SCN-反应形成配合物
(3) 3 mL 4 mol·L-1的KCl溶液 Fe2+与SCN-形成配合物有利于FeCO3向溶解方向移动
(4)可以避免不同离子对配合物解离的影响
(5) Fe3+与SCN-的络合能力比Fe2+与SCN-的强,且Fe2+与SCN-反应形成的配合物无色,不影响Fe(SCN)3红色的观察
24.
答案 (1)1∶1 (2)1∶3 (3)3∶1 (4)A
同课章节目录
