高中化学人教版(2019)必修第一册 实验活动3同周期、同主族元素性质的递变教案
文档属性
| 名称 | 高中化学人教版(2019)必修第一册 实验活动3同周期、同主族元素性质的递变教案 |

|
|
| 格式 | docx | ||
| 文件大小 | 617.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-06 21:35:20 | ||
图片预览



文档简介
实验活动三 同周期、同主族元素性质的递变
课题 同周期、同主族元素性质的递变 单元 4 学科 化学 年级 九年级
教学目标与核心素养 宏观辨识与微观探析:从宏观上通过实验感受不同元素的特点与规律,从微观上辨析同周期、同主族元素的特点,体会微观粒子的变化对宏观物质的性质的影响。 证据推理与模型认知:通过物质分类的基本模型,理解元素的原子构成的物质的不同之处,通过结合理论与实际感知化学学习的魅力,为后续的化学知识的学习奠定坚实的方法基础。 科学探究与创新意识:熟悉同周期、同主族元素性质递变规律,熟练掌握根据元素周期表推到元素性质的能力,体会化学研究过程中的科学方法。 科学精神与社会责任:通过对元素的原子构成的物质的不同的学习和理解,掌握更高效的学习方法,建立高效学习的科学精神。
教学重点难点 1.掌握实验探究的方法。 2.加深对同周期、同主族元素性质递变规律的认识。
教学过程
教学环节 教师活动 学生活动 设计意图
导入新课 教师:之前的课时中,我们已经学习了一些有关同周期、同主族元素性质递变规律的内容。 教师提问:那么除了这些比较基本的规律,还有哪些规律呢?让我们一起通过实验,来进一步探索同周期,同主族元素的递变规律吧。 教师:引出本节课学习内容 认真倾听老师的描述,适当时候做好笔记。 在老师的带领下,对问题进行思考。引出本节课内容。 图文并茂,能够较快地让学生进入本节课堂学习。 简单的思维训练能够让学生不害怕对本节课知识点学习,感悟本节课的知识点。
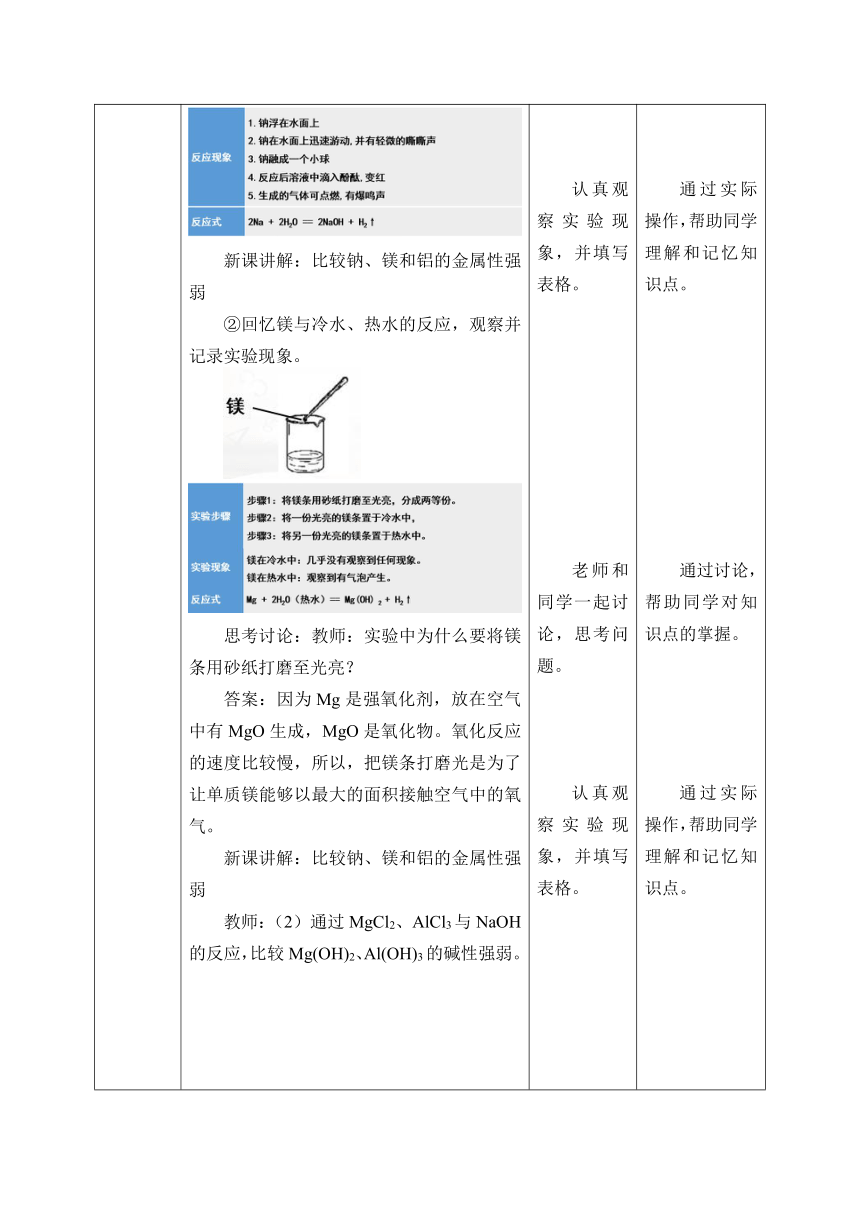
讲授新课 教师利用多媒体设备向学生投影出下面 新课讲解:比较氯、溴和碘的非金属性强弱 教师:(1)在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和新制的氯水,然后向NaBr溶液和NaI溶液中各滴入3滴新制的氯水。观察颜色变化,并与氯水的颜色进行比较。写出反应的化学方程式。 新课讲解:比较氯、溴和碘的非金属性强弱 教师:(2)在点滴板的2个孔穴中分别滴入3滴NaI溶液和溴水,然后向NaI溶液中各滴入3滴溴水。观察颜色变化,并与溴水的颜色进行比较。写出反应的化学方程式。 思考讨论:教师:实验中所用的氯水为什么要用新制的? 答案:因为氯水中溶解的氯气部分能够与水反应,生成盐酸和次氯酸,次氯酸不稳定,受光易分解产生氧气,最终氯水变为盐酸。 思维启迪:氯、溴和碘的非金属性强弱 现象:Cl2能从NaBr中置换出Br2,从NaI中置换出I2 结论:因此Cl2的非金属性强于Br2,也强于I2 现象:Br2能从NaI中置换出I2 结论:因此Br2的非金属性强于I2 最终结论:他们的非金属性由强到弱的排序为:Cl2>Br2>I2 新课讲解:比较钠、镁和铝的金属性强弱 教师:①回忆钠与水反应的实验,写出实验现象和化学方程式。 新课讲解:比较钠、镁和铝的金属性强弱 ②回忆镁与冷水、热水的反应,观察并记录实验现象。 思考讨论:教师:实验中为什么要将镁条用砂纸打磨至光亮? 答案:因为Mg是强氧化剂,放在空气中有MgO生成,MgO是氧化物。氧化反应的速度比较慢,所以,把镁条打磨光是为了让单质镁能够以最大的面积接触空气中的氧气。 新课讲解:比较钠、镁和铝的金属性强弱 教师:(2)通过MgCl2、AlCl3与NaOH的反应,比较Mg(OH)2、Al(OH)3的碱性强弱。 思维启迪:钠、镁和铝的金属性强弱 现象:Na能和冷水反应,Mg不能和冷水反应,只能和热水反应 结论:因此Na的金属性强于Mg 现象:过量氢氧化钠溶液会使氢氧化铝沉淀溶化,氢氧化镁则不受影响。 结论:因此Mg的金属性强于Al 最终结论:他们的金属性由强到弱的排序为:Na>Mg>Al 思考讨论:教师:通过以前的知识和上述实验,你能得出哪些结论? 课堂达标 1.填写下列空格 氯、溴和碘的非金属性强弱__________ 钠、镁和铝的金属性强弱____________ 氢氧化镁和氢氧化铝碱性强弱_______ 解析:氯、溴和碘非金属性由强到弱的排序为:Cl2>Br2>I2,钠、镁和铝的金属性由强到弱的排序为:Na>Mg>Al,氢氧化镁和氢氧化铝碱性由强到弱的排序为:Mg(OH)2>Al(OH)3。 2.下图表示碱金属的某些性质与核电荷数的变化关系,下列各性质中不符合图示关系的是( ) A.还原性 B.与水反应的剧烈程度 C.熔点 D.原子半径 解析:选项A中,碱金属元素中,随着碱金属的核电核数的增大,元素的金属性逐渐增强,单质的还原性逐渐增强,故A的说法正确;选项B中,碱金属元素中,随着碱金属的核电核数的增大,元素的金属性逐渐增强,与水反应的剧烈程度逐渐增大,故B的说法正确;选项C中,碱金属元素中,随着碱金属的核电核数的增大,金属晶体的金属键作用力减弱,熔点逐渐降低,故C的说法错误;选项D中,碱金属元素中,随着碱金属的核电核数的增大,核外电子层数逐渐增多,电子层数越多,半径越大,故D的说法正确。因此选C 3.金属钾和金属钠的性质相似,下列说法中能最好地解释这个事实的是( ) A.都是金属元素 B.原子半径相差不大 C.最外层电子数相同 D.最高化合价相同 解析:物质的性质是由结构决定的,钾和钠的性质相似,则说明钾和钠的结构相似即最外层电子数相同,均有1个电子。选项C的描述是正确的,因此选C。 4.运用元素周期律分析下面的推断,其中推断错误的是( ) A.氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱 B.砹(At)为有色固体,HAt不稳定 C.硫酸锶(SrSO4)是难溶于水的白色固体 D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体 解析:选项A中,Be和Mg同主族,Mg的核电荷数大于Be,金属性比Be强,因此碱性比较:Be(OH)2课堂小结 氯、溴和碘的非金属性强弱:非金属性由强到弱的排序为:Cl2>Br2>I2 钠、镁和铝的金属性强弱:金属性由强到弱的排序为:Na>Mg>Al 原子结构与元素性质: 学生和老师一起快速回顾本次课的学习内容。 通过对课堂学习知识的总结,帮助同学们加深印象。
板书 学生在笔记本上对板书进行誊写。 方便学生课后回顾。
课题 同周期、同主族元素性质的递变 单元 4 学科 化学 年级 九年级
教学目标与核心素养 宏观辨识与微观探析:从宏观上通过实验感受不同元素的特点与规律,从微观上辨析同周期、同主族元素的特点,体会微观粒子的变化对宏观物质的性质的影响。 证据推理与模型认知:通过物质分类的基本模型,理解元素的原子构成的物质的不同之处,通过结合理论与实际感知化学学习的魅力,为后续的化学知识的学习奠定坚实的方法基础。 科学探究与创新意识:熟悉同周期、同主族元素性质递变规律,熟练掌握根据元素周期表推到元素性质的能力,体会化学研究过程中的科学方法。 科学精神与社会责任:通过对元素的原子构成的物质的不同的学习和理解,掌握更高效的学习方法,建立高效学习的科学精神。
教学重点难点 1.掌握实验探究的方法。 2.加深对同周期、同主族元素性质递变规律的认识。
教学过程
教学环节 教师活动 学生活动 设计意图
导入新课 教师:之前的课时中,我们已经学习了一些有关同周期、同主族元素性质递变规律的内容。 教师提问:那么除了这些比较基本的规律,还有哪些规律呢?让我们一起通过实验,来进一步探索同周期,同主族元素的递变规律吧。 教师:引出本节课学习内容 认真倾听老师的描述,适当时候做好笔记。 在老师的带领下,对问题进行思考。引出本节课内容。 图文并茂,能够较快地让学生进入本节课堂学习。 简单的思维训练能够让学生不害怕对本节课知识点学习,感悟本节课的知识点。
讲授新课 教师利用多媒体设备向学生投影出下面 新课讲解:比较氯、溴和碘的非金属性强弱 教师:(1)在点滴板的3个孔穴中分别滴入3滴NaBr溶液、NaI溶液和新制的氯水,然后向NaBr溶液和NaI溶液中各滴入3滴新制的氯水。观察颜色变化,并与氯水的颜色进行比较。写出反应的化学方程式。 新课讲解:比较氯、溴和碘的非金属性强弱 教师:(2)在点滴板的2个孔穴中分别滴入3滴NaI溶液和溴水,然后向NaI溶液中各滴入3滴溴水。观察颜色变化,并与溴水的颜色进行比较。写出反应的化学方程式。 思考讨论:教师:实验中所用的氯水为什么要用新制的? 答案:因为氯水中溶解的氯气部分能够与水反应,生成盐酸和次氯酸,次氯酸不稳定,受光易分解产生氧气,最终氯水变为盐酸。 思维启迪:氯、溴和碘的非金属性强弱 现象:Cl2能从NaBr中置换出Br2,从NaI中置换出I2 结论:因此Cl2的非金属性强于Br2,也强于I2 现象:Br2能从NaI中置换出I2 结论:因此Br2的非金属性强于I2 最终结论:他们的非金属性由强到弱的排序为:Cl2>Br2>I2 新课讲解:比较钠、镁和铝的金属性强弱 教师:①回忆钠与水反应的实验,写出实验现象和化学方程式。 新课讲解:比较钠、镁和铝的金属性强弱 ②回忆镁与冷水、热水的反应,观察并记录实验现象。 思考讨论:教师:实验中为什么要将镁条用砂纸打磨至光亮? 答案:因为Mg是强氧化剂,放在空气中有MgO生成,MgO是氧化物。氧化反应的速度比较慢,所以,把镁条打磨光是为了让单质镁能够以最大的面积接触空气中的氧气。 新课讲解:比较钠、镁和铝的金属性强弱 教师:(2)通过MgCl2、AlCl3与NaOH的反应,比较Mg(OH)2、Al(OH)3的碱性强弱。 思维启迪:钠、镁和铝的金属性强弱 现象:Na能和冷水反应,Mg不能和冷水反应,只能和热水反应 结论:因此Na的金属性强于Mg 现象:过量氢氧化钠溶液会使氢氧化铝沉淀溶化,氢氧化镁则不受影响。 结论:因此Mg的金属性强于Al 最终结论:他们的金属性由强到弱的排序为:Na>Mg>Al 思考讨论:教师:通过以前的知识和上述实验,你能得出哪些结论? 课堂达标 1.填写下列空格 氯、溴和碘的非金属性强弱__________ 钠、镁和铝的金属性强弱____________ 氢氧化镁和氢氧化铝碱性强弱_______ 解析:氯、溴和碘非金属性由强到弱的排序为:Cl2>Br2>I2,钠、镁和铝的金属性由强到弱的排序为:Na>Mg>Al,氢氧化镁和氢氧化铝碱性由强到弱的排序为:Mg(OH)2>Al(OH)3。 2.下图表示碱金属的某些性质与核电荷数的变化关系,下列各性质中不符合图示关系的是( ) A.还原性 B.与水反应的剧烈程度 C.熔点 D.原子半径 解析:选项A中,碱金属元素中,随着碱金属的核电核数的增大,元素的金属性逐渐增强,单质的还原性逐渐增强,故A的说法正确;选项B中,碱金属元素中,随着碱金属的核电核数的增大,元素的金属性逐渐增强,与水反应的剧烈程度逐渐增大,故B的说法正确;选项C中,碱金属元素中,随着碱金属的核电核数的增大,金属晶体的金属键作用力减弱,熔点逐渐降低,故C的说法错误;选项D中,碱金属元素中,随着碱金属的核电核数的增大,核外电子层数逐渐增多,电子层数越多,半径越大,故D的说法正确。因此选C 3.金属钾和金属钠的性质相似,下列说法中能最好地解释这个事实的是( ) A.都是金属元素 B.原子半径相差不大 C.最外层电子数相同 D.最高化合价相同 解析:物质的性质是由结构决定的,钾和钠的性质相似,则说明钾和钠的结构相似即最外层电子数相同,均有1个电子。选项C的描述是正确的,因此选C。 4.运用元素周期律分析下面的推断,其中推断错误的是( ) A.氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱 B.砹(At)为有色固体,HAt不稳定 C.硫酸锶(SrSO4)是难溶于水的白色固体 D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体 解析:选项A中,Be和Mg同主族,Mg的核电荷数大于Be,金属性比Be强,因此碱性比较:Be(OH)2
板书 学生在笔记本上对板书进行誊写。 方便学生课后回顾。
