2022-2023学年高二上学期化学人教版(2019)选择性必修1-3.4.1 难溶电解质的沉淀溶解平衡 课件 (26张ppt)
文档属性
| 名称 | 2022-2023学年高二上学期化学人教版(2019)选择性必修1-3.4.1 难溶电解质的沉淀溶解平衡 课件 (26张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 739.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-06 21:59:00 | ||
图片预览








文档简介
第三章 水溶液中的离子平衡
第四节 沉淀溶解平衡
第一课时
难溶电解质的沉淀溶解平衡
学习
目标
第1课时
难溶电解质的沉淀溶解平衡
PART
01
PART
02
PART
03
能描述沉淀溶解平衡,知道溶解平衡的特征
根据化学平衡理论,分析影响沉淀溶解平衡的因素
了解离子积与Ksp的相对大小跟沉淀溶解平衡的关系。
我们知道,溶液中有沉淀生成是离子反应发生的条件之一。例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl,
????????+ + ????????? = AgCl ↓
?
如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
Ag+和?????????的反应真能进行到底吗? AgCl在水中完全不能溶解吗?
?
2 mL
0.1 mol/L NaCl溶液
AgNO3溶液
KI溶液
白色沉淀生成
黄色沉淀生成
2 mL 0.1mol/L
AgNO3溶液
步骤一
步骤二
取上层清液
提问:
1、实验说明了什么?
2、明明已经沉淀完全,为什么溶液中还有Ag+?那还有Cl-吗?
上层清液中有Ag+
沉淀完全是相对的,没有真正沉淀完全的反应。
思考:难溶物(氯化银)在水中的溶解度大吗?用什么来衡量?
衡量物质溶解能力大小的物理量之一—溶解度
定义:就是在一定条件下,物质在100g溶剂(通常是水)里溶解的最大克数。
符号:S
单位:g
溶解性
易溶
可溶
微溶
难溶
溶解度
>10 g
1~10 g
0.01~1 g
<0.01 g
20 ℃时,溶解性与溶解度的关系
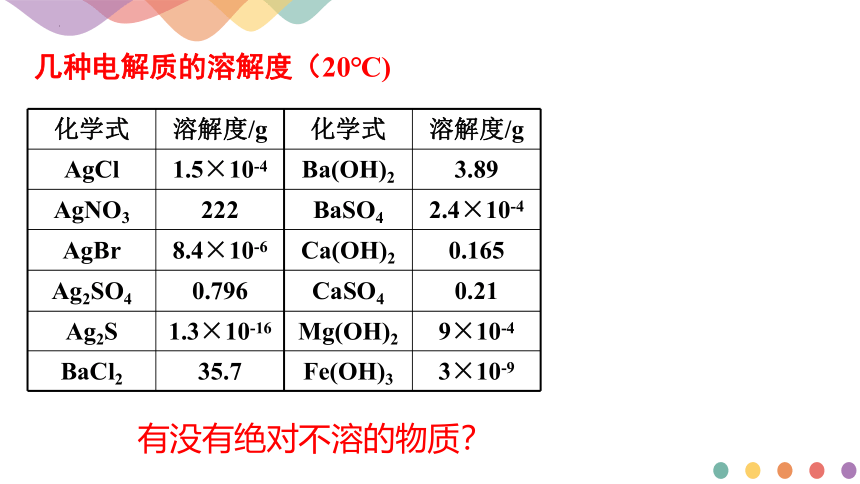
化学式
溶解度/g
化学式
溶解度/g
AgCl
1.5×10-4
Ba(OH)2
3.89
AgNO3
222
BaSO4
2.4×10-4
AgBr
8.4×10-6
Ca(OH)2
0.165
Ag2SO4
0.796
CaSO4
0.21
Ag2S
1.3×10-16
Mg(OH)2
9×10-4
BaCl2
35.7
Fe(OH)3
3×10-9
几种电解质的溶解度(20℃)
有没有绝对不溶的物质?
思考:Ag+和?????????的反应真能进行到底吗?AgCl在水中完全不能溶解吗?
?
沉淀完全是相对的,没有真正沉淀完全的反应。
资料:化学上通常认为残留在溶液中的离子浓度小于10-5mo/L时,沉淀达到完全。
思考:AgCl沉淀在水溶液中发生了怎样的变化?
Ag+
Cl-
当v溶解= v沉淀时,得到饱和AgCl溶液,建立溶解平衡
1、沉淀溶解平衡的建立:
AgCl(s) ? Ag+(aq) + Cl-(aq)
溶解
沉淀
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
难溶电解质的沉淀溶解平衡
1、概念:
在一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,溶液中各离子的浓度保持不变,这种平衡称为沉淀溶解平衡。
沉淀溶解平衡有些什么特征呢?
2、沉淀溶解平衡的特征:
逆、等、动、定、变
化学平衡移动的规律符合勒夏特列原理
AgCl(s) ? Ag+(aq) + Cl-(aq)
溶解
沉淀
v溶解______v沉淀 ,固体溶解;
v溶解______v沉淀 ,溶解平衡;
v溶解______v沉淀 ,析出晶体。
>
=
<
请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
3、沉淀溶解平衡方程式:
BaSO4(s) ??????????????+(????????)+????????????????? (aq)
?
CaCO3(s) ??????????????+(????????)+????????????????? (aq)
?
Ag2S(s) ? 2?????????+(????????)+????????? (aq)
?
特别提醒
沉淀溶解平衡方程式中各物质要标明聚集状态。
难溶电解质用“s”标明状态,溶液中的离子用“aq” 并用“ ? ”连接。
练习:书写碘化银、氢氧化镁溶解平衡方程式
AgI(s) ? ?????????+(????????)+????? (aq)
?
Mg(OH)2(s) ??????????????+(????????)+????????????? (aq)
?
思考:影响难溶电解质溶解平衡的因素?
①内因:电解质本身的性质 (起决定作用)
②外因:
浓度、温度等
c(Ag+)
c(????????? )
移动方向
Ksp
升温
加水(有固体剩余)
加AgCl
加AgNO3
通HCl
加少量氨水
加H2S
AgCl固体的饱和溶液中存在:
AgCl (s) ? ????????+ (aq) + ????????? (aq)
?
增大
增大
正向移动
增大
不变
不变
正向移动
不变
不变
增大
减小
逆向移动
增大
减小
逆向移动
不变
减小
正向移动
增大
不变
减小
正向移动
增大
不变
不变
不变
不移动
不变
二. 溶度积常数及溶度积规则
1.定义:在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数,叫做溶度积常数,简称溶度积(Ksp)。
2.表达式:
对于反应 MmAn(s) ? m Mn+(aq) + n Am-(aq)
Ksp =????????(Mn+) · ????????(Am-)
?
【试一试】写出下列难溶物沉淀溶解平衡和溶度积表达式:
BaSO4
Fe(OH)3
Ag2CrO4
Ksp =????(????????????+) · c(?????????????????)
?
Ksp =????(????????????+) · ????????(?????????)
?
Ksp =????????(????????+) · c(?????????????????????)
?
3.影响因素:
Ksp只与难溶电解质的性质和温度有关。 T↑,Ksp↑ [ Ca(OH)2 相反]
4. Ksp的意义:
Ksp反映了难溶电解质在水中的溶解能力,一般来说,Ksp越小,溶解度越小。(注意:对于同类型物质,Ksp越小越难溶。)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}难溶物
Ksp
溶度积
难溶物
Ksp
溶度积
AgCl
AgBr
AgI
常见难溶电解质的溶度积与溶解度(25°C)
1.8×10-10
5.4×10-13
8.5×10-17
1.1×10-10
2.6×10-39
5.0×10-9
1.5×10-4
8.4×10-6
2.1×10-7
2.4×10-3
3.0×10-9
7.1×10-4
CaCO3
BaSO4
Fe(OH)3
比较AgCl、AgBr、AgI在水中的溶解能力:____________
比较BaSO4、CaCO3在水中的溶解能力:__________
比较AgCl、 Fe(OH)3在水中的溶解能力:______________
AgCl > AgBr > AgI
CaCO3> BaSO4
AgCl>Fe(OH)3
Q>Ksp,溶液过饱和,有沉淀析出。
Q=Ksp,溶液刚饱和,沉淀与溶解处于平衡状态。
Q < Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,可以继续溶解直至饱和。
Ksp的应用:
AnBm(s)? nAm+(aq) + mBn-(aq)
Q称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度.
②溶度积规则
①离子积
Q =????????(Mn+) · ????????(Am-)
?
例1:AgCl的Ksp=1.80×10-10,将0.001 mol/L NaCl和0.001 mol/L AgNO3 溶液等体积混合,是否有AgCl 沉淀生成?
1、判断能否生成沉淀
练习:若将等体积的4.0×10?3????????????/????的AgNO3溶液和4.0×10?3????????????/????的K2CrO4溶液混合,是否能析出Ag2CrO4沉淀?
已知Ksp(Ag2CrO4)= 2.0×10?12
?
实验测得某水样中的铁离子的浓度为6×10-6mol·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?[已知Fe(OH)3的Ksp为2.6×10-39]
解:设溶液中的OH-离子的浓度最少为X才能使水中的铁离子转化为沉淀。
2、计算某离子开始沉淀的pH值
Ksp=c(Fe3+) ·c3(OH-)=2.6×10-39 =6×10-6×X3
求得X=7.57×10-12mol·L-1=c(OH-)
c(H+)=1.32×10-3mol·L-1
pH=2.88
答:pH至少要控制在2.88以上。
已知硫化亚铁、硫化铜、硫化锌的溶度积分别为:
3.7×10-19 、 8.5×10-45 、 1.2×10-23
向等浓度FeCl2、CuSO4、ZnSO4中滴加0.01mol/LNa2S溶液时Fe2+、Zn2 + 、Cu2+沉淀的先后顺序是:
Cu2+、Zn2+、Fe2+
3、离子沉淀先后顺序
4、计算离子浓度
练习:已知Ksp[Cu(OH)2]=2.0×10-20
①某CuSO4溶液里,c(????????2+)=0.02mol/L,如要生成Cu(OH)2沉淀,则应向溶液里加入NaOH溶液使c(?????????)至少为_________________
?
②要使0.2mol/L CuSO4溶液中Cu2+沉淀较为完全(使Cu2+降至原来千分之一),应调整溶液的pH,使溶液的pH至少为________________
已知Ksp[AgCl]=1.8?10-10, 试求AgCl的溶解度(用g/L表示)
5、溶度积与溶解度的相互换算
感谢您的观看
第四节 沉淀溶解平衡
第一课时
难溶电解质的沉淀溶解平衡
学习
目标
第1课时
难溶电解质的沉淀溶解平衡
PART
01
PART
02
PART
03
能描述沉淀溶解平衡,知道溶解平衡的特征
根据化学平衡理论,分析影响沉淀溶解平衡的因素
了解离子积与Ksp的相对大小跟沉淀溶解平衡的关系。
我们知道,溶液中有沉淀生成是离子反应发生的条件之一。例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl,
????????+ + ????????? = AgCl ↓
?
如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
Ag+和?????????的反应真能进行到底吗? AgCl在水中完全不能溶解吗?
?
2 mL
0.1 mol/L NaCl溶液
AgNO3溶液
KI溶液
白色沉淀生成
黄色沉淀生成
2 mL 0.1mol/L
AgNO3溶液
步骤一
步骤二
取上层清液
提问:
1、实验说明了什么?
2、明明已经沉淀完全,为什么溶液中还有Ag+?那还有Cl-吗?
上层清液中有Ag+
沉淀完全是相对的,没有真正沉淀完全的反应。
思考:难溶物(氯化银)在水中的溶解度大吗?用什么来衡量?
衡量物质溶解能力大小的物理量之一—溶解度
定义:就是在一定条件下,物质在100g溶剂(通常是水)里溶解的最大克数。
符号:S
单位:g
溶解性
易溶
可溶
微溶
难溶
溶解度
>10 g
1~10 g
0.01~1 g
<0.01 g
20 ℃时,溶解性与溶解度的关系
化学式
溶解度/g
化学式
溶解度/g
AgCl
1.5×10-4
Ba(OH)2
3.89
AgNO3
222
BaSO4
2.4×10-4
AgBr
8.4×10-6
Ca(OH)2
0.165
Ag2SO4
0.796
CaSO4
0.21
Ag2S
1.3×10-16
Mg(OH)2
9×10-4
BaCl2
35.7
Fe(OH)3
3×10-9
几种电解质的溶解度(20℃)
有没有绝对不溶的物质?
思考:Ag+和?????????的反应真能进行到底吗?AgCl在水中完全不能溶解吗?
?
沉淀完全是相对的,没有真正沉淀完全的反应。
资料:化学上通常认为残留在溶液中的离子浓度小于10-5mo/L时,沉淀达到完全。
思考:AgCl沉淀在水溶液中发生了怎样的变化?
Ag+
Cl-
当v溶解= v沉淀时,得到饱和AgCl溶液,建立溶解平衡
1、沉淀溶解平衡的建立:
AgCl(s) ? Ag+(aq) + Cl-(aq)
溶解
沉淀
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
难溶电解质的沉淀溶解平衡
1、概念:
在一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,溶液中各离子的浓度保持不变,这种平衡称为沉淀溶解平衡。
沉淀溶解平衡有些什么特征呢?
2、沉淀溶解平衡的特征:
逆、等、动、定、变
化学平衡移动的规律符合勒夏特列原理
AgCl(s) ? Ag+(aq) + Cl-(aq)
溶解
沉淀
v溶解______v沉淀 ,固体溶解;
v溶解______v沉淀 ,溶解平衡;
v溶解______v沉淀 ,析出晶体。
>
=
<
请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
3、沉淀溶解平衡方程式:
BaSO4(s) ??????????????+(????????)+????????????????? (aq)
?
CaCO3(s) ??????????????+(????????)+????????????????? (aq)
?
Ag2S(s) ? 2?????????+(????????)+????????? (aq)
?
特别提醒
沉淀溶解平衡方程式中各物质要标明聚集状态。
难溶电解质用“s”标明状态,溶液中的离子用“aq” 并用“ ? ”连接。
练习:书写碘化银、氢氧化镁溶解平衡方程式
AgI(s) ? ?????????+(????????)+????? (aq)
?
Mg(OH)2(s) ??????????????+(????????)+????????????? (aq)
?
思考:影响难溶电解质溶解平衡的因素?
①内因:电解质本身的性质 (起决定作用)
②外因:
浓度、温度等
c(Ag+)
c(????????? )
移动方向
Ksp
升温
加水(有固体剩余)
加AgCl
加AgNO3
通HCl
加少量氨水
加H2S
AgCl固体的饱和溶液中存在:
AgCl (s) ? ????????+ (aq) + ????????? (aq)
?
增大
增大
正向移动
增大
不变
不变
正向移动
不变
不变
增大
减小
逆向移动
增大
减小
逆向移动
不变
减小
正向移动
增大
不变
减小
正向移动
增大
不变
不变
不变
不移动
不变
二. 溶度积常数及溶度积规则
1.定义:在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数,叫做溶度积常数,简称溶度积(Ksp)。
2.表达式:
对于反应 MmAn(s) ? m Mn+(aq) + n Am-(aq)
Ksp =????????(Mn+) · ????????(Am-)
?
【试一试】写出下列难溶物沉淀溶解平衡和溶度积表达式:
BaSO4
Fe(OH)3
Ag2CrO4
Ksp =????(????????????+) · c(?????????????????)
?
Ksp =????(????????????+) · ????????(?????????)
?
Ksp =????????(????????+) · c(?????????????????????)
?
3.影响因素:
Ksp只与难溶电解质的性质和温度有关。 T↑,Ksp↑ [ Ca(OH)2 相反]
4. Ksp的意义:
Ksp反映了难溶电解质在水中的溶解能力,一般来说,Ksp越小,溶解度越小。(注意:对于同类型物质,Ksp越小越难溶。)
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}难溶物
Ksp
溶度积
难溶物
Ksp
溶度积
AgCl
AgBr
AgI
常见难溶电解质的溶度积与溶解度(25°C)
1.8×10-10
5.4×10-13
8.5×10-17
1.1×10-10
2.6×10-39
5.0×10-9
1.5×10-4
8.4×10-6
2.1×10-7
2.4×10-3
3.0×10-9
7.1×10-4
CaCO3
BaSO4
Fe(OH)3
比较AgCl、AgBr、AgI在水中的溶解能力:____________
比较BaSO4、CaCO3在水中的溶解能力:__________
比较AgCl、 Fe(OH)3在水中的溶解能力:______________
AgCl > AgBr > AgI
CaCO3> BaSO4
AgCl>Fe(OH)3
Q>Ksp,溶液过饱和,有沉淀析出。
Q=Ksp,溶液刚饱和,沉淀与溶解处于平衡状态。
Q < Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,可以继续溶解直至饱和。
Ksp的应用:
AnBm(s)? nAm+(aq) + mBn-(aq)
Q称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度.
②溶度积规则
①离子积
Q =????????(Mn+) · ????????(Am-)
?
例1:AgCl的Ksp=1.80×10-10,将0.001 mol/L NaCl和0.001 mol/L AgNO3 溶液等体积混合,是否有AgCl 沉淀生成?
1、判断能否生成沉淀
练习:若将等体积的4.0×10?3????????????/????的AgNO3溶液和4.0×10?3????????????/????的K2CrO4溶液混合,是否能析出Ag2CrO4沉淀?
已知Ksp(Ag2CrO4)= 2.0×10?12
?
实验测得某水样中的铁离子的浓度为6×10-6mol·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?[已知Fe(OH)3的Ksp为2.6×10-39]
解:设溶液中的OH-离子的浓度最少为X才能使水中的铁离子转化为沉淀。
2、计算某离子开始沉淀的pH值
Ksp=c(Fe3+) ·c3(OH-)=2.6×10-39 =6×10-6×X3
求得X=7.57×10-12mol·L-1=c(OH-)
c(H+)=1.32×10-3mol·L-1
pH=2.88
答:pH至少要控制在2.88以上。
已知硫化亚铁、硫化铜、硫化锌的溶度积分别为:
3.7×10-19 、 8.5×10-45 、 1.2×10-23
向等浓度FeCl2、CuSO4、ZnSO4中滴加0.01mol/LNa2S溶液时Fe2+、Zn2 + 、Cu2+沉淀的先后顺序是:
Cu2+、Zn2+、Fe2+
3、离子沉淀先后顺序
4、计算离子浓度
练习:已知Ksp[Cu(OH)2]=2.0×10-20
①某CuSO4溶液里,c(????????2+)=0.02mol/L,如要生成Cu(OH)2沉淀,则应向溶液里加入NaOH溶液使c(?????????)至少为_________________
?
②要使0.2mol/L CuSO4溶液中Cu2+沉淀较为完全(使Cu2+降至原来千分之一),应调整溶液的pH,使溶液的pH至少为________________
已知Ksp[AgCl]=1.8?10-10, 试求AgCl的溶解度(用g/L表示)
5、溶度积与溶解度的相互换算
感谢您的观看
