高中化学人教版(2019)选择性必修1 3.3.1盐类的水解(共19张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修1 3.3.1盐类的水解(共19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 693.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-07 10:59:28 | ||
图片预览




文档简介
(共19张PPT)
3.3.1盐类的水解
复习与衔接
一、盐的分类
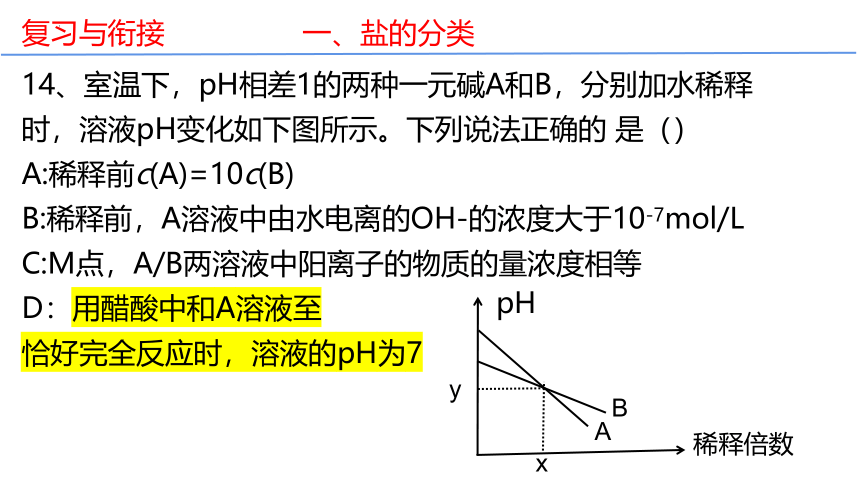
14、室温下,pH相差1的两种一元碱A和B,分别加水稀释时,溶液pH变化如下图所示。下列说法正确的 是()
A:稀释前c(A)=10c(B)
B:稀释前,A溶液中由水电离的OH-的浓度大于10-7mol/L
C:M点,A/B两溶液中阳离子的物质的量浓度相等
D:用醋酸中和A溶液至
恰好完全反应时,溶液的pH为7
pH
稀释倍数
y
x
B
A
复习与衔接
一、盐的分类
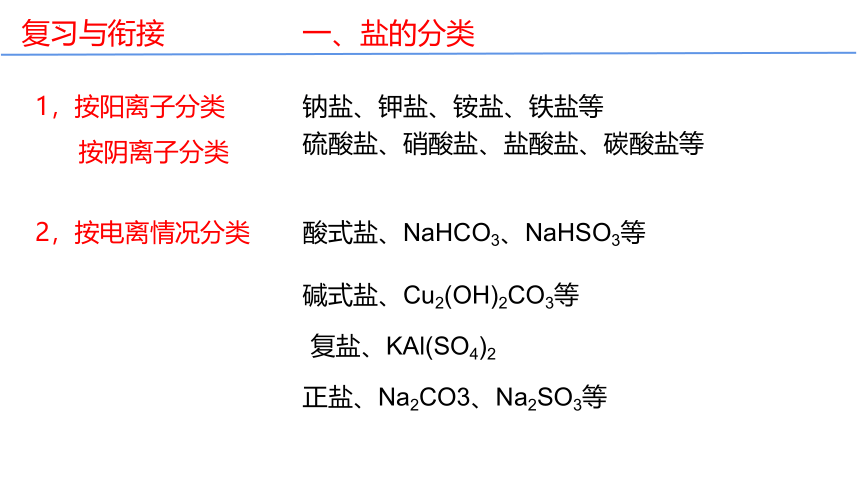
1,按阳离子分类
钠盐、钾盐、铵盐、铁盐等
按阴离子分类
硫酸盐、硝酸盐、盐酸盐、碳酸盐等
2,按电离情况分类
酸式盐、NaHCO3、NaHSO3等
碱式盐、Cu2(OH)2CO3等
复盐、KAl(SO4)2
正盐、Na2CO3、Na2SO3等
复习与衔接
一、盐的分类
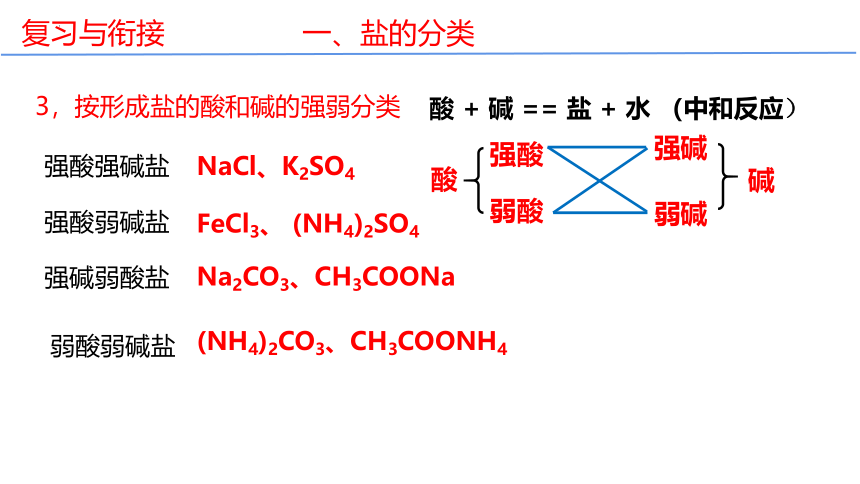
3,按形成盐的酸和碱的强弱分类
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
酸 + 碱 == 盐 + 水 (中和反应)
弱碱
强碱
酸
碱
强酸
弱酸
NaCl、K2SO4
FeCl3、 (NH4)2SO4
Na2CO3、CH3COONa
(NH4)2CO3、CH3COONH4
实验探究
二、盐溶液的酸碱性
提出问题:酸溶液呈酸性,碱溶液呈碱性。那么盐溶液的酸碱性如何呢,与盐的类型之间有什么关系
实验设计:用pH计测量NH4Cl溶液、NaCl溶液、 CH3COONa溶液pH
实验探究
二、盐溶液的酸碱性
实验现象
pH=5.3
pH=7.0
pH=8.6
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
实验探究
二、盐溶液显示不同酸碱性的原因
实验结论
盐的类别与溶液酸碱性的关系:
强碱弱酸盐的水溶液——显碱性
强酸弱碱盐的水溶液——显酸性
强酸强碱盐的水溶液——显中性
“谁___显谁性”,“都强显____性”。
强
中
思考与讨论
二、盐溶液的酸碱性
盐溶液 NaCl溶液
溶液中的电离
溶液中的离子
离子间能否相互结合
对水的电离的影响
c(H+)和c(OH-)的相对大小
讨论NaCl溶液的微观情况
H2O H++OH-
NaCl===Na++Cl-
H+、OH-、Na+、Cl-
否
无影响
c(H+) = c(OH-)
思考与讨论
二、盐溶液的酸碱性
盐溶液 NH4Cl溶液
溶液中的电离
溶液中的离子
离子间能否相互结合
对水的电离的影响
c(H+)和c(OH-)的相对大小
讨论NH4Cl溶液的微观情况
H2O H++OH-
NH4Cl===NH4++Cl-
H+、OH-、NH4+、Cl-
能 生成NH3.H20
促进水的电离
c(H+) > c(OH-)
思考与讨论
二、盐溶液的酸碱性
盐溶液 CH3COONa溶液
溶液中的电离
溶液中的离子
离子间能否相互结合
对水的电离的影响
c(H+)和c(OH-)的相对大小
讨论CH3COONa溶液的微观情况
H2O H++OH-
CH3COONa===CH3COO-+Na+
H+、OH-、CH3COO-、Na+
能 生成CH3COOH
促进水的电离
c(H+) < c(OH-)
①盐在水中完全电离为离子,但不产生H+和OH-,不能使溶液显酸碱性;
②纯水会微弱电离产生H+和OH-,但c(H+) =c(OH-) ,显中性;
③盐溶液显酸(碱)性,说明溶液中c(H+) ≠c(OH-)。
思考:是什么原因使得溶液中c(H+) ≠c(OH-)?
盐溶于水并电离都是在水分子的作用下发生的,由此可见,在溶液中的各种离子并非孤立存在,它们在运动过程中相互作用。
问题与思考:
实验探究
二、盐溶液显示不同酸碱性的原因
实验结论
盐溶液显示不同的酸碱性,与盐电离出来的离子能否和水电离出来的离子,结合生成弱酸或弱碱有关
盐类的水解
必须会背
三、盐类的水解
1、概念
在水溶液中,盐电离出来的弱离子与水电离出来的H+或OH—
结合生成弱电解质的反应 。
弱酸酸根离子或弱碱阳离子
弱酸或弱碱
2、实质
生成弱碱或弱酸,从而促进水的电离平衡向着右移动,
导致溶液中的C(H+)和C (OH—)不相等,使溶液呈现出
一定的酸性或碱性。
必须会写
3、水解方程式书写
三、盐类的水解
盐类水解是可逆反应,反应方程式中要写“ ”符号
一般盐类水解的程度很小,通常不生成沉淀或气体,一般不标“↓”或“↑” 。
多元弱酸根分步水解,一般只写一步;多元弱碱离子一步写
必须会写
3、水解方程式书写
三、盐类的水解
1.NH4Cl溶液
H2O OH-+H+
NH4Cl = NH4+ + Cl-
+
NH3·H2O
NH4Cl+H2O NH3·H2O +HCl
NH4 + +H2O NH3 ·H2O +H +
强酸弱碱盐溶于水时,盐电离的弱碱阳离子与OH-结合生成_____,使H2O的电离平衡向____的方向移动,溶液中的c(H+) 随之_____,当达到新的平衡时,c(H+) ___c(OH-),溶液呈_____性。
弱碱
电离
增大
>
酸
必须会写
3、水解方程式书写
三、盐类的水解
2. NaAc溶液
+
强碱弱酸盐溶于水时,盐电离的弱酸根离子与H+结合生成_____,使H2O的电离平衡向____的方向移动,溶液中的c(OH-) 随之_____,当达到新的平衡时,c(H+) ___c(OH-),溶液呈_____性。
弱酸
电离
增大
碱
NaAc = Na++ Ac-
H2O OH-+H+
HAc
NaAc+H2O HAc+NaOH
Ac- + H2O HAc + OH-
<
必须会写
3、水解方程式书写
三、盐类的水解
3. Na2CO3溶液
H2O OH-+ H+
Na2CO3 = 2Na++ CO32-
+
HCO3-
H2O OH-+H+
+
H2CO3
Na2CO3+ H2O NaHCO3+ NaOH
CO32- + H2O HCO3- + OH-
NaHCO3+ H2O H2CO3+ NaOH
HCO3- + H2O H2CO3 + OH-
必须会写
3、水解方程式书写
三、盐类的水解
Cu2+ + 2 H2O Cu(OH)2+2H+
Fe3+ + 3H2O Fe(OH)3+3H+
①常见弱酸离子
NH4+→NH3·H2O Mg2+→Mg(OH)2 Al3+→Al(OH)3 Fe2+→Fe(OH)2 Fe3+→Fe(OH)3 Cu2+→Cu(OH)2
②常见弱碱离子
SO32—→HSO3- S2—→HS- PO43— →HPO42-
HPO42— →H2PO4- H2PO4— →H3PO4
Ac—→ HAc
ClO— → HClO
CN— → HCN
F—→HF
AlO2 — →Al(OH)3 CO32—→HCO3- SiO32—→H2SiO3
HCO3—→H2CO3 HSO3—→H2SO3 HS—→H2S
3.3.1盐类的水解
复习与衔接
一、盐的分类
14、室温下,pH相差1的两种一元碱A和B,分别加水稀释时,溶液pH变化如下图所示。下列说法正确的 是()
A:稀释前c(A)=10c(B)
B:稀释前,A溶液中由水电离的OH-的浓度大于10-7mol/L
C:M点,A/B两溶液中阳离子的物质的量浓度相等
D:用醋酸中和A溶液至
恰好完全反应时,溶液的pH为7
pH
稀释倍数
y
x
B
A
复习与衔接
一、盐的分类
1,按阳离子分类
钠盐、钾盐、铵盐、铁盐等
按阴离子分类
硫酸盐、硝酸盐、盐酸盐、碳酸盐等
2,按电离情况分类
酸式盐、NaHCO3、NaHSO3等
碱式盐、Cu2(OH)2CO3等
复盐、KAl(SO4)2
正盐、Na2CO3、Na2SO3等
复习与衔接
一、盐的分类
3,按形成盐的酸和碱的强弱分类
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
酸 + 碱 == 盐 + 水 (中和反应)
弱碱
强碱
酸
碱
强酸
弱酸
NaCl、K2SO4
FeCl3、 (NH4)2SO4
Na2CO3、CH3COONa
(NH4)2CO3、CH3COONH4
实验探究
二、盐溶液的酸碱性
提出问题:酸溶液呈酸性,碱溶液呈碱性。那么盐溶液的酸碱性如何呢,与盐的类型之间有什么关系
实验设计:用pH计测量NH4Cl溶液、NaCl溶液、 CH3COONa溶液pH
实验探究
二、盐溶液的酸碱性
实验现象
pH=5.3
pH=7.0
pH=8.6
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
实验探究
二、盐溶液显示不同酸碱性的原因
实验结论
盐的类别与溶液酸碱性的关系:
强碱弱酸盐的水溶液——显碱性
强酸弱碱盐的水溶液——显酸性
强酸强碱盐的水溶液——显中性
“谁___显谁性”,“都强显____性”。
强
中
思考与讨论
二、盐溶液的酸碱性
盐溶液 NaCl溶液
溶液中的电离
溶液中的离子
离子间能否相互结合
对水的电离的影响
c(H+)和c(OH-)的相对大小
讨论NaCl溶液的微观情况
H2O H++OH-
NaCl===Na++Cl-
H+、OH-、Na+、Cl-
否
无影响
c(H+) = c(OH-)
思考与讨论
二、盐溶液的酸碱性
盐溶液 NH4Cl溶液
溶液中的电离
溶液中的离子
离子间能否相互结合
对水的电离的影响
c(H+)和c(OH-)的相对大小
讨论NH4Cl溶液的微观情况
H2O H++OH-
NH4Cl===NH4++Cl-
H+、OH-、NH4+、Cl-
能 生成NH3.H20
促进水的电离
c(H+) > c(OH-)
思考与讨论
二、盐溶液的酸碱性
盐溶液 CH3COONa溶液
溶液中的电离
溶液中的离子
离子间能否相互结合
对水的电离的影响
c(H+)和c(OH-)的相对大小
讨论CH3COONa溶液的微观情况
H2O H++OH-
CH3COONa===CH3COO-+Na+
H+、OH-、CH3COO-、Na+
能 生成CH3COOH
促进水的电离
c(H+) < c(OH-)
①盐在水中完全电离为离子,但不产生H+和OH-,不能使溶液显酸碱性;
②纯水会微弱电离产生H+和OH-,但c(H+) =c(OH-) ,显中性;
③盐溶液显酸(碱)性,说明溶液中c(H+) ≠c(OH-)。
思考:是什么原因使得溶液中c(H+) ≠c(OH-)?
盐溶于水并电离都是在水分子的作用下发生的,由此可见,在溶液中的各种离子并非孤立存在,它们在运动过程中相互作用。
问题与思考:
实验探究
二、盐溶液显示不同酸碱性的原因
实验结论
盐溶液显示不同的酸碱性,与盐电离出来的离子能否和水电离出来的离子,结合生成弱酸或弱碱有关
盐类的水解
必须会背
三、盐类的水解
1、概念
在水溶液中,盐电离出来的弱离子与水电离出来的H+或OH—
结合生成弱电解质的反应 。
弱酸酸根离子或弱碱阳离子
弱酸或弱碱
2、实质
生成弱碱或弱酸,从而促进水的电离平衡向着右移动,
导致溶液中的C(H+)和C (OH—)不相等,使溶液呈现出
一定的酸性或碱性。
必须会写
3、水解方程式书写
三、盐类的水解
盐类水解是可逆反应,反应方程式中要写“ ”符号
一般盐类水解的程度很小,通常不生成沉淀或气体,一般不标“↓”或“↑” 。
多元弱酸根分步水解,一般只写一步;多元弱碱离子一步写
必须会写
3、水解方程式书写
三、盐类的水解
1.NH4Cl溶液
H2O OH-+H+
NH4Cl = NH4+ + Cl-
+
NH3·H2O
NH4Cl+H2O NH3·H2O +HCl
NH4 + +H2O NH3 ·H2O +H +
强酸弱碱盐溶于水时,盐电离的弱碱阳离子与OH-结合生成_____,使H2O的电离平衡向____的方向移动,溶液中的c(H+) 随之_____,当达到新的平衡时,c(H+) ___c(OH-),溶液呈_____性。
弱碱
电离
增大
>
酸
必须会写
3、水解方程式书写
三、盐类的水解
2. NaAc溶液
+
强碱弱酸盐溶于水时,盐电离的弱酸根离子与H+结合生成_____,使H2O的电离平衡向____的方向移动,溶液中的c(OH-) 随之_____,当达到新的平衡时,c(H+) ___c(OH-),溶液呈_____性。
弱酸
电离
增大
碱
NaAc = Na++ Ac-
H2O OH-+H+
HAc
NaAc+H2O HAc+NaOH
Ac- + H2O HAc + OH-
<
必须会写
3、水解方程式书写
三、盐类的水解
3. Na2CO3溶液
H2O OH-+ H+
Na2CO3 = 2Na++ CO32-
+
HCO3-
H2O OH-+H+
+
H2CO3
Na2CO3+ H2O NaHCO3+ NaOH
CO32- + H2O HCO3- + OH-
NaHCO3+ H2O H2CO3+ NaOH
HCO3- + H2O H2CO3 + OH-
必须会写
3、水解方程式书写
三、盐类的水解
Cu2+ + 2 H2O Cu(OH)2+2H+
Fe3+ + 3H2O Fe(OH)3+3H+
①常见弱酸离子
NH4+→NH3·H2O Mg2+→Mg(OH)2 Al3+→Al(OH)3 Fe2+→Fe(OH)2 Fe3+→Fe(OH)3 Cu2+→Cu(OH)2
②常见弱碱离子
SO32—→HSO3- S2—→HS- PO43— →HPO42-
HPO42— →H2PO4- H2PO4— →H3PO4
Ac—→ HAc
ClO— → HClO
CN— → HCN
F—→HF
AlO2 — →Al(OH)3 CO32—→HCO3- SiO32—→H2SiO3
HCO3—→H2CO3 HSO3—→H2SO3 HS—→H2S
