高中化学人教版(2019)必修第一册 4.1原子结构与元素周期表(第3课时)教案
文档属性
| 名称 | 高中化学人教版(2019)必修第一册 4.1原子结构与元素周期表(第3课时)教案 |  | |
| 格式 | docx | ||
| 文件大小 | 483.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-07 11:41:09 | ||
图片预览

文档简介
第四章 物质结构 元素周期律
4.1 原子结构与元素周期表(第3课时)
教学设计
教学目标
1.知识与技能
(1)了解原子结构与元素性质的关系。
(2)掌握碱金属元素和卤族元素的性质与原子结构的关系。
(3)能初步学会总结元素递变规律的方法,具有把元素的性质、元素周期表的位置与元素组成微粒的结构初步联系起来并在一定条件下相互转化的运用能力。
2.过程与方法
(1)通过归纳、比较法来总结碱金属元素和卤族元素性质。
(2)培养学生的抽象思维能力和逻辑思维能力;通过对元素原子结构、位置间的关系的推导,培养学生的分析和推理能力。
3.情感态度与价值观
培养学生的求实、严谨和创新的优良品质;提高学生的学习兴趣。
教学重难点
1.教学重点:同周期、同主族性质的递变规律
2.教学难点:元素性质的递变规律与元素组成微粒结构的联系。
教学过程
教学环节 教学内容 师生互动 设计意图
1.新课导入 【复习引入】 第二章我们已经学习过金属钠了,同学们来回忆一下金属钠的物理性质有哪些?它能发生哪些反应? 钠是碱金属元素的代表,那么还有哪些元素是碱金属呢? 【生】1.银白色,柔软,具有金属通性。 2.能与非金属反应,能与水反应
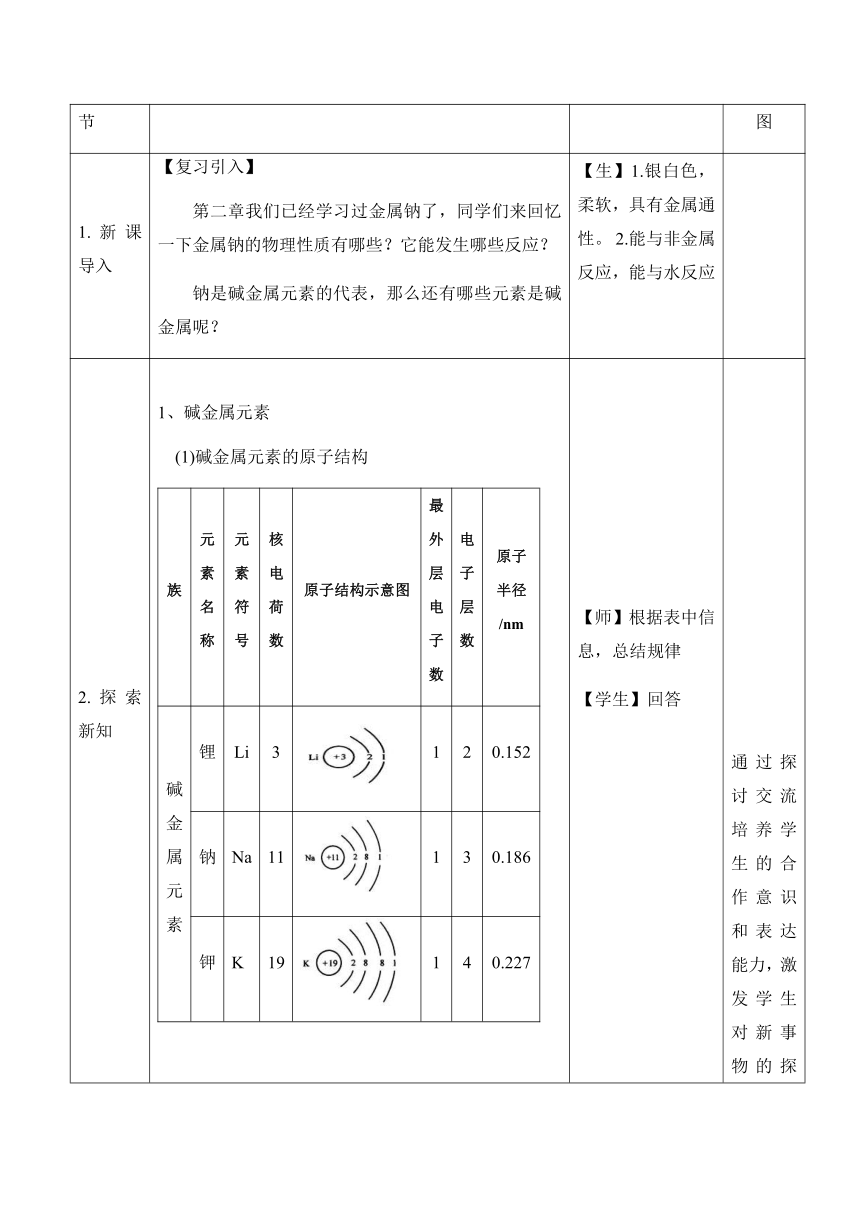
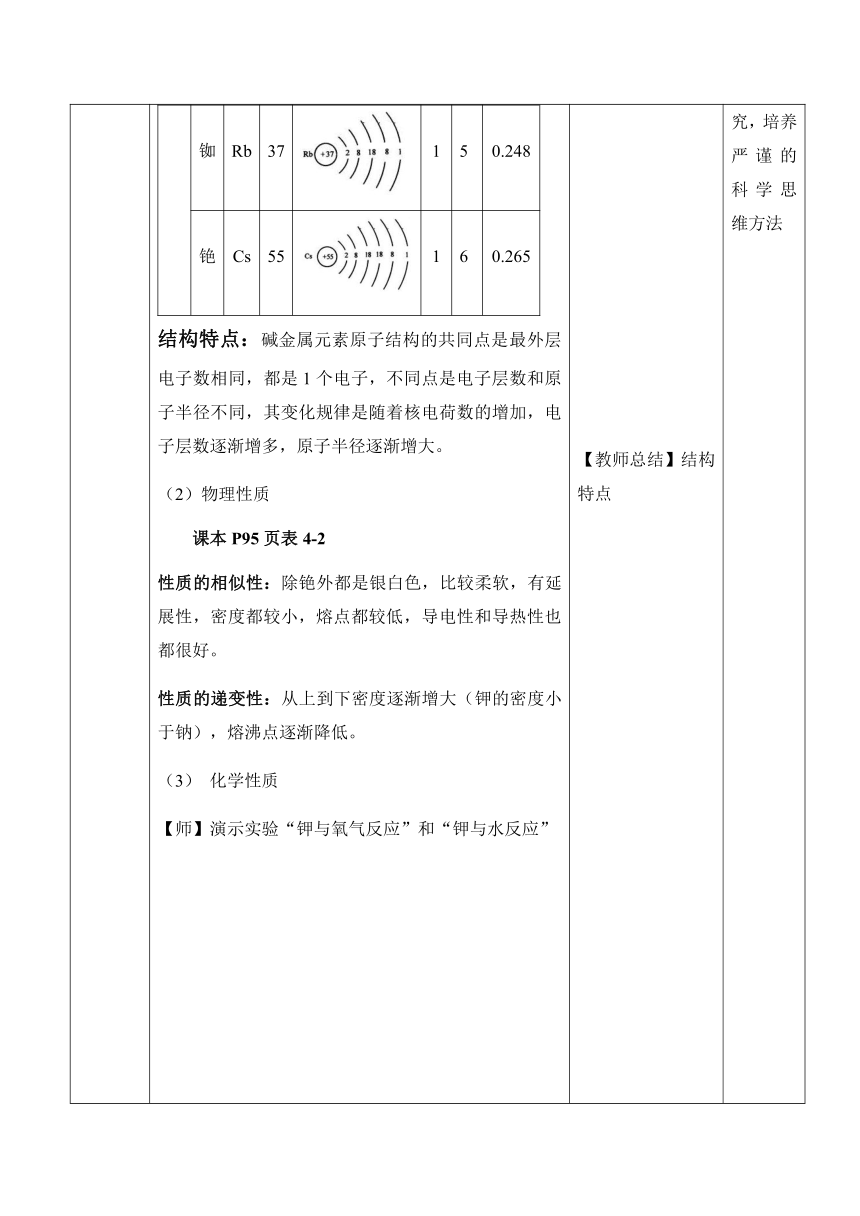
2.探索新知 1、碱金属元素 (1)碱金属元素的原子结构 族元素名称元素符号核电荷数原子结构示意图最外层电子数电子层数原子半径/nm碱金属元素锂Li3120.152钠Na 11130.186钾K19140.227铷Rb37150.248铯Cs55160.265
结构特点:碱金属元素原子结构的共同点是最外层电子数相同,都是1个电子,不同点是电子层数和原子半径不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。 (2)物理性质 课本P95页表4-2 性质的相似性:除铯外都是银白色,比较柔软,有延展性,密度都较小,熔点都较低,导电性和导热性也都很好。 性质的递变性:从上到下密度逐渐增大(钾的密度小于钠),熔沸点逐渐降低。 化学性质 【师】演示实验“钾与氧气反应”和“钾与水反应” 反应方程式反应程度产物复杂程度活泼性LiNa4Na+O2===2Na2O KRbCs
实验现象:熔成小球,浮于水面,四处游动,有轻微爆炸 声,反应后溶液滴加酚酞变红。 【师总结】碱金属元素的化学性质具有递变性,随着核电荷数的增加,碱金属元素原子的电子层数增多,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强。即从锂到铯,金属性逐渐增强。 2、卤族元素——简称卤素 (1)原子结构 相似性:最外层电子数都是7。 递变性:F→I,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大。 (2)卤素单质的物理性质 F2Cl2Br2I2颜色、状态淡黄绿色气体黄绿色气体深红棕色液体紫黑色固体密度逐渐增大熔、沸点逐渐增大
(3)卤素单质的化学性质 【师】演示【实验4-1】 ①卤素单质与氢气的反应。 反应的剧烈程度:F2>Cl2>Br2>I2; 氢化物的稳定性:HF>HCl>HBr>HI。 ②卤素单质间置换反应(写出化学反应方程式)。 将氯水加入NaBr溶液中:Cl2+2NaBr===2NaCl+Br2; 将氯水加入KI溶液中:Cl2+2KI===2KCl+I2; 将溴水加入KI溶液中:Br2+2KI===2KBr+I2。 ③结论:卤素单质的氧化性(从F2→I2)逐渐减弱,卤素的非金属性(从F→I)逐渐减弱。 【师总结】同主族元素的性质与原子结构的关系 【师】根据表中信息,总结规律 【学生】回答 【教师总结】结构特点 【学生】板书反应方程式 【教师补充】补充学生未写出的反应 【学生活动】 【实验演示】 【学生活动】总结实验现象并与钠的实验现象作比较 【师】根据碱金属元素的探究方法来探究卤族元素的规律 【学生思考回答】 【实验演示】4-1 【教师总结】 通过探讨交流培养学生的合作意识和表达能力,激发学生对新事物的探究,培养严谨的科学思维方法 培养学生总结归纳、辩证思维的能力
3.小结作业 完成同步练习
四.板书设计
原子结构与元素周期表
碱金属元素
卤族元素
同主族元素的性质与原子结构的关系
4.1 原子结构与元素周期表(第3课时)
教学设计
教学目标
1.知识与技能
(1)了解原子结构与元素性质的关系。
(2)掌握碱金属元素和卤族元素的性质与原子结构的关系。
(3)能初步学会总结元素递变规律的方法,具有把元素的性质、元素周期表的位置与元素组成微粒的结构初步联系起来并在一定条件下相互转化的运用能力。
2.过程与方法
(1)通过归纳、比较法来总结碱金属元素和卤族元素性质。
(2)培养学生的抽象思维能力和逻辑思维能力;通过对元素原子结构、位置间的关系的推导,培养学生的分析和推理能力。
3.情感态度与价值观
培养学生的求实、严谨和创新的优良品质;提高学生的学习兴趣。
教学重难点
1.教学重点:同周期、同主族性质的递变规律
2.教学难点:元素性质的递变规律与元素组成微粒结构的联系。
教学过程
教学环节 教学内容 师生互动 设计意图
1.新课导入 【复习引入】 第二章我们已经学习过金属钠了,同学们来回忆一下金属钠的物理性质有哪些?它能发生哪些反应? 钠是碱金属元素的代表,那么还有哪些元素是碱金属呢? 【生】1.银白色,柔软,具有金属通性。 2.能与非金属反应,能与水反应
2.探索新知 1、碱金属元素 (1)碱金属元素的原子结构 族元素名称元素符号核电荷数原子结构示意图最外层电子数电子层数原子半径/nm碱金属元素锂Li3120.152钠Na 11130.186钾K19140.227铷Rb37150.248铯Cs55160.265
结构特点:碱金属元素原子结构的共同点是最外层电子数相同,都是1个电子,不同点是电子层数和原子半径不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。 (2)物理性质 课本P95页表4-2 性质的相似性:除铯外都是银白色,比较柔软,有延展性,密度都较小,熔点都较低,导电性和导热性也都很好。 性质的递变性:从上到下密度逐渐增大(钾的密度小于钠),熔沸点逐渐降低。 化学性质 【师】演示实验“钾与氧气反应”和“钾与水反应” 反应方程式反应程度产物复杂程度活泼性LiNa4Na+O2===2Na2O KRbCs
实验现象:熔成小球,浮于水面,四处游动,有轻微爆炸 声,反应后溶液滴加酚酞变红。 【师总结】碱金属元素的化学性质具有递变性,随着核电荷数的增加,碱金属元素原子的电子层数增多,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强。即从锂到铯,金属性逐渐增强。 2、卤族元素——简称卤素 (1)原子结构 相似性:最外层电子数都是7。 递变性:F→I,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大。 (2)卤素单质的物理性质 F2Cl2Br2I2颜色、状态淡黄绿色气体黄绿色气体深红棕色液体紫黑色固体密度逐渐增大熔、沸点逐渐增大
(3)卤素单质的化学性质 【师】演示【实验4-1】 ①卤素单质与氢气的反应。 反应的剧烈程度:F2>Cl2>Br2>I2; 氢化物的稳定性:HF>HCl>HBr>HI。 ②卤素单质间置换反应(写出化学反应方程式)。 将氯水加入NaBr溶液中:Cl2+2NaBr===2NaCl+Br2; 将氯水加入KI溶液中:Cl2+2KI===2KCl+I2; 将溴水加入KI溶液中:Br2+2KI===2KBr+I2。 ③结论:卤素单质的氧化性(从F2→I2)逐渐减弱,卤素的非金属性(从F→I)逐渐减弱。 【师总结】同主族元素的性质与原子结构的关系 【师】根据表中信息,总结规律 【学生】回答 【教师总结】结构特点 【学生】板书反应方程式 【教师补充】补充学生未写出的反应 【学生活动】 【实验演示】 【学生活动】总结实验现象并与钠的实验现象作比较 【师】根据碱金属元素的探究方法来探究卤族元素的规律 【学生思考回答】 【实验演示】4-1 【教师总结】 通过探讨交流培养学生的合作意识和表达能力,激发学生对新事物的探究,培养严谨的科学思维方法 培养学生总结归纳、辩证思维的能力
3.小结作业 完成同步练习
四.板书设计
原子结构与元素周期表
碱金属元素
卤族元素
同主族元素的性质与原子结构的关系
