江苏省南京市建邺高级中学2013-2014学年高一上学期期中考试化学试题
文档属性
| 名称 | 江苏省南京市建邺高级中学2013-2014学年高一上学期期中考试化学试题 |

|
|
| 格式 | zip | ||
| 文件大小 | 159.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-11-28 00:00:00 | ||
图片预览

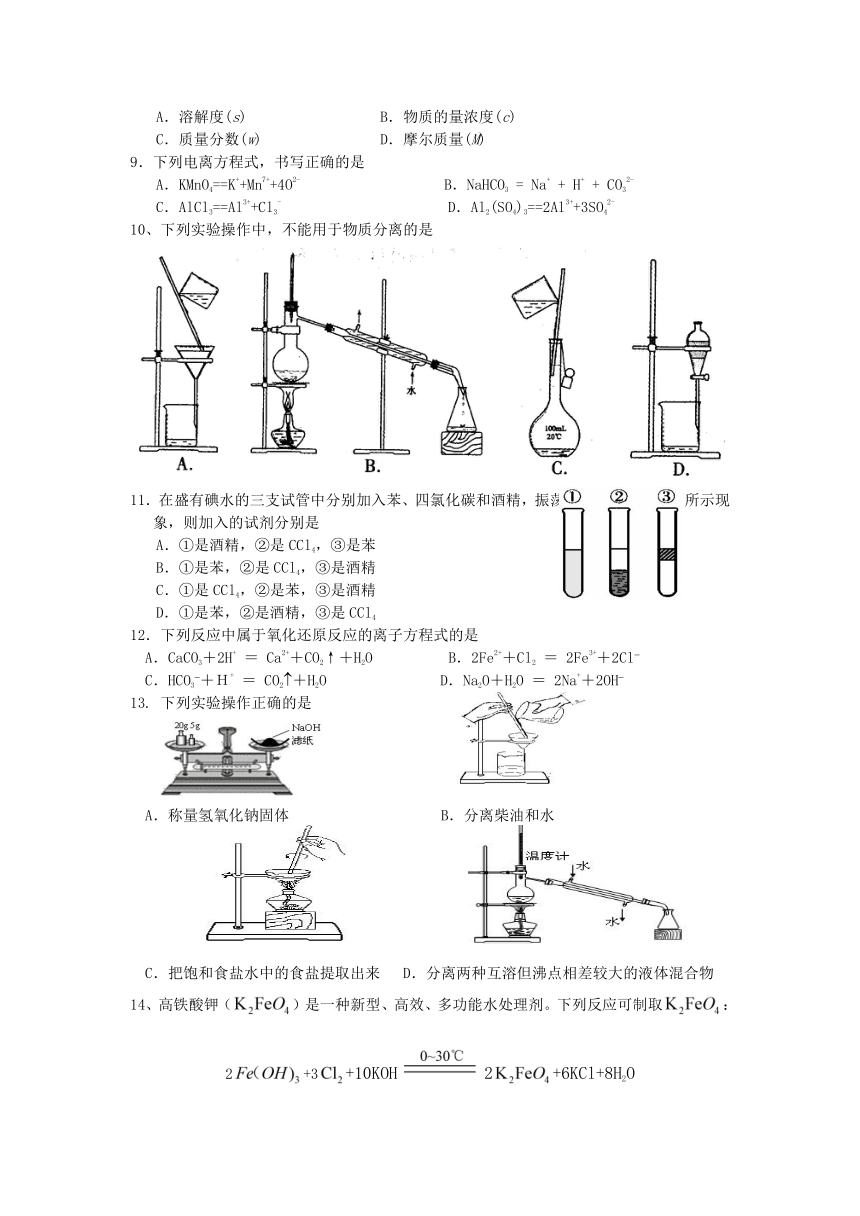

文档简介
2013-2014学年度第一学期期中测试
高 一 化 学 2013.11
注意事项:
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间75分钟。
考生将第Ⅰ卷、第Ⅱ卷答案填涂在答卷纸上,答在试卷上无效。
可能用到的相对原子质量:H: 1 C: 12 O:16 N: 14 Cl:35.5 S:32
Na: 23 Mg: 24 Zn: 65 Ba 137
第Ⅰ卷(选择题 共69分)
单项选择题(本题包括23小题,每小题3分,共69分。每小题只有一个选项符合题意)
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A、木已成舟 B、铁杵成针 C、蜡炬成灰 D、滴水成冰
2.下列自然、生活中的事例不属于氧化还原反应的是
A.动物呼吸 B.植物光合作用 C.金属生锈 D.石膏点制豆腐
3.危险化学品要在包装标签上印有警示性标志。氢氧化钠应选用的标志是
4.分类法是一种简单易行、行之有效的科学方法。碳酸钠不属于
A.纯净物 B.化合物 C.氧化物 D.盐
5.下列各组物质中按酸、碱、盐顺序排列的是
?? A.HCl、NaOH、H2O???????????? B.NaCl、HCl、KOH
?? C.H2SO4、NaOH、NaCl?????????? D.HCl、Na2CO3、NaOH
6.下列物质中属于电解质的是
A.硫酸铜 B.氮气 C.酒精 D.蔗糖
7.下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.如图所示树林中的晨曦,该现象与丁达尔效应有关
8.小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是
A.溶解度(s) B.物质的量浓度(c)
C.质量分数(w) D.摩尔质量(M)
9.下列电离方程式,书写正确的是
A.KMnO4==K++Mn7++4O2- B.NaHCO3 = Na+ + H+ + CO32-
C.AlCl3==Al3++Cl3- D.Al2(SO4)3==2Al3++3SO42-
10、下列实验操作中,不能用于物质分离的是
11.在盛有碘水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是
A.①是酒精,②是CCl4,③是苯
B.①是苯,②是CCl4,③是酒精
C.①是CCl4,②是苯,③是酒精
D.①是苯,②是酒精,③是CCl4
12.下列反应中属于氧化还原反应的离子方程式的是
A.CaCO3+2H+ = Ca2++CO2↑+H2O B.2Fe2++Cl2 = 2Fe3++2Cl(
C.HCO3(+H+ = CO2(+H2O D.Na2O+H2O = 2Na++2OH(
13. 下列实验操作正确的是
A.称量氢氧化钠固体 B.分离柴油和水
C.把饱和食盐水中的食盐提取出来 D.分离两种互溶但沸点相差较大的液体混合物
14、高铁酸钾()是一种新型、高效、多功能水处理剂。下列反应可制取:
2+3+10KOH2+6KCl+8H2O
对于该反应,下列说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.发生还原反应 D.是氧化剂
15.3月22日是 “世界水日”。下列各反应中,水作为还原剂的是
A、2H2+O2 2H2O B、SO3+H2O===H2SO4
C、2F2+2H2O===4HF+O2 D、2Na+2H2O===2NaOH+H2↑
16. 下列转化,需要加入氧化剂才能完成的是
A. H+ →H2 B. MnO4-→ Mn2+ C. CO 2→CO32- D. S2-→SO42-
17.某溶液中存在较多的H+、SO42-、C1-,该溶液中还可能大量存在的离子是
A.OH- B.Ba2+ C.NH4+ D.Ag+
18.在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、CO32-
19、下列的离子方程式正确的是
A.用大理石跟稀盐酸制二氧化碳:CO32-+ 2H+ == H2O + CO2↑
B.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
C.H2SO4溶液中滴入Ba(OH)2溶液:OH- + H+ == H2O
D.氧化镁与盐酸混合:MgO + 2H+ == Mg2+ + H2O
20.不能用H+ + OH- == H2O离子方程式表示的化学反应是
A.盐酸和氢氧化钾溶液的反应 B.硝酸和氢氧化铜溶液的反应
C.盐酸和澄清石灰水的反应 D.硫酸和氢氧化钠溶液反应
21.用NA表示阿伏加德罗常数的值,下列说法正确的是
A、标准状况下,11.2L的水中含有0.5个NA水分子
B、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Mg2+的个数为0.5NA
C、1 mol H2和O2的混合气体中含NA个分子
D、11.2L NH3中所含的原子数目为2NA
22、在反应KClO3+6HCl=KCl+3Cl2+3H2O中,被还原和被氧化的氯原子的质量比为
A.1 :6 B.6 :1 C.1 :5 D.5 :1
23.已知NH4+ + OH- NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
A、一定存在SO42-、CO32-、NH4+,可能存在Na+、K+、Cl-
B、一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C、c(CO32-)=0.01 mol/L,c(NH4+)>c(SO42-)
D、如果上述6种离子都存在,则c(Cl-)>c(SO42-)
第Ⅱ卷(非选择题 共31分)
24.(11分)某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
溶液中检测出的溶质
第一次
KCl、K2SO4 、Na2CO3、NaCl
第二次
KCl、BaCl2 、Na2CO3、NaCl
第三次
KCl、K2CO3、Na2SO4、NaCl
⑴三次检测结果中,第 次的结果肯定不正确。
⑵在检测时,为了确定溶液中是否存在SO42- 、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
实验步骤
实验操作
实验目的
反应的离子方程式
第一步
向溶液中滴加过量的硝酸
检验 ① 的存在
②
第二步
继续滴加过量的 ③ 溶液
检验SO42-的存在
④
第三步
过滤,再向滤液中滴加 ⑤ 溶液
检验 ⑥ 的存在
Ag++Cl- = AgCl↓
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
25.(7分)阅读下列材料后回答问题。
一个体重60 kg健康的成年人,体内约含有4 g铁,这4 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+Fe3+的转化时, ①中的Fe2+作________剂,
②中的Fe3+作___________剂。
(2)“服用维生素C,可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应中作___________剂,具有___________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_______________
(并用单线桥法标出该式中的电子转移方向和数目)。
26.(7分)氯化钠溶液在生产、生活中都有广泛的用途。现配置1 L 0.2 mol·L-1 NaCl溶液,请回答问题。
实验步骤
有关问题
(1)计算并称量
用托盘天平称量NaCl固体的质量为 g
(2)溶解
为加速溶解,可进行的操作是
(3)转移
指出示意图中的两处错误:
错误1:
错误2:
(4)洗涤
用少量蒸馏水洗涤 2~3次,并将洗涤液转移到容量瓶中
(5)定容
若俯视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度 (填“偏高”“偏低”或“无影响”)
27.(6分)将足量的锌投入200mL某浓度的盐酸中完全反应,生成的H2在标准状况下体积为1.12L。求:
(1)参加反应的锌的质量是多少?
(2)所用盐酸中HCl的物质的量浓度?
2013-2014学年第一学期期中考试高一化学参考答案
第I卷 选择题(共69分)
1~23单项选择题,每小题3分,共69分
1 C 2 D 3 D 4 C 5 C 6 A 7 C 8 B 9 D 10 C 11 A 12 B 13 C 14 D 15 C 16 D 17 C 18 A 19 D 20 B 21 C 22 C 23 D
第II卷 (共31分)
24、(11分)离子方程式为每空2分,其余每空1分
(1)二
(2)① CO32- ② 2H+ + CO32- = CO2↑ + H2O
③ Ba(NO3)2溶液 ④ Ba2+ + SO42- = BaSO4↓ ⑤ AgNO3溶液 ⑥ Cl-
(3)不能 若加入盐酸,则引入Cl-
25、(7分)离子方程式为每空2分,其余每空1分
(1)①还原剂 ②氧化剂
(2)还原剂 还原性
(3)Fe + 2H+ = Fe2+ + H2↑
单线桥转移2e-
26、(7分)除第(1)空2分外,其余每空1分
(1)11.7 (2) 玻璃棒搅拌
(3)未用玻璃棒引流;应用规格为1L的容量瓶
(4)烧杯和玻璃棒 (5) 偏高
27、(6分) 每小问3分
(1) 3.25 g
其中:方程式正确(1分)
式子列得正确(1分)
答案正确(1分)
0.5 mol/L
其中:式子列得正确(1分)
答案正确(2分)
高 一 化 学 2013.11
注意事项:
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间75分钟。
考生将第Ⅰ卷、第Ⅱ卷答案填涂在答卷纸上,答在试卷上无效。
可能用到的相对原子质量:H: 1 C: 12 O:16 N: 14 Cl:35.5 S:32
Na: 23 Mg: 24 Zn: 65 Ba 137
第Ⅰ卷(选择题 共69分)
单项选择题(本题包括23小题,每小题3分,共69分。每小题只有一个选项符合题意)
1.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A、木已成舟 B、铁杵成针 C、蜡炬成灰 D、滴水成冰
2.下列自然、生活中的事例不属于氧化还原反应的是
A.动物呼吸 B.植物光合作用 C.金属生锈 D.石膏点制豆腐
3.危险化学品要在包装标签上印有警示性标志。氢氧化钠应选用的标志是
4.分类法是一种简单易行、行之有效的科学方法。碳酸钠不属于
A.纯净物 B.化合物 C.氧化物 D.盐
5.下列各组物质中按酸、碱、盐顺序排列的是
?? A.HCl、NaOH、H2O???????????? B.NaCl、HCl、KOH
?? C.H2SO4、NaOH、NaCl?????????? D.HCl、Na2CO3、NaOH
6.下列物质中属于电解质的是
A.硫酸铜 B.氮气 C.酒精 D.蔗糖
7.下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.如图所示树林中的晨曦,该现象与丁达尔效应有关
8.小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是
A.溶解度(s) B.物质的量浓度(c)
C.质量分数(w) D.摩尔质量(M)
9.下列电离方程式,书写正确的是
A.KMnO4==K++Mn7++4O2- B.NaHCO3 = Na+ + H+ + CO32-
C.AlCl3==Al3++Cl3- D.Al2(SO4)3==2Al3++3SO42-
10、下列实验操作中,不能用于物质分离的是
11.在盛有碘水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是
A.①是酒精,②是CCl4,③是苯
B.①是苯,②是CCl4,③是酒精
C.①是CCl4,②是苯,③是酒精
D.①是苯,②是酒精,③是CCl4
12.下列反应中属于氧化还原反应的离子方程式的是
A.CaCO3+2H+ = Ca2++CO2↑+H2O B.2Fe2++Cl2 = 2Fe3++2Cl(
C.HCO3(+H+ = CO2(+H2O D.Na2O+H2O = 2Na++2OH(
13. 下列实验操作正确的是
A.称量氢氧化钠固体 B.分离柴油和水
C.把饱和食盐水中的食盐提取出来 D.分离两种互溶但沸点相差较大的液体混合物
14、高铁酸钾()是一种新型、高效、多功能水处理剂。下列反应可制取:
2+3+10KOH2+6KCl+8H2O
对于该反应,下列说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.发生还原反应 D.是氧化剂
15.3月22日是 “世界水日”。下列各反应中,水作为还原剂的是
A、2H2+O2 2H2O B、SO3+H2O===H2SO4
C、2F2+2H2O===4HF+O2 D、2Na+2H2O===2NaOH+H2↑
16. 下列转化,需要加入氧化剂才能完成的是
A. H+ →H2 B. MnO4-→ Mn2+ C. CO 2→CO32- D. S2-→SO42-
17.某溶液中存在较多的H+、SO42-、C1-,该溶液中还可能大量存在的离子是
A.OH- B.Ba2+ C.NH4+ D.Ag+
18.在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、CO32-
19、下列的离子方程式正确的是
A.用大理石跟稀盐酸制二氧化碳:CO32-+ 2H+ == H2O + CO2↑
B.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
C.H2SO4溶液中滴入Ba(OH)2溶液:OH- + H+ == H2O
D.氧化镁与盐酸混合:MgO + 2H+ == Mg2+ + H2O
20.不能用H+ + OH- == H2O离子方程式表示的化学反应是
A.盐酸和氢氧化钾溶液的反应 B.硝酸和氢氧化铜溶液的反应
C.盐酸和澄清石灰水的反应 D.硫酸和氢氧化钠溶液反应
21.用NA表示阿伏加德罗常数的值,下列说法正确的是
A、标准状况下,11.2L的水中含有0.5个NA水分子
B、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Mg2+的个数为0.5NA
C、1 mol H2和O2的混合气体中含NA个分子
D、11.2L NH3中所含的原子数目为2NA
22、在反应KClO3+6HCl=KCl+3Cl2+3H2O中,被还原和被氧化的氯原子的质量比为
A.1 :6 B.6 :1 C.1 :5 D.5 :1
23.已知NH4+ + OH- NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
A、一定存在SO42-、CO32-、NH4+,可能存在Na+、K+、Cl-
B、一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C、c(CO32-)=0.01 mol/L,c(NH4+)>c(SO42-)
D、如果上述6种离子都存在,则c(Cl-)>c(SO42-)
第Ⅱ卷(非选择题 共31分)
24.(11分)某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
溶液中检测出的溶质
第一次
KCl、K2SO4 、Na2CO3、NaCl
第二次
KCl、BaCl2 、Na2CO3、NaCl
第三次
KCl、K2CO3、Na2SO4、NaCl
⑴三次检测结果中,第 次的结果肯定不正确。
⑵在检测时,为了确定溶液中是否存在SO42- 、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
实验步骤
实验操作
实验目的
反应的离子方程式
第一步
向溶液中滴加过量的硝酸
检验 ① 的存在
②
第二步
继续滴加过量的 ③ 溶液
检验SO42-的存在
④
第三步
过滤,再向滤液中滴加 ⑤ 溶液
检验 ⑥ 的存在
Ag++Cl- = AgCl↓
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
25.(7分)阅读下列材料后回答问题。
一个体重60 kg健康的成年人,体内约含有4 g铁,这4 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+Fe3+的转化时, ①中的Fe2+作________剂,
②中的Fe3+作___________剂。
(2)“服用维生素C,可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应中作___________剂,具有___________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_______________
(并用单线桥法标出该式中的电子转移方向和数目)。
26.(7分)氯化钠溶液在生产、生活中都有广泛的用途。现配置1 L 0.2 mol·L-1 NaCl溶液,请回答问题。
实验步骤
有关问题
(1)计算并称量
用托盘天平称量NaCl固体的质量为 g
(2)溶解
为加速溶解,可进行的操作是
(3)转移
指出示意图中的两处错误:
错误1:
错误2:
(4)洗涤
用少量蒸馏水洗涤 2~3次,并将洗涤液转移到容量瓶中
(5)定容
若俯视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度 (填“偏高”“偏低”或“无影响”)
27.(6分)将足量的锌投入200mL某浓度的盐酸中完全反应,生成的H2在标准状况下体积为1.12L。求:
(1)参加反应的锌的质量是多少?
(2)所用盐酸中HCl的物质的量浓度?
2013-2014学年第一学期期中考试高一化学参考答案
第I卷 选择题(共69分)
1~23单项选择题,每小题3分,共69分
1 C 2 D 3 D 4 C 5 C 6 A 7 C 8 B 9 D 10 C 11 A 12 B 13 C 14 D 15 C 16 D 17 C 18 A 19 D 20 B 21 C 22 C 23 D
第II卷 (共31分)
24、(11分)离子方程式为每空2分,其余每空1分
(1)二
(2)① CO32- ② 2H+ + CO32- = CO2↑ + H2O
③ Ba(NO3)2溶液 ④ Ba2+ + SO42- = BaSO4↓ ⑤ AgNO3溶液 ⑥ Cl-
(3)不能 若加入盐酸,则引入Cl-
25、(7分)离子方程式为每空2分,其余每空1分
(1)①还原剂 ②氧化剂
(2)还原剂 还原性
(3)Fe + 2H+ = Fe2+ + H2↑
单线桥转移2e-
26、(7分)除第(1)空2分外,其余每空1分
(1)11.7 (2) 玻璃棒搅拌
(3)未用玻璃棒引流;应用规格为1L的容量瓶
(4)烧杯和玻璃棒 (5) 偏高
27、(6分) 每小问3分
(1) 3.25 g
其中:方程式正确(1分)
式子列得正确(1分)
答案正确(1分)
0.5 mol/L
其中:式子列得正确(1分)
答案正确(2分)
同课章节目录
