2022-2023学年高二上学期人教版(2019)化学选择性必修1-3.2.3 酸碱中和滴定(操作及误差分析)课件(20张PPT)
文档属性
| 名称 | 2022-2023学年高二上学期人教版(2019)化学选择性必修1-3.2.3 酸碱中和滴定(操作及误差分析)课件(20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 491.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-07 11:59:29 | ||
图片预览




文档简介
(共20张PPT)
第三章 水溶液中的离子反应与平衡
第二节第3课时 酸碱中和滴定
高二化学
(酸碱中和滴定的操作及误差分析)
【学习任务一】酸碱中和滴定的实验操作:
教材P91实验活动2
【实验步骤】
1.练习中和滴定的实验操作;理解中和滴定的原量;探究酸碱中和反应过程中PH的变化。
2.通过实验进一步掌握数据分析的方法,体会定量实验在化学研究中的作用。
【实验用品】
酸、碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台。
0.1000mol/LHCl溶液、0.1000mol/LNaOH左右的溶液、酚酞溶液、蒸馏水。
【实验目的】
(2)滴定阶段:
(3)数据处理阶段:
(1)准备阶段:
①检查是否漏水
②水洗、润洗
③装液、固定、赶气泡、调液面
④记录初读数V酸前
⑩计算待测液浓度
⑨记录末读数V酸后
⑧滴加最后一滴标准液直至颜色发生变化,且半分钟不变
⑥取待测液V(待)
⑦加指示剂
⑤水洗
滴定管:
锥形瓶:
小结:中和滴定步骤
c(标)·V(标)
V(待)
=
c(待 )
无润洗!
锥形瓶不能用待测液润洗
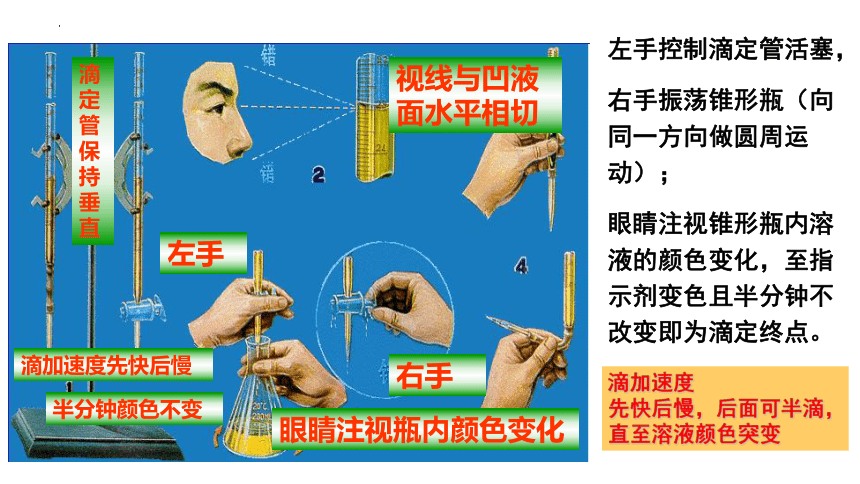
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
左手控制滴定管活塞,
右手振荡锥形瓶(向同一方向做圆周运动);
眼睛注视锥形瓶内溶液的颜色变化,至指示剂变色且半分钟不改变即为滴定终点。
滴加速度
先快后慢,后面可半滴,
直至溶液颜色突变
【学习任务一】酸碱中和滴定的实验操作:
注意事项
1.中和滴定前,必须用滴定液多次润洗滴定管,以确保溶液的浓度不被剩余在滴定管中的 水稀释变小;
2.中和滴定前,气泡的存在使液面上升,读数变小,为减少实验误差必须赶出气泡;
3.加入指示剂的量控制在2~3滴,以避免指示剂消耗酸或碱而引起误差;
4.锥形瓶不能润洗,否则润洗后残留在锥形瓶中的溶质将引起误差;
5.锥形瓶下垫一张白纸的作用:便于观察溶液颜色的变化,减少误差;
6.滴速:先快后慢,当接近终点时,为了避免过量,应一滴一摇,甚至半滴一摇,利用锥 形瓶内壁“刮”下尖嘴处悬挂的半滴溶液;
7.终点判断:滴入最后一滴标准液,指示剂变色,且在半分钟内不变回原色,视为滴定终点;
8.数据处理:重视测定结果的复核,为减少实验误差,重复实验2~3次,异常数值应去掉,求出所用标准溶液体积的平均值,然后再计算待测液的物质的量浓度。
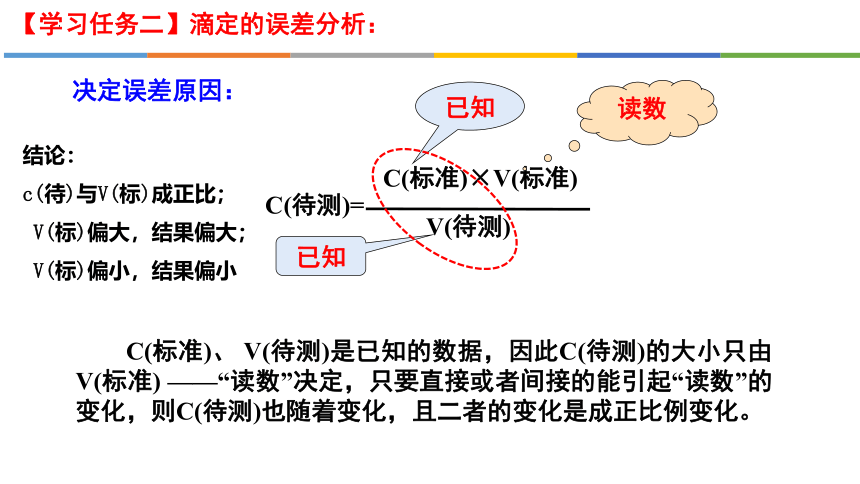
【学习任务二】滴定的误差分析:
C(待测)=
C(标准)×V(标准)
V(待测)
C(标准)、 V(待测)是已知的数据,因此C(待测)的大小只由V(标准) ——“读数”决定,只要直接或者间接的能引起“读数”的变化,则C(待测)也随着变化,且二者的变化是成正比例变化。
已知
已知
读数
决定误差原因:
结论:
c(待)与V(标)成正比;
V(标)偏大,结果偏大;
V(标)偏小,结果偏小
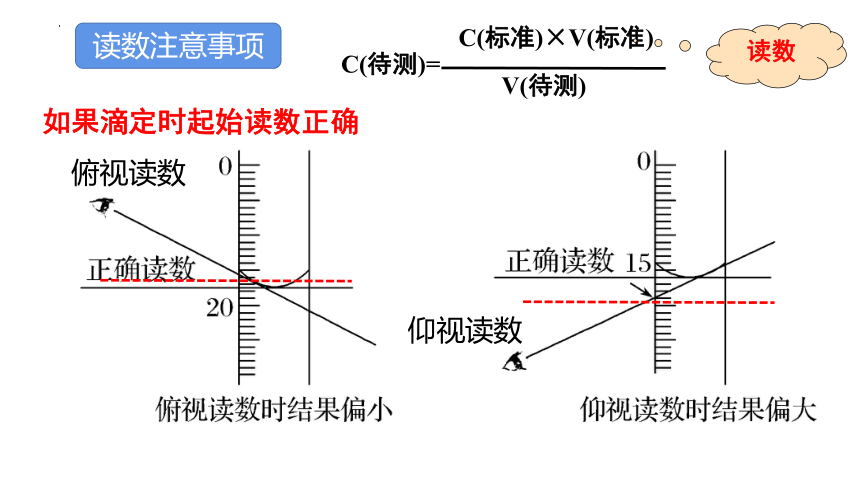
读数注意事项
俯视读数
仰视读数
如果滴定时起始读数正确
C(待测)=
C(标准)×V(标准)
V(待测)
读数
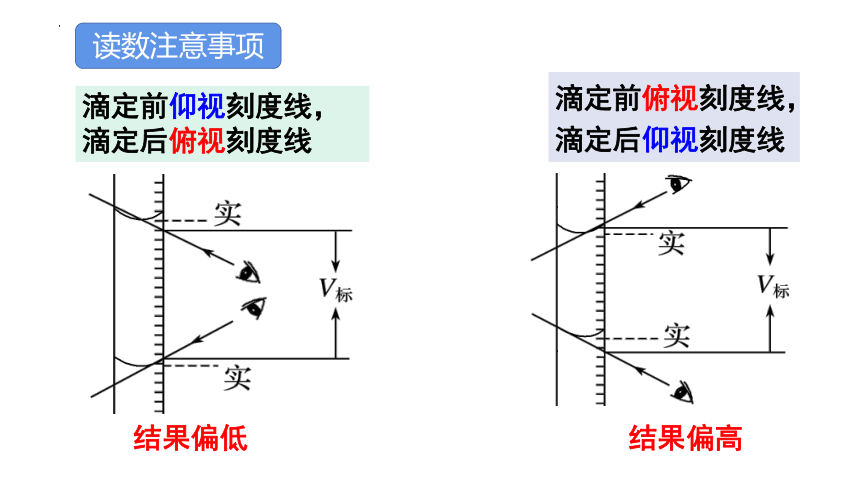
读数注意事项
滴定前仰视刻度线,滴定后俯视刻度线
结果偏低
滴定前俯视刻度线,滴定后仰视刻度线
结果偏高
【学习任务二】滴定的误差分析:
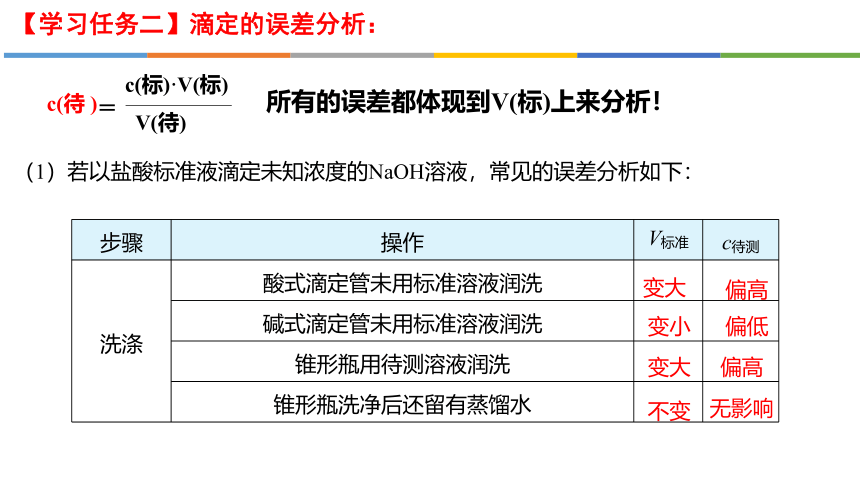
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
洗涤 酸式滴定管未用标准溶液润洗
碱式滴定管未用标准溶液润洗
锥形瓶用待测溶液润洗
锥形瓶洗净后还留有蒸馏水
变大
偏高
变小
偏低
变大
偏高
不变
无影响
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失
变小
偏低
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失
振荡锥形瓶时部分液体溅出
部分酸液滴出锥形瓶外
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化
变大
偏高
变小
偏低
变大
偏高
变大
偏高
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯)
滴定前读数正确,滴定后仰视读数(或前俯后仰)
变小
偏低
变大
偏高
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
配制NaOH 标准液 NaOH固体部分潮解
NaOH固体中含有不与酸反应的杂质
NaOH固体中含有与酸反应的杂质(Na2CO3)
NaOH固体中含有与酸反应的杂质(Na2O)
变大
偏高
变大
偏高
变大
偏高
变小
偏低
(1)滴定终点就是酸碱恰好中和的点_________。
(2)滴定管盛标准溶液时,调液面一定要调到“0”刻度________。
(3)KMnO4溶液应用碱式滴定管盛装 ________。
(4)用碱式滴定管准确量取20.00 mL的NaOH溶液________。
(5)将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL_____。
(6)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL________。
(7)中和滴定实验时,滴定管、锥形瓶均用待测液润洗________。
【课堂评价】
×
×
×
√
×
×
×
【课堂评价】
×
(8)用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂________。
(9)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 ________。
(10)用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 ________。
(11)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH________。
(12)等体积、等物质的量浓度的盐酸和醋酸分别与NaOH溶液反应,得到pH=7的溶液所消耗的n(NaOH)相等________。
(13)用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时为滴定终点________。
√
×
×
×
√
【课堂评价】
用0.2000mol·L-1的标准NaOH溶液滴定20.00mL未知浓度的盐酸,用酚酞做指示剂,所得实验数据如下,请回答下列问题。
滴定次数 盐酸体积 消耗NaOH溶液体积
1 20.00 18.10
2 20.00 16.20
3 20.00 16.16
(1)量取20.00mL待测液应使用______________(填仪器名称);
(2)由表可知,第一次消耗NaOH溶液体积偏大,其可能的原因是____;
A. 锥形瓶装液前留有少量蒸馏水 B. 滴定结束时,仰视计数
C. 滴定前滴定管尖嘴有气泡,滴定结束无气泡
D. 滴定过程刚变色就立即停止滴定
(3)到达滴定终点的依据是______________________________________
________________________________________________________。
(4)根据表中记录数据,计算该盐酸浓度为_______mol/L。
酸式滴定管
BC
当滴入最后半滴标准液时,溶液由无色变为浅红色,且半分钟内不恢复为原来的颜色。
0.1618
【课堂评价】
【变1】在一支50 mL酸式滴定管中盛入0.1 mol/L HCl溶液,其液面恰好在20 mL刻度处。若把滴定管中的溶液全部放入锥形瓶中,滴人3滴酚酞试液,然后以0.1 mol/L NaOH溶液进行滴定,当溶液刚好变为浅红色时,消耗NaOH镕液的体积
A.等于20 mL D.小于20 mL C.等于30 mL D.大于30 ml
D
【课堂评价】
【变2】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是
①用天平称量氢氧化钠固体时,将小烧杯放在右盘,砝码放在左盘,并移动游码使之平衡
②配制烧碱溶液时,将称量后的氢氧化钠固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线
③滴定前滴定管中无气泡,滴定后有气泡
④酸式滴定管用蒸馏水洗后,未用标准液润洗
⑤读取滴定管终点读数时,仰视刻度线
A.①②③④⑤ B.②③④⑤ C.②④⑤ D.③④⑤
C
【变4-1】下图是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是
A.酚酞不能用作本实验的指示剂
B.盐酸的物质的量浓度为1 mol·L-1
C.P点时恰好完全中和,溶液呈中性
D.曲线b是氢氧化钠溶液滴定盐酸的曲线
C
【课堂评价】
4.依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品,配成100 mL待测溶液,②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
(1)如何知道滴定到达终点?__________________________________________________________
下列操作会导致测定结果偏低的是_____________
A.盛标准溶液的滴定管用蒸馏水洗后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有 ;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
当滴入最后一滴KMnO4溶液时,由浅绿色变为紫红色,且半分钟后不变色
C
AD
【拓展延伸】
第三章 水溶液中的离子反应与平衡
第二节第3课时 酸碱中和滴定
高二化学
(酸碱中和滴定的操作及误差分析)
【学习任务一】酸碱中和滴定的实验操作:
教材P91实验活动2
【实验步骤】
1.练习中和滴定的实验操作;理解中和滴定的原量;探究酸碱中和反应过程中PH的变化。
2.通过实验进一步掌握数据分析的方法,体会定量实验在化学研究中的作用。
【实验用品】
酸、碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台。
0.1000mol/LHCl溶液、0.1000mol/LNaOH左右的溶液、酚酞溶液、蒸馏水。
【实验目的】
(2)滴定阶段:
(3)数据处理阶段:
(1)准备阶段:
①检查是否漏水
②水洗、润洗
③装液、固定、赶气泡、调液面
④记录初读数V酸前
⑩计算待测液浓度
⑨记录末读数V酸后
⑧滴加最后一滴标准液直至颜色发生变化,且半分钟不变
⑥取待测液V(待)
⑦加指示剂
⑤水洗
滴定管:
锥形瓶:
小结:中和滴定步骤
c(标)·V(标)
V(待)
=
c(待 )
无润洗!
锥形瓶不能用待测液润洗
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
左手控制滴定管活塞,
右手振荡锥形瓶(向同一方向做圆周运动);
眼睛注视锥形瓶内溶液的颜色变化,至指示剂变色且半分钟不改变即为滴定终点。
滴加速度
先快后慢,后面可半滴,
直至溶液颜色突变
【学习任务一】酸碱中和滴定的实验操作:
注意事项
1.中和滴定前,必须用滴定液多次润洗滴定管,以确保溶液的浓度不被剩余在滴定管中的 水稀释变小;
2.中和滴定前,气泡的存在使液面上升,读数变小,为减少实验误差必须赶出气泡;
3.加入指示剂的量控制在2~3滴,以避免指示剂消耗酸或碱而引起误差;
4.锥形瓶不能润洗,否则润洗后残留在锥形瓶中的溶质将引起误差;
5.锥形瓶下垫一张白纸的作用:便于观察溶液颜色的变化,减少误差;
6.滴速:先快后慢,当接近终点时,为了避免过量,应一滴一摇,甚至半滴一摇,利用锥 形瓶内壁“刮”下尖嘴处悬挂的半滴溶液;
7.终点判断:滴入最后一滴标准液,指示剂变色,且在半分钟内不变回原色,视为滴定终点;
8.数据处理:重视测定结果的复核,为减少实验误差,重复实验2~3次,异常数值应去掉,求出所用标准溶液体积的平均值,然后再计算待测液的物质的量浓度。
【学习任务二】滴定的误差分析:
C(待测)=
C(标准)×V(标准)
V(待测)
C(标准)、 V(待测)是已知的数据,因此C(待测)的大小只由V(标准) ——“读数”决定,只要直接或者间接的能引起“读数”的变化,则C(待测)也随着变化,且二者的变化是成正比例变化。
已知
已知
读数
决定误差原因:
结论:
c(待)与V(标)成正比;
V(标)偏大,结果偏大;
V(标)偏小,结果偏小
读数注意事项
俯视读数
仰视读数
如果滴定时起始读数正确
C(待测)=
C(标准)×V(标准)
V(待测)
读数
读数注意事项
滴定前仰视刻度线,滴定后俯视刻度线
结果偏低
滴定前俯视刻度线,滴定后仰视刻度线
结果偏高
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
洗涤 酸式滴定管未用标准溶液润洗
碱式滴定管未用标准溶液润洗
锥形瓶用待测溶液润洗
锥形瓶洗净后还留有蒸馏水
变大
偏高
变小
偏低
变大
偏高
不变
无影响
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失
变小
偏低
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失
振荡锥形瓶时部分液体溅出
部分酸液滴出锥形瓶外
溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化
变大
偏高
变小
偏低
变大
偏高
变大
偏高
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
读数 滴定前读数正确,滴定后俯视读数(或前仰后俯)
滴定前读数正确,滴定后仰视读数(或前俯后仰)
变小
偏低
变大
偏高
【学习任务二】滴定的误差分析:
(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V(标)上来分析!
步骤 操作 V标准 c待测
配制NaOH 标准液 NaOH固体部分潮解
NaOH固体中含有不与酸反应的杂质
NaOH固体中含有与酸反应的杂质(Na2CO3)
NaOH固体中含有与酸反应的杂质(Na2O)
变大
偏高
变大
偏高
变大
偏高
变小
偏低
(1)滴定终点就是酸碱恰好中和的点_________。
(2)滴定管盛标准溶液时,调液面一定要调到“0”刻度________。
(3)KMnO4溶液应用碱式滴定管盛装 ________。
(4)用碱式滴定管准确量取20.00 mL的NaOH溶液________。
(5)将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL_____。
(6)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL________。
(7)中和滴定实验时,滴定管、锥形瓶均用待测液润洗________。
【课堂评价】
×
×
×
√
×
×
×
【课堂评价】
×
(8)用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂________。
(9)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 ________。
(10)用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 ________。
(11)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH________。
(12)等体积、等物质的量浓度的盐酸和醋酸分别与NaOH溶液反应,得到pH=7的溶液所消耗的n(NaOH)相等________。
(13)用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时为滴定终点________。
√
×
×
×
√
【课堂评价】
用0.2000mol·L-1的标准NaOH溶液滴定20.00mL未知浓度的盐酸,用酚酞做指示剂,所得实验数据如下,请回答下列问题。
滴定次数 盐酸体积 消耗NaOH溶液体积
1 20.00 18.10
2 20.00 16.20
3 20.00 16.16
(1)量取20.00mL待测液应使用______________(填仪器名称);
(2)由表可知,第一次消耗NaOH溶液体积偏大,其可能的原因是____;
A. 锥形瓶装液前留有少量蒸馏水 B. 滴定结束时,仰视计数
C. 滴定前滴定管尖嘴有气泡,滴定结束无气泡
D. 滴定过程刚变色就立即停止滴定
(3)到达滴定终点的依据是______________________________________
________________________________________________________。
(4)根据表中记录数据,计算该盐酸浓度为_______mol/L。
酸式滴定管
BC
当滴入最后半滴标准液时,溶液由无色变为浅红色,且半分钟内不恢复为原来的颜色。
0.1618
【课堂评价】
【变1】在一支50 mL酸式滴定管中盛入0.1 mol/L HCl溶液,其液面恰好在20 mL刻度处。若把滴定管中的溶液全部放入锥形瓶中,滴人3滴酚酞试液,然后以0.1 mol/L NaOH溶液进行滴定,当溶液刚好变为浅红色时,消耗NaOH镕液的体积
A.等于20 mL D.小于20 mL C.等于30 mL D.大于30 ml
D
【课堂评价】
【变2】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是
①用天平称量氢氧化钠固体时,将小烧杯放在右盘,砝码放在左盘,并移动游码使之平衡
②配制烧碱溶液时,将称量后的氢氧化钠固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线
③滴定前滴定管中无气泡,滴定后有气泡
④酸式滴定管用蒸馏水洗后,未用标准液润洗
⑤读取滴定管终点读数时,仰视刻度线
A.①②③④⑤ B.②③④⑤ C.②④⑤ D.③④⑤
C
【变4-1】下图是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是
A.酚酞不能用作本实验的指示剂
B.盐酸的物质的量浓度为1 mol·L-1
C.P点时恰好完全中和,溶液呈中性
D.曲线b是氢氧化钠溶液滴定盐酸的曲线
C
【课堂评价】
4.依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品,配成100 mL待测溶液,②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
(1)如何知道滴定到达终点?__________________________________________________________
下列操作会导致测定结果偏低的是_____________
A.盛标准溶液的滴定管用蒸馏水洗后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有 ;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
当滴入最后一滴KMnO4溶液时,由浅绿色变为紫红色,且半分钟后不变色
C
AD
【拓展延伸】
