3.1.3铁盐和亚铁盐(教学课件)-高中化学人教版(2019)必修第一册(23张)
文档属性
| 名称 | 3.1.3铁盐和亚铁盐(教学课件)-高中化学人教版(2019)必修第一册(23张) |  | |
| 格式 | pptx | ||
| 文件大小 | 63.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-08 09:08:05 | ||
图片预览








文档简介
(共23张PPT)
第一节
铁及其化合物
第三章 铁 金属材料
第3课时 铁盐和亚铁盐
02 Fe3+、Fe2+的性质
01 Fe3+的检验方法
03 自主练习
常见的铁盐和亚铁盐
硫酸亚铁
硫酸亚铁溶液
氯化亚铁
硫酸铁
硫酸铁溶液
氯化铁
氯化铁
溶液
01
Fe3+的检验方法
Fe3+的检验方法
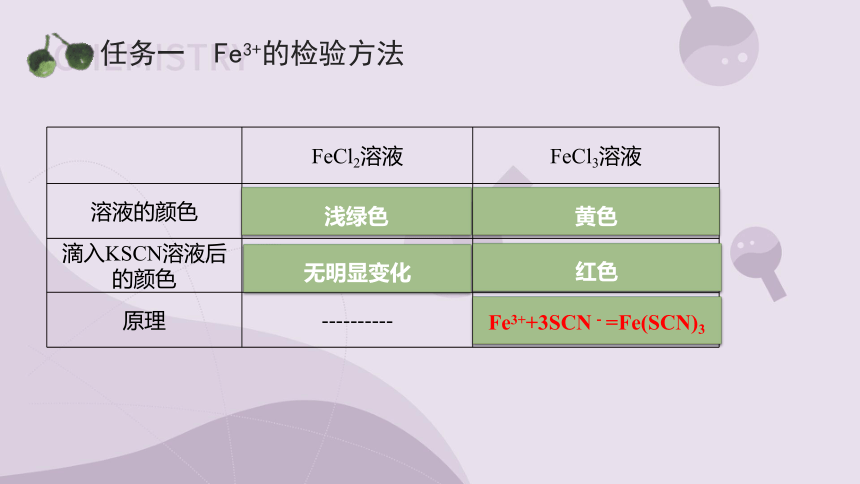
任务一 Fe3+的检验方法
FeCl2溶液 FeCl3溶液
溶液的颜色
滴入KSCN溶液后的颜色
原理 ----------
浅绿色
黄色
无明显变化
红色
Fe3++3SCN-=Fe(SCN)3
思考讨论
如何检验Fe3+?
Fe3+的检验方法:
①滴加KSCN溶液,溶液立即变为红色。
②加入NaOH溶液,立即出现红褐色沉淀。
思考讨论
实验室如何保存硫酸亚铁溶液?为什么?
常加入铁粉,为防止硫酸亚铁氧化。
02
Fe3+、Fe2+的性质
Fe3+、Fe2+的性质
实验操作 现象 反应的离子方程式
FeCl3溶液滴入KSCN溶液,加入铁粉
取适量上层清液加氯水,振荡
Fe3+、Fe2+的性质
溶液先变为血红色,加入铁粉后血红色褪色
溶液又为血红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=3Fe3++2Cl—
Fe3+、Fe2+的性质
1.根据Fe3+和Fe2+的化合价判断,Fe3+只具有氧化性,Fe2+具有氧化性和还原性。
2.Fe3+和Fe2+的转化
Fe3+ Fe2+
①Fe ②Cu
③Cl2
学以致用
如何检验Fe2+
检验Fe2+的方法:
①滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变为红色。
②加入NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。
利用覆铜板制作图案
将设计好的覆铜板放入氯化铁溶液中
铁三角
03
自主练习
1.下列有关Fe2+及Fe3+的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液,溶液变为红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液,得到白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
C
2.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
A.用如图装置可以制备Fe(OH)2
B.FeCl3溶液中含有FeCl2杂质,可向溶液中通入氯气除去
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+
D.Fe(OH)2暴露在空气中很容易被氧化
C
3. FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定含Cu2+
B.溶液中一定含Fe2+
C.加入KSCN溶液一定不变红色
D.剩余固体中一定含Cu
A
4. 在一些茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可以看到灰黑色粉末,其中有些已变成棕褐色。将上述粉末溶于稀盐酸,取上层清液,滴入几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是( )
A.该灰黑色粉末用作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
D
5.几种物质间的相互转化关系如图所示:
(1)A转化为B及气体的反应中应加入的试剂是______(填化学式)。
HCl
(2)写出B的化学式:_______,F的化学式:_____。
(3)写出G→H的化学方程式:___________________________________。
(4)写出检验D溶液中金属阳离子的方法:
___________________________;
向D溶液中加入A,发生反应的离子方程式是
___________________。
FeCl2
KCl
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe3++3SCN-=Fe(SCN)3
2Fe3++Fe=3Fe2+
谢谢观看
第一节
铁及其化合物
第三章 铁 金属材料
第3课时 铁盐和亚铁盐
02 Fe3+、Fe2+的性质
01 Fe3+的检验方法
03 自主练习
常见的铁盐和亚铁盐
硫酸亚铁
硫酸亚铁溶液
氯化亚铁
硫酸铁
硫酸铁溶液
氯化铁
氯化铁
溶液
01
Fe3+的检验方法
Fe3+的检验方法
任务一 Fe3+的检验方法
FeCl2溶液 FeCl3溶液
溶液的颜色
滴入KSCN溶液后的颜色
原理 ----------
浅绿色
黄色
无明显变化
红色
Fe3++3SCN-=Fe(SCN)3
思考讨论
如何检验Fe3+?
Fe3+的检验方法:
①滴加KSCN溶液,溶液立即变为红色。
②加入NaOH溶液,立即出现红褐色沉淀。
思考讨论
实验室如何保存硫酸亚铁溶液?为什么?
常加入铁粉,为防止硫酸亚铁氧化。
02
Fe3+、Fe2+的性质
Fe3+、Fe2+的性质
实验操作 现象 反应的离子方程式
FeCl3溶液滴入KSCN溶液,加入铁粉
取适量上层清液加氯水,振荡
Fe3+、Fe2+的性质
溶液先变为血红色,加入铁粉后血红色褪色
溶液又为血红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=3Fe3++2Cl—
Fe3+、Fe2+的性质
1.根据Fe3+和Fe2+的化合价判断,Fe3+只具有氧化性,Fe2+具有氧化性和还原性。
2.Fe3+和Fe2+的转化
Fe3+ Fe2+
①Fe ②Cu
③Cl2
学以致用
如何检验Fe2+
检验Fe2+的方法:
①滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变为红色。
②加入NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。
利用覆铜板制作图案
将设计好的覆铜板放入氯化铁溶液中
铁三角
03
自主练习
1.下列有关Fe2+及Fe3+的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液,溶液变为红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液,得到白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
C
2.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
A.用如图装置可以制备Fe(OH)2
B.FeCl3溶液中含有FeCl2杂质,可向溶液中通入氯气除去
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+
D.Fe(OH)2暴露在空气中很容易被氧化
C
3. FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定含Cu2+
B.溶液中一定含Fe2+
C.加入KSCN溶液一定不变红色
D.剩余固体中一定含Cu
A
4. 在一些茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可以看到灰黑色粉末,其中有些已变成棕褐色。将上述粉末溶于稀盐酸,取上层清液,滴入几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是( )
A.该灰黑色粉末用作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
D
5.几种物质间的相互转化关系如图所示:
(1)A转化为B及气体的反应中应加入的试剂是______(填化学式)。
HCl
(2)写出B的化学式:_______,F的化学式:_____。
(3)写出G→H的化学方程式:___________________________________。
(4)写出检验D溶液中金属阳离子的方法:
___________________________;
向D溶液中加入A,发生反应的离子方程式是
___________________。
FeCl2
KCl
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe3++3SCN-=Fe(SCN)3
2Fe3++Fe=3Fe2+
谢谢观看
