高中化学人教版(2019)必修第一册3.2.1铁合金 铝和铝合金(共31张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册3.2.1铁合金 铝和铝合金(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-08 10:51:42 | ||
图片预览









文档简介
(共31张PPT)
第二节
金属材料
第三章 铁 金属材料
第1课时 铁合金 铝和铝合金
02 铁合金
01 认识合金
03 铝和铝合金
04 自主练习
常见的金属材料
氯化铁
氯化铁
溶液
01
认识合金
任务一 认识合金
回顾合金的概念。
阅读教材,总结合金的物理性质,讨论、分析合金的性质是通过什么方法调节的。
阅读教材,从微观结构探讨合金物理性质如硬度与纯金属的不同。
认识合金
1.金属材料:包括纯金属和它们的合金。
2.合金的性能:具有许多优良的物理、化学或机械性能,如合金的硬 度、熔点不同于其成分金属。
(1)性能变化
①熔点:常见合金的熔点低于其成分金属;
②硬度:常见合金的硬度大于其成分金属。
认识合金
(2)调节方法
通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
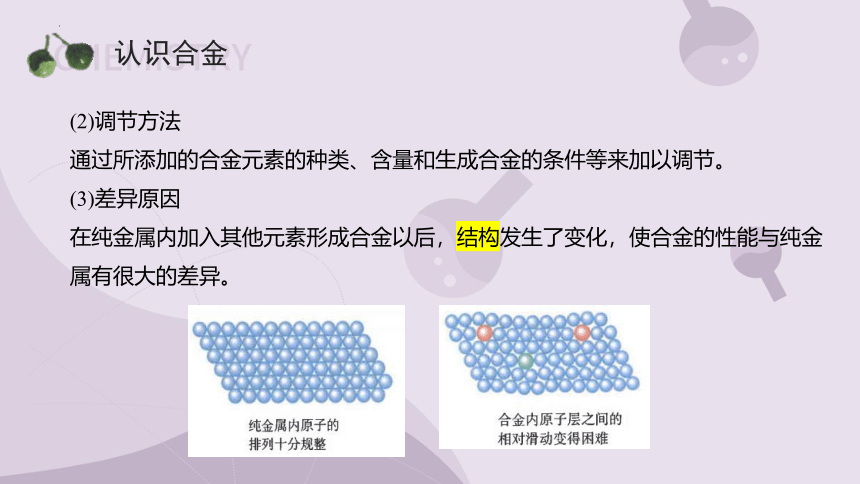
(3)差异原因
在纯金属内加入其他元素形成合金以后,结构发生了变化,使合金的性能与纯金属有很大的差异。
学以致用
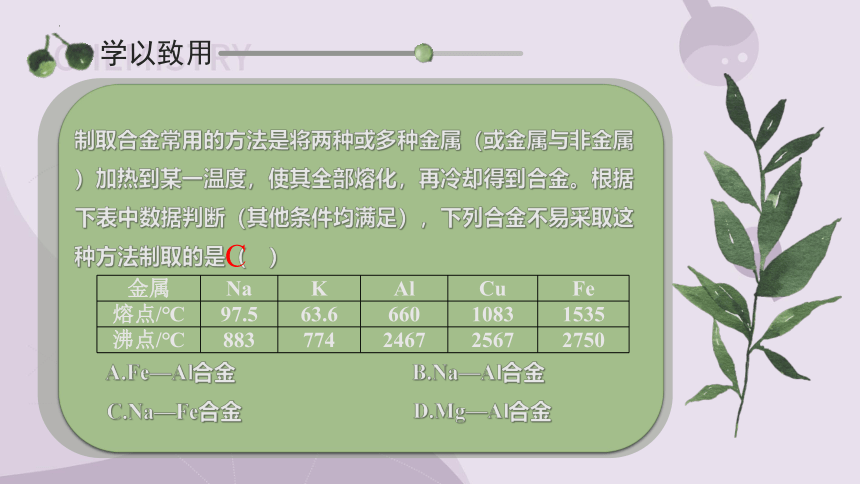
制取合金常用的方法是将两种或多种金属(或金属与非金属)加热到某一温度,使其全部熔化,再冷却得到合金。根据下表中数据判断(其他条件均满足),下列合金不易采取这种方法制取的是( )
A.Fe—Al合金 B.Na—Al合金
C.Na—Fe合金 D.Mg—Al合金
金属 Na K Al Cu Fe
熔点/℃ 97.5 63.6 660 1083 1535
沸点/℃ 883 774 2467 2567 2750
C
02
铁合金
任务二 认识生铁和钢
阅读教材,列表比较生铁和钢在组成、性能上的差异。
阅读教材的资料卡片,对比碳素钢和合金钢的异同,学习跟那个中合金元素的性质,讨论合金钢的特殊组成,讨论不锈钢的性能。
铁合金
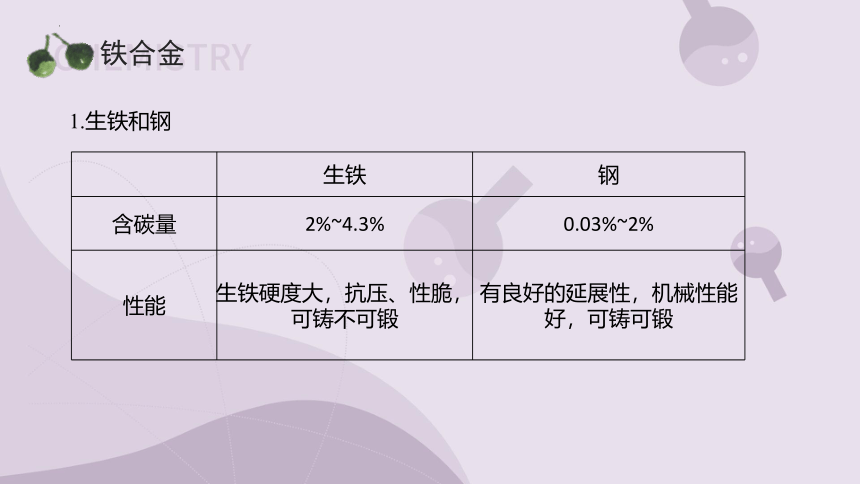
1.生铁和钢
生铁 钢
含碳量 2%~4.3% 0.03%~2%
性能 生铁硬度大,抗压、性脆,可铸不可锻
有良好的延展性,机械性能好,可铸可锻
铁合金
2.钢
碳素钢 合金钢
相同点 都是合金
不同点 含碳量较低的碳合金 在碳素钢中加入了合金元素(不锈钢一般加入镍和铬)
性能 含碳的碳素钢,硬度大;含碳量低的碳素钢,韧性强 不锈钢在空气中比较稳定,不易生锈,具有很强的抗腐蚀能力
思考讨论
P75 在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这对你有什么启示?
物质组成成分的种类和百分含量都对物质的性质有重大影响。在合金的冶炼中,可以根据实际需求,通过调节合金元素的种类和百分含量,制成具有不同性能的合金。
03
铝和铝合金
任务三 认识铝和铝合金
阅读教材,讨论铝的金属性强弱,讨论铝制品为什么不易生锈?
阅读资料卡片,知道铝制品表面的处理方法,思考铝制品表面为什么要进行处理?
铝
1.铝的物理性质
铝是地壳中含量最多的金属元素,单质铝具有金属的一般物理性质,是银白色固体,具有良好的导电性、导热性和延展性。
2.铝是一种活泼金属,在常温下就能与空气中的氧气发生反应,表面生产 一层致密的氧化铝薄膜。
4Al + 3O2 = 2Al2O3
【实验3-4】
完成实验,探究铝与盐酸发生的反应,分析教材是如何检验生成的气体?讨论氧化膜为什么没有保护铝?发生了哪些反应?练习书写化学方程式。
【实验3-4】
实验 现象
方程式
铝片逐渐溶解,有无色气泡冒出;将点燃的木条放在试管口有爆鸣声
Al2O3+6H+==2Al3++3H2O、2Al+6H+==2Al3++3H2↑
Al2O3+6HCl==2AlCl3+3H2O、2Al+6HCl==2AlCl3+3H2↑
【实验3-5】
完成实验,为什么未打磨的铝片不立即生成氢气,二是一段时间后生成气泡?练习书写化学方程式。
【实验3-5】
实验 现象
方程式
试管①中一开始无气泡产生,一段时间后,铝片溶解,有无色气泡冒出。
试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有爆鸣声。
Al2O3+2OH- =2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2- +3H2↑
Al2O3+2NaOH=2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑
两性氧化物
像Al2O3这类既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。写出Al2O3分别与盐酸、NaOH溶液反应的离子方程式:
【生活常识】由于Al和 Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
两性氧化物
像Al2O3这类既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。写出Al2O3分别与盐酸、NaOH溶液反应的离子方程式:
【生活常识】由于Al和 Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
铝合金
1.制备:向铝中加入少量的合金元素,可制成铝合金;
2.应用:铝合金是目前用途广泛的合金之一,如硬铝(含Cu、Mg、Mn、Si)的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
04
自主练习
1. 沈括根据变法需要,悉心总结了兵器制作技术。《梦溪笔谈·器用》中记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折。剑之钢者,刃多毁缺,巨阙是也,故不可纯用剂钢。”以所学合金的知识,分析古人铸剑时剑身的材料为( )
A.钢 B.生铁
C.青铜 D.白铜
A
2.下表中四种金属的熔、沸点:
其中不能形成合金的是( )
①Cu与Na ②Fe与Cu ③Fe与Na ④Al与Na
A.①② B.①③
C.①④ D.②④
C
金属 Na Cu Al Fe
熔点/℃ 97.8 1 083 660 1 535
沸点/℃ 883 2 567 2 467 2 750
3.中国国产大型客机C919机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
D
4. 为了除去MgO中混有的少量杂质Al2O3,可选用的试剂是( )
A.KOH溶液
B.氨水
C.稀盐酸
D.稀醋酸
A
5. 用铁、铝的混合物进行如下实验:
(1)操作X的名称是_____。
(2)①、②的离子方程式为________________________________,
过滤
2Al+2OH-+2H2O=2AlO2-+3H2↑
____________________。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_______(填“氧化剂”或“还原剂”)。
Fe+2H+===Fe2++H2↑
HCl
还原剂
谢谢观看
第二节
金属材料
第三章 铁 金属材料
第1课时 铁合金 铝和铝合金
02 铁合金
01 认识合金
03 铝和铝合金
04 自主练习
常见的金属材料
氯化铁
氯化铁
溶液
01
认识合金
任务一 认识合金
回顾合金的概念。
阅读教材,总结合金的物理性质,讨论、分析合金的性质是通过什么方法调节的。
阅读教材,从微观结构探讨合金物理性质如硬度与纯金属的不同。
认识合金
1.金属材料:包括纯金属和它们的合金。
2.合金的性能:具有许多优良的物理、化学或机械性能,如合金的硬 度、熔点不同于其成分金属。
(1)性能变化
①熔点:常见合金的熔点低于其成分金属;
②硬度:常见合金的硬度大于其成分金属。
认识合金
(2)调节方法
通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
(3)差异原因
在纯金属内加入其他元素形成合金以后,结构发生了变化,使合金的性能与纯金属有很大的差异。
学以致用
制取合金常用的方法是将两种或多种金属(或金属与非金属)加热到某一温度,使其全部熔化,再冷却得到合金。根据下表中数据判断(其他条件均满足),下列合金不易采取这种方法制取的是( )
A.Fe—Al合金 B.Na—Al合金
C.Na—Fe合金 D.Mg—Al合金
金属 Na K Al Cu Fe
熔点/℃ 97.5 63.6 660 1083 1535
沸点/℃ 883 774 2467 2567 2750
C
02
铁合金
任务二 认识生铁和钢
阅读教材,列表比较生铁和钢在组成、性能上的差异。
阅读教材的资料卡片,对比碳素钢和合金钢的异同,学习跟那个中合金元素的性质,讨论合金钢的特殊组成,讨论不锈钢的性能。
铁合金
1.生铁和钢
生铁 钢
含碳量 2%~4.3% 0.03%~2%
性能 生铁硬度大,抗压、性脆,可铸不可锻
有良好的延展性,机械性能好,可铸可锻
铁合金
2.钢
碳素钢 合金钢
相同点 都是合金
不同点 含碳量较低的碳合金 在碳素钢中加入了合金元素(不锈钢一般加入镍和铬)
性能 含碳的碳素钢,硬度大;含碳量低的碳素钢,韧性强 不锈钢在空气中比较稳定,不易生锈,具有很强的抗腐蚀能力
思考讨论
P75 在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这对你有什么启示?
物质组成成分的种类和百分含量都对物质的性质有重大影响。在合金的冶炼中,可以根据实际需求,通过调节合金元素的种类和百分含量,制成具有不同性能的合金。
03
铝和铝合金
任务三 认识铝和铝合金
阅读教材,讨论铝的金属性强弱,讨论铝制品为什么不易生锈?
阅读资料卡片,知道铝制品表面的处理方法,思考铝制品表面为什么要进行处理?
铝
1.铝的物理性质
铝是地壳中含量最多的金属元素,单质铝具有金属的一般物理性质,是银白色固体,具有良好的导电性、导热性和延展性。
2.铝是一种活泼金属,在常温下就能与空气中的氧气发生反应,表面生产 一层致密的氧化铝薄膜。
4Al + 3O2 = 2Al2O3
【实验3-4】
完成实验,探究铝与盐酸发生的反应,分析教材是如何检验生成的气体?讨论氧化膜为什么没有保护铝?发生了哪些反应?练习书写化学方程式。
【实验3-4】
实验 现象
方程式
铝片逐渐溶解,有无色气泡冒出;将点燃的木条放在试管口有爆鸣声
Al2O3+6H+==2Al3++3H2O、2Al+6H+==2Al3++3H2↑
Al2O3+6HCl==2AlCl3+3H2O、2Al+6HCl==2AlCl3+3H2↑
【实验3-5】
完成实验,为什么未打磨的铝片不立即生成氢气,二是一段时间后生成气泡?练习书写化学方程式。
【实验3-5】
实验 现象
方程式
试管①中一开始无气泡产生,一段时间后,铝片溶解,有无色气泡冒出。
试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有爆鸣声。
Al2O3+2OH- =2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2- +3H2↑
Al2O3+2NaOH=2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑
两性氧化物
像Al2O3这类既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。写出Al2O3分别与盐酸、NaOH溶液反应的离子方程式:
【生活常识】由于Al和 Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
两性氧化物
像Al2O3这类既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。写出Al2O3分别与盐酸、NaOH溶液反应的离子方程式:
【生活常识】由于Al和 Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
铝合金
1.制备:向铝中加入少量的合金元素,可制成铝合金;
2.应用:铝合金是目前用途广泛的合金之一,如硬铝(含Cu、Mg、Mn、Si)的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
04
自主练习
1. 沈括根据变法需要,悉心总结了兵器制作技术。《梦溪笔谈·器用》中记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折。剑之钢者,刃多毁缺,巨阙是也,故不可纯用剂钢。”以所学合金的知识,分析古人铸剑时剑身的材料为( )
A.钢 B.生铁
C.青铜 D.白铜
A
2.下表中四种金属的熔、沸点:
其中不能形成合金的是( )
①Cu与Na ②Fe与Cu ③Fe与Na ④Al与Na
A.①② B.①③
C.①④ D.②④
C
金属 Na Cu Al Fe
熔点/℃ 97.8 1 083 660 1 535
沸点/℃ 883 2 567 2 467 2 750
3.中国国产大型客机C919机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
D
4. 为了除去MgO中混有的少量杂质Al2O3,可选用的试剂是( )
A.KOH溶液
B.氨水
C.稀盐酸
D.稀醋酸
A
5. 用铁、铝的混合物进行如下实验:
(1)操作X的名称是_____。
(2)①、②的离子方程式为________________________________,
过滤
2Al+2OH-+2H2O=2AlO2-+3H2↑
____________________。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_______(填“氧化剂”或“还原剂”)。
Fe+2H+===Fe2++H2↑
HCl
还原剂
谢谢观看
