山东省淄博市高青县2022-2023学年九年级上学期期中化学试题(含答案)
文档属性
| 名称 | 山东省淄博市高青县2022-2023学年九年级上学期期中化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 127.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-07 23:41:14 | ||
图片预览



文档简介
2022-2023学年度第一学期期中诊断性检测
九年级化学试题
可能用到的相对原子质量:H1 O16 C135.5 Na 23
一、选择题:(每小题有1个正确答案,请把答案写在下面的答案栏中)
1. 下列关于溶液的说法中,正确的是
A. 溶液中一定含有水 B. 溶液一定是无色透明的液体
C. 液态物质一定是溶液 D. 溶液一定是均一、稳定的混合物
2. 下列说法不正确的是
A. 一定温度下不能继续溶解某溶质的溶液,称为该溶质的饱和溶液
B. 饱和溶液升高温度一定变成其不饱和溶液
C. 增加溶质可以使某不饱和溶液变为其饱和溶液
D. 增加溶剂可以使某饱和溶液变为其不饱和溶液
3. 将100g25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液,所需水的质量为
A. 150g B. 250g C. 100g D. 50g
4. 下列情况能导致配制氯化钠溶液质量分数偏大的是
A. 用量筒取水时仰视读数
B. 称量氯化钠时,所用的砝码生锈
C. 配制溶液用的烧杯清洗后有水残留
D. 配制好溶液装瓶时,溶液有洒落
5. 下列说法错误的是
A. 物质的溶解性与本身的性质有关 B. 一定温度下,压强越大气体的溶解度越大
C. 固体物质的溶解度都随温度升高而增大 D. 溶解度是定量表示物质溶解性的一种方法
6. 如图是KNO3和NH4C1溶解度曲线,下列叙述错误的是
A. t1℃时,KNO3的溶解度与NH4CI的溶解度相等
B. t2℃时,KNO3饱和溶液中溶质的质量分数是60%
C. t1℃时,NH4C1的饱和溶液升温,变为不饱和溶液
D. t2℃时,KNO3饱和溶液中溶质的质量分数一定大于NH4CI饱和溶液中溶质的质量分数
7. 下列有关浓盐酸和浓硫酸的叙述正确的是
A. 浓盐酸和浓硫酸都有挥发性 B. 浓盐酸和浓硫酸都有吸水性
C. 浓盐酸和浓硫酸都有腐蚀性 D. 浓盐酸和浓硫酸都能作干燥剂
8. 二氧化碳溶于水可以生产碳酸饮料,碳酸是一种常见的弱酸。下列说法错误的是
A. 碳酸饮料能使紫色石蕊试液变蓝色 B. 碳酸不稳定,受热易分解
C. 碳酸饮料中含有自由移动的氢离子 D. 胃酸过多的人不宜饮用碳酸饮料
9. 下列液体中,酸性最强的是
A. 雨水(pH=5.6) B. 厨房油污清洗剂(pH=13.0)
C. 小苏打水(pH=9.0) D. 食醋(pH=3.0)
10. 某物质能使无色酚酞变红,下列说法正确的是
A. 该物质一定是碱 B. 该物质溶液显碱性
C. 该物质溶液加水稀释,pH增大 D. 向该物质中滴加稀盐酸,一定发生中和反应
11. 下列反应原理不属于中和反应的是
A. 生石灰用于干燥剂 B. 氢氧化铝用于治疗胃酸过多
C. 熟石灰用于处理酸性工业废水 D. 硼酸用于处理皮肤上沾有的碱
12. 下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A 用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B 先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C. 用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D. 用pH试纸测得该氢氧化钠溶液的
13. 下列化学方程式书写正确的是
A. B.
C. D.
14. 发现酸碱指示剂并制成了石蕊试纸的化学家是
A. 阿伦尼乌斯 B. 布朗斯特 C. 卢瑟福 D. 波义耳
15. 区分海水和蒸馏水常用的试剂是
A. 紫色石蕊 B. 无色酚酞
C 硝酸银溶液 D. 氯化钠溶液
二、理解与应用
16. 用常见物质的化学式填写。
(1)红色固体单质_______。
(2)金属氧化物_______。
(3)非金属氧化物_______。
(4)pH=7的化合物_______。
(5)难溶性盐_______。
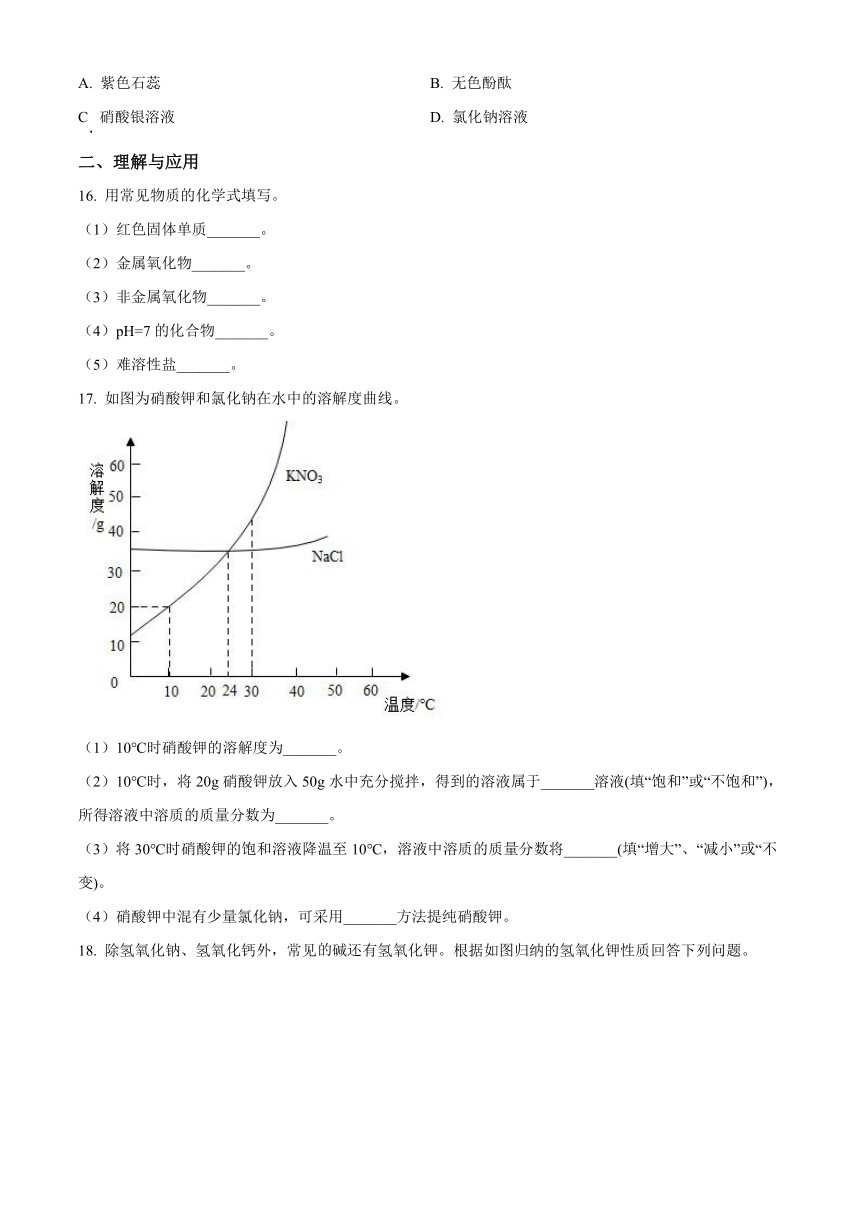
17. 如图为硝酸钾和氯化钠在水中的溶解度曲线。
(1)10℃时硝酸钾的溶解度为_______。
(2)10℃时,将20g硝酸钾放入50g水中充分搅拌,得到的溶液属于_______溶液(填“饱和”或“不饱和”),所得溶液中溶质的质量分数为_______。
(3)将30℃时硝酸钾的饱和溶液降温至10℃,溶液中溶质的质量分数将_______(填“增大”、“减小”或“不变)。
(4)硝酸钾中混有少量氯化钠,可采用_______方法提纯硝酸钾。
18. 除氢氧化钠、氢氧化钙外,常见碱还有氢氧化钾。根据如图归纳的氢氧化钾性质回答下列问题。
(1)KOH溶于水解离出的阴离子是_______(填离子符号)。
(2)将紫色石蕊试液滴入KOH溶液中,溶液呈_______色。
(3)KOH固体极易吸收空气中的水分而潮解,同时能吸收空气中的某种气体物质而变质,写其变质反应的化学方程式_______。所以,氢氧化钾必须_______保存。
(4)稀盐酸与氢氧化钾反应的化学反应方程式_______,反应类型是_______反应,该反应的实质是_______。
(5)将硫酸铜溶液滴入氢氧化钾溶液中,观察到的现象是____,反应的化学方程式是___。
19. 小明同学在洁净的点滴板上分别加入少量的无色酚酞试液、紫色石蕊试液、氢氧化钠溶液、氯化钡溶液、生锈小铁钉、镁条。然后向其中分别加入5~6滴稀硫酸观察现象。
(1)实验的目的是_______。使用点滴板的优点是_______。
(2)写出一个有气体产生的反应方程式_______。
(3)写出稀硫酸和铁锈反应的化学方程式_______。
(4)稀硫酸和氯化钡反应的实质是_______。
三、实验与探究
20. 完成下列实验问题:
(1)图1中,观察到的现象是_______。
(2)图2中,观察到的现象是_______,反应的化学方程式是_______。
(3)图3中,反应的化学方程式是_______。
(4)图4中,观察到的现象是_______,反应的化学方程式是_______。
21. 实验室中要配制一定溶质质量分数的氯化钠溶液,请你帮助完成。
(1)甲图中缺少一种必须用到的玻璃仪器是_______(填写名称),该仪器在实验操作中的作用是_______。
(2)用托盘天平称量氯化钠时,药品放在_______盘,砝码放在_______盘。准确称量18g氯化钠:量取蒸馏水的体积如乙图所示,选用量筒的规格是_______mL,氯化钠完全溶解后所配制的溶液中溶质的质量分数是_______(水的密度为1g/cm3)
(3)配制氯化钠溶液的操作过程正确的操作步骤是:计算、_______、_______、装瓶并贴上标签存放。存放在药品厨中时,标签应朝向_______。
四、分析与计算
22. 今取质量分数为4%的氢氧化钠溶液100g,滴入几滴酚酞试液,再向里逐滴滴加稀盐酸,至溶液颜色恰好褪去,停止滴加。测得反应后溶液的总质量为200g。试求:
(1)反应后溶液的pH=_______。
(2)所用稀盐酸中溶质的质量分数(写出计算过程)
2022-2023学年度第一学期期中诊断性检测
九年级化学试题
可能用到的相对原子质量:H1 O16 C135.5 Na 23
一、选择题:(每小题有1个正确答案,请把答案写在下面的答案栏中)
【1题答案】
【答案】D
【2题答案】
【答案】B
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】C
【6题答案】
【答案】B
【7题答案】
【答案】C
【8题答案】
【答案】A
【9题答案】
【答案】D
【10题答案】
【答案】B
【11题答案】
【答案】A
【12题答案】
【答案】C
【13题答案】
【答案】B
【14题答案】
【答案】D
【15题答案】
【答案】C
二、理解与应用
【16题答案】
【答案】(1)P (2)Fe3O4
(3)CO2 (4)NaCl
(5)CaCO3
【17题答案】
【答案】 ①. 20g ②. 饱和 ③. 16.7% ④. 减小 ⑤. 冷却热饱和溶液(或降温结晶)
【18题答案】
【答案】(1)OH- (2)蓝
(3) ①.
②. 密封
(4) ①.
②. 复分解 ③. 酸中的氢离子和碱中的氢氧根离子结合生成水分子
(5) ①. 生成蓝色沉淀,溶液由蓝色变为无色 ②.
【19题答案】
【答案】(1) ①. 探究稀硫酸的化学性质 ②. 节约药品
(2)
(3)
(4)钡离子和硫酸根离子结合生成硫酸钡沉淀
三、实验与探究
【20题答案】
【答案】(1)溶液变红
(2) ①. 有蓝色沉淀生成 ②. Ca(OH)2+CuCl2=Cu(OH)2↓+CaCl2
(3)Ca(OH)2+2HCl=CaCl2+2H2O
(4) ①. 有白色沉淀生成 ②. Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【21题答案】
【答案】(1) ①. 玻璃棒 ②. 加速溶解
(2) ①. 左 ②. 右 ③. 100 ④. 18%
(3) ①. 称量 ②. 溶解 ③. 外
四、分析与计算
【22题答案】
【答案】(1)7 (2)解:恰好完全反应时用去NaOH质量为100g×4%=4g
设所用稀盐酸中溶质的质量为x
x=3.65g
根据质量守恒定律可知,所用稀盐酸溶液的质量为200g-100g=100g,则所用稀盐酸中溶质的质量分数为×100%=3.65%
答:所用稀盐酸中溶质的质量分数为3.65%。
九年级化学试题
可能用到的相对原子质量:H1 O16 C135.5 Na 23
一、选择题:(每小题有1个正确答案,请把答案写在下面的答案栏中)
1. 下列关于溶液的说法中,正确的是
A. 溶液中一定含有水 B. 溶液一定是无色透明的液体
C. 液态物质一定是溶液 D. 溶液一定是均一、稳定的混合物
2. 下列说法不正确的是
A. 一定温度下不能继续溶解某溶质的溶液,称为该溶质的饱和溶液
B. 饱和溶液升高温度一定变成其不饱和溶液
C. 增加溶质可以使某不饱和溶液变为其饱和溶液
D. 增加溶剂可以使某饱和溶液变为其不饱和溶液
3. 将100g25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液,所需水的质量为
A. 150g B. 250g C. 100g D. 50g
4. 下列情况能导致配制氯化钠溶液质量分数偏大的是
A. 用量筒取水时仰视读数
B. 称量氯化钠时,所用的砝码生锈
C. 配制溶液用的烧杯清洗后有水残留
D. 配制好溶液装瓶时,溶液有洒落
5. 下列说法错误的是
A. 物质的溶解性与本身的性质有关 B. 一定温度下,压强越大气体的溶解度越大
C. 固体物质的溶解度都随温度升高而增大 D. 溶解度是定量表示物质溶解性的一种方法
6. 如图是KNO3和NH4C1溶解度曲线,下列叙述错误的是
A. t1℃时,KNO3的溶解度与NH4CI的溶解度相等
B. t2℃时,KNO3饱和溶液中溶质的质量分数是60%
C. t1℃时,NH4C1的饱和溶液升温,变为不饱和溶液
D. t2℃时,KNO3饱和溶液中溶质的质量分数一定大于NH4CI饱和溶液中溶质的质量分数
7. 下列有关浓盐酸和浓硫酸的叙述正确的是
A. 浓盐酸和浓硫酸都有挥发性 B. 浓盐酸和浓硫酸都有吸水性
C. 浓盐酸和浓硫酸都有腐蚀性 D. 浓盐酸和浓硫酸都能作干燥剂
8. 二氧化碳溶于水可以生产碳酸饮料,碳酸是一种常见的弱酸。下列说法错误的是
A. 碳酸饮料能使紫色石蕊试液变蓝色 B. 碳酸不稳定,受热易分解
C. 碳酸饮料中含有自由移动的氢离子 D. 胃酸过多的人不宜饮用碳酸饮料
9. 下列液体中,酸性最强的是
A. 雨水(pH=5.6) B. 厨房油污清洗剂(pH=13.0)
C. 小苏打水(pH=9.0) D. 食醋(pH=3.0)
10. 某物质能使无色酚酞变红,下列说法正确的是
A. 该物质一定是碱 B. 该物质溶液显碱性
C. 该物质溶液加水稀释,pH增大 D. 向该物质中滴加稀盐酸,一定发生中和反应
11. 下列反应原理不属于中和反应的是
A. 生石灰用于干燥剂 B. 氢氧化铝用于治疗胃酸过多
C. 熟石灰用于处理酸性工业废水 D. 硼酸用于处理皮肤上沾有的碱
12. 下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A 用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B 先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C. 用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D. 用pH试纸测得该氢氧化钠溶液的
13. 下列化学方程式书写正确的是
A. B.
C. D.
14. 发现酸碱指示剂并制成了石蕊试纸的化学家是
A. 阿伦尼乌斯 B. 布朗斯特 C. 卢瑟福 D. 波义耳
15. 区分海水和蒸馏水常用的试剂是
A. 紫色石蕊 B. 无色酚酞
C 硝酸银溶液 D. 氯化钠溶液
二、理解与应用
16. 用常见物质的化学式填写。
(1)红色固体单质_______。
(2)金属氧化物_______。
(3)非金属氧化物_______。
(4)pH=7的化合物_______。
(5)难溶性盐_______。
17. 如图为硝酸钾和氯化钠在水中的溶解度曲线。
(1)10℃时硝酸钾的溶解度为_______。
(2)10℃时,将20g硝酸钾放入50g水中充分搅拌,得到的溶液属于_______溶液(填“饱和”或“不饱和”),所得溶液中溶质的质量分数为_______。
(3)将30℃时硝酸钾的饱和溶液降温至10℃,溶液中溶质的质量分数将_______(填“增大”、“减小”或“不变)。
(4)硝酸钾中混有少量氯化钠,可采用_______方法提纯硝酸钾。
18. 除氢氧化钠、氢氧化钙外,常见碱还有氢氧化钾。根据如图归纳的氢氧化钾性质回答下列问题。
(1)KOH溶于水解离出的阴离子是_______(填离子符号)。
(2)将紫色石蕊试液滴入KOH溶液中,溶液呈_______色。
(3)KOH固体极易吸收空气中的水分而潮解,同时能吸收空气中的某种气体物质而变质,写其变质反应的化学方程式_______。所以,氢氧化钾必须_______保存。
(4)稀盐酸与氢氧化钾反应的化学反应方程式_______,反应类型是_______反应,该反应的实质是_______。
(5)将硫酸铜溶液滴入氢氧化钾溶液中,观察到的现象是____,反应的化学方程式是___。
19. 小明同学在洁净的点滴板上分别加入少量的无色酚酞试液、紫色石蕊试液、氢氧化钠溶液、氯化钡溶液、生锈小铁钉、镁条。然后向其中分别加入5~6滴稀硫酸观察现象。
(1)实验的目的是_______。使用点滴板的优点是_______。
(2)写出一个有气体产生的反应方程式_______。
(3)写出稀硫酸和铁锈反应的化学方程式_______。
(4)稀硫酸和氯化钡反应的实质是_______。
三、实验与探究
20. 完成下列实验问题:
(1)图1中,观察到的现象是_______。
(2)图2中,观察到的现象是_______,反应的化学方程式是_______。
(3)图3中,反应的化学方程式是_______。
(4)图4中,观察到的现象是_______,反应的化学方程式是_______。
21. 实验室中要配制一定溶质质量分数的氯化钠溶液,请你帮助完成。
(1)甲图中缺少一种必须用到的玻璃仪器是_______(填写名称),该仪器在实验操作中的作用是_______。
(2)用托盘天平称量氯化钠时,药品放在_______盘,砝码放在_______盘。准确称量18g氯化钠:量取蒸馏水的体积如乙图所示,选用量筒的规格是_______mL,氯化钠完全溶解后所配制的溶液中溶质的质量分数是_______(水的密度为1g/cm3)
(3)配制氯化钠溶液的操作过程正确的操作步骤是:计算、_______、_______、装瓶并贴上标签存放。存放在药品厨中时,标签应朝向_______。
四、分析与计算
22. 今取质量分数为4%的氢氧化钠溶液100g,滴入几滴酚酞试液,再向里逐滴滴加稀盐酸,至溶液颜色恰好褪去,停止滴加。测得反应后溶液的总质量为200g。试求:
(1)反应后溶液的pH=_______。
(2)所用稀盐酸中溶质的质量分数(写出计算过程)
2022-2023学年度第一学期期中诊断性检测
九年级化学试题
可能用到的相对原子质量:H1 O16 C135.5 Na 23
一、选择题:(每小题有1个正确答案,请把答案写在下面的答案栏中)
【1题答案】
【答案】D
【2题答案】
【答案】B
【3题答案】
【答案】A
【4题答案】
【答案】B
【5题答案】
【答案】C
【6题答案】
【答案】B
【7题答案】
【答案】C
【8题答案】
【答案】A
【9题答案】
【答案】D
【10题答案】
【答案】B
【11题答案】
【答案】A
【12题答案】
【答案】C
【13题答案】
【答案】B
【14题答案】
【答案】D
【15题答案】
【答案】C
二、理解与应用
【16题答案】
【答案】(1)P (2)Fe3O4
(3)CO2 (4)NaCl
(5)CaCO3
【17题答案】
【答案】 ①. 20g ②. 饱和 ③. 16.7% ④. 减小 ⑤. 冷却热饱和溶液(或降温结晶)
【18题答案】
【答案】(1)OH- (2)蓝
(3) ①.
②. 密封
(4) ①.
②. 复分解 ③. 酸中的氢离子和碱中的氢氧根离子结合生成水分子
(5) ①. 生成蓝色沉淀,溶液由蓝色变为无色 ②.
【19题答案】
【答案】(1) ①. 探究稀硫酸的化学性质 ②. 节约药品
(2)
(3)
(4)钡离子和硫酸根离子结合生成硫酸钡沉淀
三、实验与探究
【20题答案】
【答案】(1)溶液变红
(2) ①. 有蓝色沉淀生成 ②. Ca(OH)2+CuCl2=Cu(OH)2↓+CaCl2
(3)Ca(OH)2+2HCl=CaCl2+2H2O
(4) ①. 有白色沉淀生成 ②. Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【21题答案】
【答案】(1) ①. 玻璃棒 ②. 加速溶解
(2) ①. 左 ②. 右 ③. 100 ④. 18%
(3) ①. 称量 ②. 溶解 ③. 外
四、分析与计算
【22题答案】
【答案】(1)7 (2)解:恰好完全反应时用去NaOH质量为100g×4%=4g
设所用稀盐酸中溶质的质量为x
x=3.65g
根据质量守恒定律可知,所用稀盐酸溶液的质量为200g-100g=100g,则所用稀盐酸中溶质的质量分数为×100%=3.65%
答:所用稀盐酸中溶质的质量分数为3.65%。
同课章节目录
