高中化学人教版(2019)选择性必修2 2.3.1 共价键的极性(共23张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修2 2.3.1 共价键的极性(共23张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-08 10:49:26 | ||
图片预览







文档简介
(共24张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
1.能从共用电子对是否发生偏移的角度认识键的极性的实质是成键原子分别带正电和负电。
2.知道分子可以分为极性分子和非极性分子。
3.知道分子极性和分子中键的极性、分子的空间结构密切相关。
学习目标:
素养目标:
通过共价健极性学习,发展宏观辨识和微观探析、模型认知和证据推理能及化学社会价值的认知水平。
电子云密度大
电子云密度小
观察下图,在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,可看到四氯化碳呈直线状垂直流入烧杯中。将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,四氯化碳的流动方向未发生变化。再向另一酸式滴定管中加入蒸馏水进行同样的实验,水流动方向却发生了偏转。你知道是为什么吗?
观察与思考
水分子的表面静电势图
颜色表示静电势的数值:
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
又如,在形成氯气分子时,两个氯原子吸引电子的能力相等,共用电子不偏移,两个成键氯原子不显电性。
②相同原子形成的共价键,因两个原子吸引电子的能力相同,共用电子对不发生偏移,两个键合原子呈中性,这种共价键叫作非极性共价键,简称非极性键。
共价键
极性键
非极性键
不同原子间
同种原子间
共用电子对偏移
成键原子呈电性
共用电子对不偏移
成键原子呈电中性
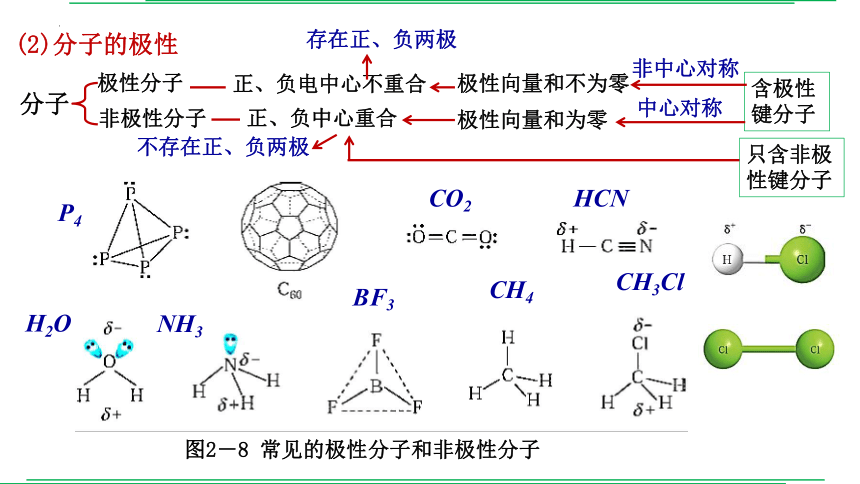
(2)分子的极性
分子
极性分子
非极性分子
正、负电中心不重合
正、负中心重合
含极性键分子
极性向量和不为零
极性向量和为零
只含非极性键分子
图2-8 常见的极性分子和非极性分子
P4
CO2
HCN
H2O
NH3
BF3
CH4
CH3Cl
存在正、负两极
不存在正、负两极
中心对称
非中心对称
根据图2-18,思考和回答下列问题:
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)P4和C60是极性分子还是非极性分子
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
思考与讨论
极性分子
非极性分子
P4和C60是非极性分子
HCN、H2O、NH3、CH3Cl是极性分子,
CO2、 BF3、CH4是非极性分子。
水分子的正电中心和负电中心不重合,在电场作用下可以定向转动。
极性分子
金
属
片
金
属
片
微波炉的加热原理示意图
水分子极性的应用:微波炉
众多的水分子随电磁场定向转动,因频繁相互间摩擦损耗,使电磁能转化为热能。
(3)从向量的角度理解分子的极性
①若分子中共价键的极性的向量和等于0,则分子中没有带正电和带负电的两部分,为非极性分子,如BF3、CH4等。
对称的3个F所带负电的向量和位于分子中心,即与B重合,且负电量与B所带正电量相等,分子不带电,为非极性分子。
对称的4个H所带正电的向量和位于分子中心,即与C重合,且正电量与C所带负电量相等,分子不带电,为非极性分子。
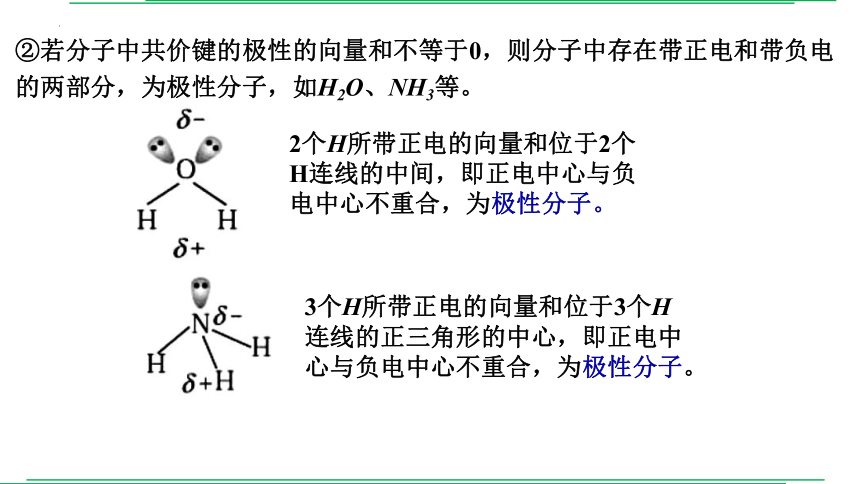
②若分子中共价键的极性的向量和不等于0,则分子中存在带正电和带负电的两部分,为极性分子,如H2O、NH3等。
2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子。
3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子。
(4)判断分子的极性的方法
①化合价法:
ABn型分子中
中心原子化合价绝对值
该元素的价电子数
=
分子的空间结构中心对称
≠
该元素的价电子数
分子的空间结构非中心对称
该分子为非极性分子
直线形
平面正三角形
正四面体
……
该分子为极性分子
V形
三角锥形
四面体
……
如:BF3
B原子化合价绝对值=价电子数=3
非极性分子
如:SO2
S原子化合价绝对值为4≠价电子数6
极性分子
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
常见分子的极性、非极性:
②空间结构法:
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性分子
极性分子
极性分子
CO2、CS2
SO2、
H2O、H2S
3+0
3+1
正三角形
三角锥
非极性分子
极性分子
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性分子
CH4、CCl4
直线形
非极性分子
极性分子
O2、H2
HF、CO
σ键电子对数
价层电子对数
VSEPR模型
孤电子对数
空间结构
非中心对称
中心对称
非极性分子
极性分子
臭氧是极性分子
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂······
臭氧分子的空间结构与水分子的相似,其分子有极性,但很微弱,仅是水分子的极性的28%。臭氧分子中的共价键是极性键,其中心氧原子是呈正电性的,而端位的两个氧原子是呈负电性的。由于臭氧的极性微弱,它在四氯化碳里的溶解度高于在水中的溶解度。
资料卡片
δ+
δ-
O均采用sp2杂化
表面活性剂 和细胞膜
有一大类称为表面活性剂的有机分子,分子的一端有极性,称为亲水基团,分子的另一端没有或者几乎没有极性,称为疏水基团。烷基磺酸根离子就是一种表面活性剂(如图2-19左)。
表面活性剂在水中会形成亲水基团向外、疏水基团向内的胶束(如图2-19中)。由于油渍等污垢是疏水的,会被包裹在胶束内腔,这就是肥皂和洗涤剂的去污原理。
科学 技术 社会
图2-19 烷基磺酸根离子(左)、胶束(中)
这些分子之所以称为表面活性剂,是由它们会分散在水的液体表面形成一层疏水基团朝向空气的单分子层,又称单分子膜(如图2-19右),从而大大降低水的表面张力。
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性、另一端无极性)组装而成的,膜的筒图如图2-20所示。
为什么双分子膜以头向外而尾向内的方式排列?这是由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基 。
图2-20 细胞和细胞器的双分子膜
图2-19 表面活性剂在水中形成单分层
回顾与思考
我们已经学过醋酸,它的官能团是什么?请写出其电离方程式及电离平衡常数Ka表达式。如何用pKa衡量弱酸强弱?什么叫羧酸?
官能团:
CH3COOH
羧基(—COOH)
CH3COOH CH3COO- + H+
Ka=
c(H+)·c(CH3COO-)
c(CH3COOH)
pKa= - lgKa
(1,0)
Ka
pKa
pKa越小,Ka越大,酸性越强。
分子中含有羧基的有机酸叫羧酸,如甲酸(HCOOH)、丙酸(CH3CH2COOH)等。
2.键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响,羧酸的酸性大小与其分子的组成和结构有关,如表2-6所示。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
酸
性
增
强
为什么从上到下酸性逐渐增强呢?
(1)电负性F (4.0)>Cl(3.0) ,极性F-C>Cl-C,使F3C-的极性> Cl3C-的极性,通过传导作用导致三氟乙烯的羧羟基的极性更大,更易电离出H+。同理,三氯乙酸的酸性大于二氯乙酸的,二氯乙酸的酸性大于一氯乙酸的。
Cl-C-C-O-H
O
=
Cl
-
-
Cl
F-C-C-O-H
O
=
F
-
-
F
δ+
δ-
δ+
δ-
一氯乙酸、二氯乙酸、三氯乙酸的表面静电势图
(2烷基(-R)是推电子基团,烷基越长,推电子效应越大,使羧羟基的极性越小,羧酸的酸性越弱。因此,酸性:甲酸>乙酸>丙酸>······随着烷基加长,酸性的差异越来越小。
CH3
O
H
O
C
C2H5
O
H
O
C
乙酸的表面静电势图
δ-
δ+
δ-
δ+
分子结构修饰与分子的性质
分子结构修饰是指不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到的新分于。分于结构被修饰后,分子的性质发生了改变。例如,用三个氯原子取代蔗糖分子(如2-21)中的三个羟基,就得到三氯蔗糖(如图2-21)。
三氯蔗糖(如图2-22),又名蔗糖素,其甜度是蔗糖的600倍,没有异味,具有热量值极低、安全性好等优点,可供糖尿病患者食用,被认为是近乎完美的甜味剂。
图2-21 蔗糖和三氯蔗糖结构式
科学 技术 社会
三氯蔗糖
分子结构修饰在药物设计与合成中有广泛的应用。为提高药物的治疗效果,降低毒副作用等,可将药物分子的结构进行修饰。例如,布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图2-23所示的成酯修饰。
小结:
共价键
极性键
极性分子
非极性分子
非极性键
共价化合物
微观探析
发展核心素养:
证据推理
模型认知
空间结构非中心对称
空间结构中心对称
只含
相同的原子间
不同的原子间
判断方法
宏观辨识
键的极性影响分子的化学性质
1.下列有关分子的结构与性质的叙述中正确的是( )
A.CS2、H2O、C2H2都是直线型
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.CH2=CH2和CH≡CH分子含有的π键个数相等
D.CH4、CCl4、SiH4都是含有极性键的非极性分子
D
2.下列有关分子的叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D. 非极性分子中一定含有非极性共价键
A
学习评价:
再 见 !
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
1.能从共用电子对是否发生偏移的角度认识键的极性的实质是成键原子分别带正电和负电。
2.知道分子可以分为极性分子和非极性分子。
3.知道分子极性和分子中键的极性、分子的空间结构密切相关。
学习目标:
素养目标:
通过共价健极性学习,发展宏观辨识和微观探析、模型认知和证据推理能及化学社会价值的认知水平。
电子云密度大
电子云密度小
观察下图,在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,可看到四氯化碳呈直线状垂直流入烧杯中。将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,四氯化碳的流动方向未发生变化。再向另一酸式滴定管中加入蒸馏水进行同样的实验,水流动方向却发生了偏转。你知道是为什么吗?
观察与思考
水分子的表面静电势图
颜色表示静电势的数值:
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
又如,在形成氯气分子时,两个氯原子吸引电子的能力相等,共用电子不偏移,两个成键氯原子不显电性。
②相同原子形成的共价键,因两个原子吸引电子的能力相同,共用电子对不发生偏移,两个键合原子呈中性,这种共价键叫作非极性共价键,简称非极性键。
共价键
极性键
非极性键
不同原子间
同种原子间
共用电子对偏移
成键原子呈电性
共用电子对不偏移
成键原子呈电中性
(2)分子的极性
分子
极性分子
非极性分子
正、负电中心不重合
正、负中心重合
含极性键分子
极性向量和不为零
极性向量和为零
只含非极性键分子
图2-8 常见的极性分子和非极性分子
P4
CO2
HCN
H2O
NH3
BF3
CH4
CH3Cl
存在正、负两极
不存在正、负两极
中心对称
非中心对称
根据图2-18,思考和回答下列问题:
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)P4和C60是极性分子还是非极性分子
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
思考与讨论
极性分子
非极性分子
P4和C60是非极性分子
HCN、H2O、NH3、CH3Cl是极性分子,
CO2、 BF3、CH4是非极性分子。
水分子的正电中心和负电中心不重合,在电场作用下可以定向转动。
极性分子
金
属
片
金
属
片
微波炉的加热原理示意图
水分子极性的应用:微波炉
众多的水分子随电磁场定向转动,因频繁相互间摩擦损耗,使电磁能转化为热能。
(3)从向量的角度理解分子的极性
①若分子中共价键的极性的向量和等于0,则分子中没有带正电和带负电的两部分,为非极性分子,如BF3、CH4等。
对称的3个F所带负电的向量和位于分子中心,即与B重合,且负电量与B所带正电量相等,分子不带电,为非极性分子。
对称的4个H所带正电的向量和位于分子中心,即与C重合,且正电量与C所带负电量相等,分子不带电,为非极性分子。
②若分子中共价键的极性的向量和不等于0,则分子中存在带正电和带负电的两部分,为极性分子,如H2O、NH3等。
2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子。
3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子。
(4)判断分子的极性的方法
①化合价法:
ABn型分子中
中心原子化合价绝对值
该元素的价电子数
=
分子的空间结构中心对称
≠
该元素的价电子数
分子的空间结构非中心对称
该分子为非极性分子
直线形
平面正三角形
正四面体
……
该分子为极性分子
V形
三角锥形
四面体
……
如:BF3
B原子化合价绝对值=价电子数=3
非极性分子
如:SO2
S原子化合价绝对值为4≠价电子数6
极性分子
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
常见分子的极性、非极性:
②空间结构法:
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性分子
极性分子
极性分子
CO2、CS2
SO2、
H2O、H2S
3+0
3+1
正三角形
三角锥
非极性分子
极性分子
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性分子
CH4、CCl4
直线形
非极性分子
极性分子
O2、H2
HF、CO
σ键电子对数
价层电子对数
VSEPR模型
孤电子对数
空间结构
非中心对称
中心对称
非极性分子
极性分子
臭氧是极性分子
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂······
臭氧分子的空间结构与水分子的相似,其分子有极性,但很微弱,仅是水分子的极性的28%。臭氧分子中的共价键是极性键,其中心氧原子是呈正电性的,而端位的两个氧原子是呈负电性的。由于臭氧的极性微弱,它在四氯化碳里的溶解度高于在水中的溶解度。
资料卡片
δ+
δ-
O均采用sp2杂化
表面活性剂 和细胞膜
有一大类称为表面活性剂的有机分子,分子的一端有极性,称为亲水基团,分子的另一端没有或者几乎没有极性,称为疏水基团。烷基磺酸根离子就是一种表面活性剂(如图2-19左)。
表面活性剂在水中会形成亲水基团向外、疏水基团向内的胶束(如图2-19中)。由于油渍等污垢是疏水的,会被包裹在胶束内腔,这就是肥皂和洗涤剂的去污原理。
科学 技术 社会
图2-19 烷基磺酸根离子(左)、胶束(中)
这些分子之所以称为表面活性剂,是由它们会分散在水的液体表面形成一层疏水基团朝向空气的单分子层,又称单分子膜(如图2-19右),从而大大降低水的表面张力。
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性、另一端无极性)组装而成的,膜的筒图如图2-20所示。
为什么双分子膜以头向外而尾向内的方式排列?这是由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基 。
图2-20 细胞和细胞器的双分子膜
图2-19 表面活性剂在水中形成单分层
回顾与思考
我们已经学过醋酸,它的官能团是什么?请写出其电离方程式及电离平衡常数Ka表达式。如何用pKa衡量弱酸强弱?什么叫羧酸?
官能团:
CH3COOH
羧基(—COOH)
CH3COOH CH3COO- + H+
Ka=
c(H+)·c(CH3COO-)
c(CH3COOH)
pKa= - lgKa
(1,0)
Ka
pKa
pKa越小,Ka越大,酸性越强。
分子中含有羧基的有机酸叫羧酸,如甲酸(HCOOH)、丙酸(CH3CH2COOH)等。
2.键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响,羧酸的酸性大小与其分子的组成和结构有关,如表2-6所示。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
酸
性
增
强
为什么从上到下酸性逐渐增强呢?
(1)电负性F (4.0)>Cl(3.0) ,极性F-C>Cl-C,使F3C-的极性> Cl3C-的极性,通过传导作用导致三氟乙烯的羧羟基的极性更大,更易电离出H+。同理,三氯乙酸的酸性大于二氯乙酸的,二氯乙酸的酸性大于一氯乙酸的。
Cl-C-C-O-H
O
=
Cl
-
-
Cl
F-C-C-O-H
O
=
F
-
-
F
δ+
δ-
δ+
δ-
一氯乙酸、二氯乙酸、三氯乙酸的表面静电势图
(2烷基(-R)是推电子基团,烷基越长,推电子效应越大,使羧羟基的极性越小,羧酸的酸性越弱。因此,酸性:甲酸>乙酸>丙酸>······随着烷基加长,酸性的差异越来越小。
CH3
O
H
O
C
C2H5
O
H
O
C
乙酸的表面静电势图
δ-
δ+
δ-
δ+
分子结构修饰与分子的性质
分子结构修饰是指不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到的新分于。分于结构被修饰后,分子的性质发生了改变。例如,用三个氯原子取代蔗糖分子(如2-21)中的三个羟基,就得到三氯蔗糖(如图2-21)。
三氯蔗糖(如图2-22),又名蔗糖素,其甜度是蔗糖的600倍,没有异味,具有热量值极低、安全性好等优点,可供糖尿病患者食用,被认为是近乎完美的甜味剂。
图2-21 蔗糖和三氯蔗糖结构式
科学 技术 社会
三氯蔗糖
分子结构修饰在药物设计与合成中有广泛的应用。为提高药物的治疗效果,降低毒副作用等,可将药物分子的结构进行修饰。例如,布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图2-23所示的成酯修饰。
小结:
共价键
极性键
极性分子
非极性分子
非极性键
共价化合物
微观探析
发展核心素养:
证据推理
模型认知
空间结构非中心对称
空间结构中心对称
只含
相同的原子间
不同的原子间
判断方法
宏观辨识
键的极性影响分子的化学性质
1.下列有关分子的结构与性质的叙述中正确的是( )
A.CS2、H2O、C2H2都是直线型
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.CH2=CH2和CH≡CH分子含有的π键个数相等
D.CH4、CCl4、SiH4都是含有极性键的非极性分子
D
2.下列有关分子的叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D. 非极性分子中一定含有非极性共价键
A
学习评价:
再 见 !
