高中化学人教版(2019)选择性必修1 4.2.2电解原理的应用(共30张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修1 4.2.2电解原理的应用(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-08 20:05:06 | ||
图片预览






文档简介
(共30张PPT)
POWERPOINT
电解原理的应用
第四章第二节第二课时
学习目标
1、认识电解饱和食盐水、电镀、电解精炼铜、电冶金的原理,会写其电极反应式及总反应式
2.学会电解的有关计算,特别是守恒法的应用。
目录
CONTENT
01
氯碱工业
02
电镀
03
电解精炼铜
04
电冶金
氯气和烧碱是重要的化工原料。
工业上利用电解饱和食盐水制氯气和烧碱,称为氯碱工业。
Cl2
NaOH
阳极反应:
2Cl--2e-===Cl2↑
Cl->OH-
阳极离子放电顺序 :
阴极反应:
2H2O+2e-===H2↑+2OH-
H+>Na+
阴极离子放电顺序:
总反应化学方程式:
2Cl-+2H2O H2↑+Cl2↑+2OH-
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
电解
电解
应用:氯碱工业(教材106图4-11)
1、电 解饱和食盐水(氯碱工业)
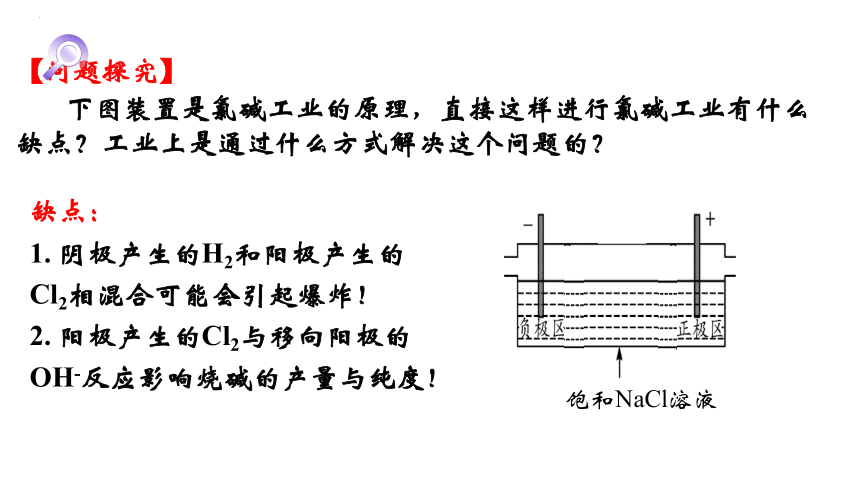
缺点:
1. 阴极产生的H2和阳极产生的Cl2相混合可能会引起爆炸!
2. 阳极产生的Cl2与移向阳极的OH-反应影响烧碱的产量与纯度!
【问题探究】
下图装置是氯碱工业的原理,直接这样进行氯碱工业有什么缺点?工业上是通过什么方式解决这个问题的?
饱和NaCl溶液
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
惰性电极
阴 极
碳钢网
阳极室
阴极室
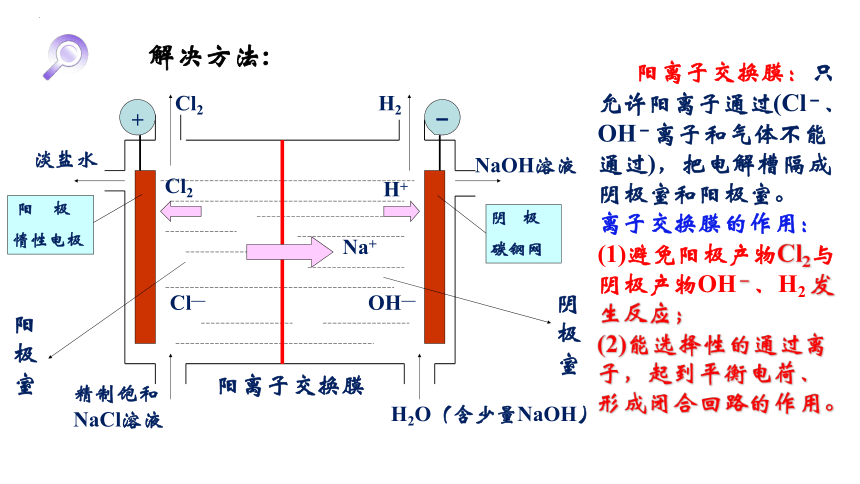
阳离子交换膜:只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
离子交换膜的作用:
(1)避免阳极产物Cl2与阴极产物OH-、H2 发生反应;
(2)能选择性的通过离子,起到平衡电荷、形成闭合回路的作用。
解决方法:
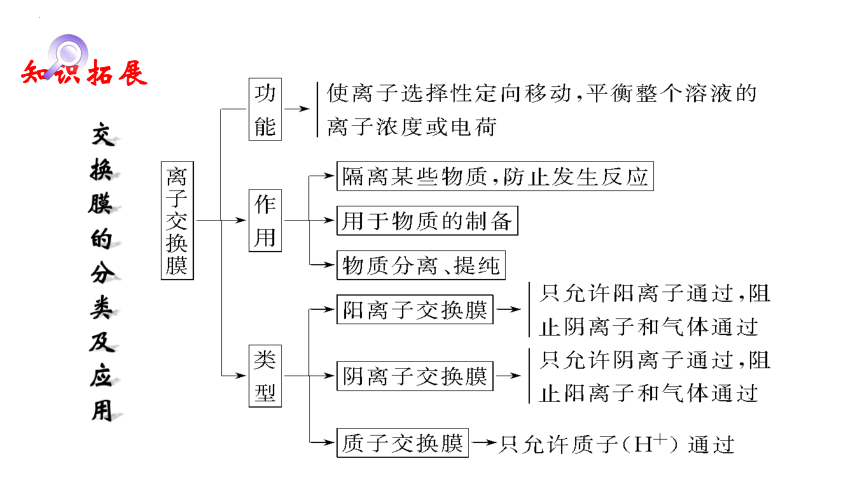
交换膜的分类及应用
知识拓展
练习1、右图为阳离子交换膜法电解饱和食盐水原理示意图。
下列说法不正确的是 ( )
A.从E口逸出的气体是Cl2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,
精制时先加Na2CO3溶液
AD
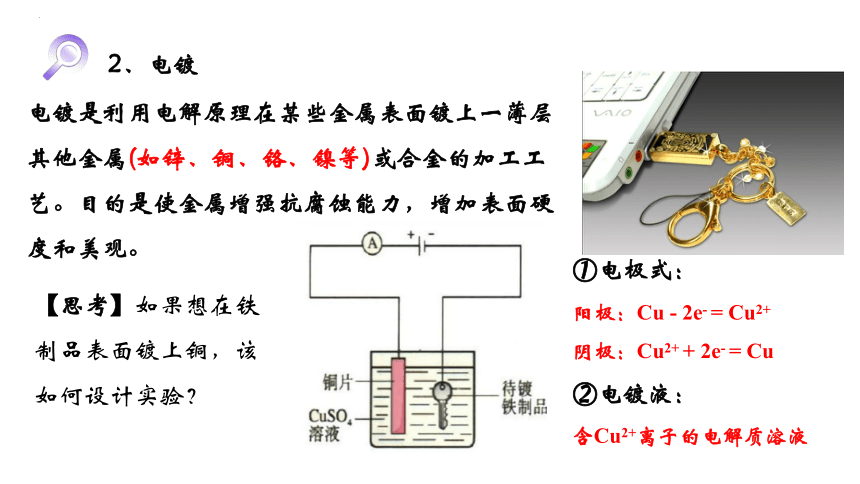
2、电镀
电镀是利用电解原理在某些金属表面镀上一薄层其他金属(如锌、铜、铬、镍等)或合金的加工工艺。目的是使金属增强抗腐蚀能力,增加表面硬度和美观。
【思考】如果想在铁制品表面镀上铜,该如何设计实验?
①电极式:
阳极:Cu - 2e- = Cu2+
阴极:Cu2+ + 2e- = Cu
②电镀液:
含Cu2+离子的电解质溶液
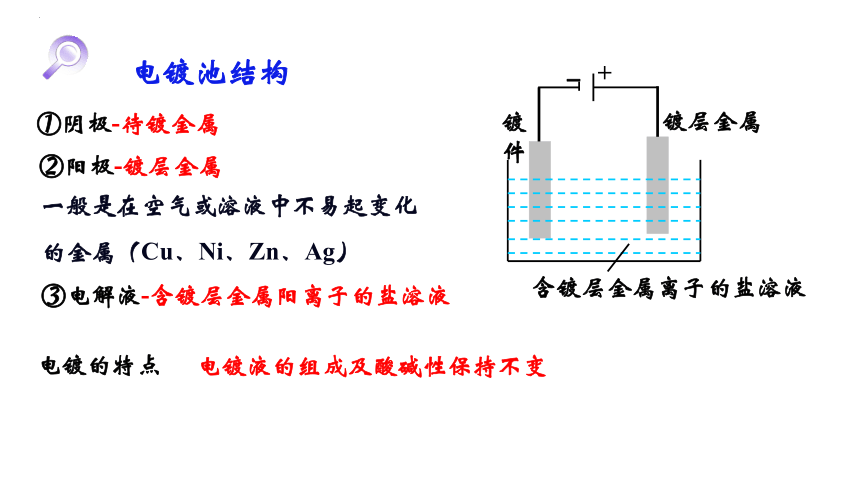
电镀池结构
①阴极-待镀金属
②阳极-镀层金属
一般是在空气或溶液中不易起变化的金属(Cu、Ni、Zn、Ag)
③电解液-含镀层金属阳离子的盐溶液
电镀的特点
电镀液的组成及酸碱性保持不变
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
练习2、在铜片上镀银时,下列叙述中错误的是( )
①将铜片接在电源的正极
②将银片接在电源的正极
③在铜片上发生的反应是Ag++e-=Ag
④在银片上发生的反应是4OH--4e-=O2↑+2H2O
⑤可用CuSO4溶液作电解质溶液
⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
C
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
练习3.在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,铁制品作阴极,溶液中含Zn2+
B.铂作阴极,铁制品作阳极,溶液中含Zn2+
C.铁作阳极,铁制品作阴极,溶液中含Fe2+
D.锌作阴极,铁制品作阳极,溶液中含Zn2+
A
3、金属的电解精炼
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。
电解精炼的结构
阳极--粗铜
阴极--纯铜
电解液-- CuSO4溶液
阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+
Au、Ag---阳极泥
阴极: Cu2+ +2e-=Cu
CuSO4溶液
精铜
粗铜
Ag Au
阳极泥
CuSO4溶液的浓度略减小
练习4、利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A. 电解时以精铜作阳极
B.电解时阳极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu = Cu2+ + 2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
D
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
练习5. 金属镍有广泛的用途,粗镍中含有少量等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知氧化性:)( )
A. 阳极发生还原反应,其电极反应式为
B. 电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C. 电解后,电解槽底部的阳极泥中含有和
D. 电解后,溶液中存在的金属阳离子只有和
C
4、电冶金
电解是最强有力的氧化还原手段。
电解法是冶炼金属的重要方法,特别是冶炼活泼金属(如冶炼钠、钙、镁、铝等活泼金属)
电解熔融氯化钠冶炼钠:
阴极反应:2Na+ + 2e- = 2Na
阳极反应:2Cl- - 2e- = Cl2↑
总反应:2NaCl === 2Na+Cl2↑
电解
(2)电解熔融的氯化镁:(制取金属镁)
阳极:
阴极:
2Cl - -2e- = Cl2↑
Mg2+ + 2e- = Mg
MgCl2(熔融) == Mg + Cl2 ↑
电解
(3)电解熔融的氧化铝:(制取金属铝)
阳极:
阴极:
总反应:
6O2- -12e- = 3O2↑
4Al3+ + 12e- = 4Al
2Al2O3(熔融) == 4Al + 3O2 ↑
电解
冰晶石
【思考】工业制取镁,用的氯化镁而不用氧化镁?制取铝时,用的是氧化铝而不用氯化铝?
原因:因为氧化镁的熔点比氯化镁高很多,浪费了能量 ;氯化铝是共价化合物,共价化合物为分子晶体,不能电解。而氧化铝是离子化合物,可电解。
【思考】电解熔融NaCl的方法可制备金属钠,金属Mg、Al如何制备呢?
石墨
石墨
阴极
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)降低Al2O3的熔点
电解池、电解精炼池、电镀池的比较
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
阳极:电源正极相连
阴极:电源负极相连
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
应用电解原理在某些金属表面镀上一层其它金属的装置。
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
练习6、海水提镁的最后一步是将氯化镁电解获取金属镁,下列有关该电解过程的叙述中,正确的是( )
A.两个电极必须都用惰性电极
B.阳极可以用金属电极,阴极必须是惰性电极
C.电解熔融状态的氯化镁
D.电解氯化镁的水溶液
C
5、电有机合成
阅读课本P109资料卡片了解电有机合成
阳极:H2O-2e-= 2H++1/2O2↑
丙烯(CH3CH=CH2)
丙烯腈(CH2=CHCN)
己二腈(NC(CH2)4CN)
阴极:2CH2=CHCN+2e-+2H+= NC(CH2)4CN
电解
总反应:2CH2=CHCN+2H2O ====NC(CH2)4CN+ 1/2O2
电解
练习7 .依据下图判断,下列叙述正确的是( )
A.Ⅰ是原电池,Ⅱ是电镀装置
B.Ⅰ、Ⅱ装置中锌极上均发生氧化反应
C.Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解
D.Ⅱ、Ⅲ装置中Cu2+ 浓度基本不变
A
练习8、关于下列各图的说法中,正确的是( )
A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中电子由b极流向a极
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
D
练习9、用石墨棒作电极,在Na+、Cu2+、Cl-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是________。
(2)当阴极析出金属,阳极放出O2时,电解质是________。
(3)当阴极放出H2,阳极放出Cl2时,电解质是________。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是________。
CuSO4
Na2SO4
CuSO4
NaCl
知识回顾
10. 如图所示,若电解,测得铜电极的质量增加。
问题1:电源中极是正极还是负极?
提示 负极。
铜极增重,说明银在铜极析出,则铜极为阴极,为负极。
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
问题2: 通电,中共收集到(标准状况)气体,溶液体积为(电解前后溶液的体积变化忽略不计),则通电前是多少?
中铜极增重,即析出,线路中通过电子。由,可知中产生的只有,即标准状况下的体积为。但中共收集到气体,说明还有气体是即全部在阴极放电后,接着放电产生了,则通过电子
时,已完全变为单质。由可知,则。
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
1.三个计算原则
(1)阳极失去的电子数等于阴极得到的电子数。
(2)串联电池中各电极上转移的电子数目相等。
(3)电源输出的电子总数和电解池中各电极上转移的电子数目相等。
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
2.三种常见计算方法
如以通过为桥梁可构建如下关系式:
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
11. 如图所示的两个电解池中的电极均为铂电极,在池中加入的溶液,池中加入的溶液,进行电解。四个电极上所析出的物质的物质的量之比是( )
A. 2:2:4:1 B. 1:1:2:1 C. 2:1:1:1 D. 2:1:2:1
A
课堂小结
POWERPOINT
电解原理的应用
第四章第二节第二课时
学习目标
1、认识电解饱和食盐水、电镀、电解精炼铜、电冶金的原理,会写其电极反应式及总反应式
2.学会电解的有关计算,特别是守恒法的应用。
目录
CONTENT
01
氯碱工业
02
电镀
03
电解精炼铜
04
电冶金
氯气和烧碱是重要的化工原料。
工业上利用电解饱和食盐水制氯气和烧碱,称为氯碱工业。
Cl2
NaOH
阳极反应:
2Cl--2e-===Cl2↑
Cl->OH-
阳极离子放电顺序 :
阴极反应:
2H2O+2e-===H2↑+2OH-
H+>Na+
阴极离子放电顺序:
总反应化学方程式:
2Cl-+2H2O H2↑+Cl2↑+2OH-
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
电解
电解
应用:氯碱工业(教材106图4-11)
1、电 解饱和食盐水(氯碱工业)
缺点:
1. 阴极产生的H2和阳极产生的Cl2相混合可能会引起爆炸!
2. 阳极产生的Cl2与移向阳极的OH-反应影响烧碱的产量与纯度!
【问题探究】
下图装置是氯碱工业的原理,直接这样进行氯碱工业有什么缺点?工业上是通过什么方式解决这个问题的?
饱和NaCl溶液
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
惰性电极
阴 极
碳钢网
阳极室
阴极室
阳离子交换膜:只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
离子交换膜的作用:
(1)避免阳极产物Cl2与阴极产物OH-、H2 发生反应;
(2)能选择性的通过离子,起到平衡电荷、形成闭合回路的作用。
解决方法:
交换膜的分类及应用
知识拓展
练习1、右图为阳离子交换膜法电解饱和食盐水原理示意图。
下列说法不正确的是 ( )
A.从E口逸出的气体是Cl2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,
精制时先加Na2CO3溶液
AD
2、电镀
电镀是利用电解原理在某些金属表面镀上一薄层其他金属(如锌、铜、铬、镍等)或合金的加工工艺。目的是使金属增强抗腐蚀能力,增加表面硬度和美观。
【思考】如果想在铁制品表面镀上铜,该如何设计实验?
①电极式:
阳极:Cu - 2e- = Cu2+
阴极:Cu2+ + 2e- = Cu
②电镀液:
含Cu2+离子的电解质溶液
电镀池结构
①阴极-待镀金属
②阳极-镀层金属
一般是在空气或溶液中不易起变化的金属(Cu、Ni、Zn、Ag)
③电解液-含镀层金属阳离子的盐溶液
电镀的特点
电镀液的组成及酸碱性保持不变
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
练习2、在铜片上镀银时,下列叙述中错误的是( )
①将铜片接在电源的正极
②将银片接在电源的正极
③在铜片上发生的反应是Ag++e-=Ag
④在银片上发生的反应是4OH--4e-=O2↑+2H2O
⑤可用CuSO4溶液作电解质溶液
⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
C
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
练习3.在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,铁制品作阴极,溶液中含Zn2+
B.铂作阴极,铁制品作阳极,溶液中含Zn2+
C.铁作阳极,铁制品作阴极,溶液中含Fe2+
D.锌作阴极,铁制品作阳极,溶液中含Zn2+
A
3、金属的电解精炼
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。
电解精炼的结构
阳极--粗铜
阴极--纯铜
电解液-- CuSO4溶液
阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+
Au、Ag---阳极泥
阴极: Cu2+ +2e-=Cu
CuSO4溶液
精铜
粗铜
Ag Au
阳极泥
CuSO4溶液的浓度略减小
练习4、利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A. 电解时以精铜作阳极
B.电解时阳极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu = Cu2+ + 2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
D
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
练习5. 金属镍有广泛的用途,粗镍中含有少量等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知氧化性:)( )
A. 阳极发生还原反应,其电极反应式为
B. 电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C. 电解后,电解槽底部的阳极泥中含有和
D. 电解后,溶液中存在的金属阳离子只有和
C
4、电冶金
电解是最强有力的氧化还原手段。
电解法是冶炼金属的重要方法,特别是冶炼活泼金属(如冶炼钠、钙、镁、铝等活泼金属)
电解熔融氯化钠冶炼钠:
阴极反应:2Na+ + 2e- = 2Na
阳极反应:2Cl- - 2e- = Cl2↑
总反应:2NaCl === 2Na+Cl2↑
电解
(2)电解熔融的氯化镁:(制取金属镁)
阳极:
阴极:
2Cl - -2e- = Cl2↑
Mg2+ + 2e- = Mg
MgCl2(熔融) == Mg + Cl2 ↑
电解
(3)电解熔融的氧化铝:(制取金属铝)
阳极:
阴极:
总反应:
6O2- -12e- = 3O2↑
4Al3+ + 12e- = 4Al
2Al2O3(熔融) == 4Al + 3O2 ↑
电解
冰晶石
【思考】工业制取镁,用的氯化镁而不用氧化镁?制取铝时,用的是氧化铝而不用氯化铝?
原因:因为氧化镁的熔点比氯化镁高很多,浪费了能量 ;氯化铝是共价化合物,共价化合物为分子晶体,不能电解。而氧化铝是离子化合物,可电解。
【思考】电解熔融NaCl的方法可制备金属钠,金属Mg、Al如何制备呢?
石墨
石墨
阴极
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)降低Al2O3的熔点
电解池、电解精炼池、电镀池的比较
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
阳极:电源正极相连
阴极:电源负极相连
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
应用电解原理在某些金属表面镀上一层其它金属的装置。
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
练习6、海水提镁的最后一步是将氯化镁电解获取金属镁,下列有关该电解过程的叙述中,正确的是( )
A.两个电极必须都用惰性电极
B.阳极可以用金属电极,阴极必须是惰性电极
C.电解熔融状态的氯化镁
D.电解氯化镁的水溶液
C
5、电有机合成
阅读课本P109资料卡片了解电有机合成
阳极:H2O-2e-= 2H++1/2O2↑
丙烯(CH3CH=CH2)
丙烯腈(CH2=CHCN)
己二腈(NC(CH2)4CN)
阴极:2CH2=CHCN+2e-+2H+= NC(CH2)4CN
电解
总反应:2CH2=CHCN+2H2O ====NC(CH2)4CN+ 1/2O2
电解
练习7 .依据下图判断,下列叙述正确的是( )
A.Ⅰ是原电池,Ⅱ是电镀装置
B.Ⅰ、Ⅱ装置中锌极上均发生氧化反应
C.Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解
D.Ⅱ、Ⅲ装置中Cu2+ 浓度基本不变
A
练习8、关于下列各图的说法中,正确的是( )
A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中电子由b极流向a极
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
D
练习9、用石墨棒作电极,在Na+、Cu2+、Cl-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是________。
(2)当阴极析出金属,阳极放出O2时,电解质是________。
(3)当阴极放出H2,阳极放出Cl2时,电解质是________。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是________。
CuSO4
Na2SO4
CuSO4
NaCl
知识回顾
10. 如图所示,若电解,测得铜电极的质量增加。
问题1:电源中极是正极还是负极?
提示 负极。
铜极增重,说明银在铜极析出,则铜极为阴极,为负极。
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
问题2: 通电,中共收集到(标准状况)气体,溶液体积为(电解前后溶液的体积变化忽略不计),则通电前是多少?
中铜极增重,即析出,线路中通过电子。由,可知中产生的只有,即标准状况下的体积为。但中共收集到气体,说明还有气体是即全部在阴极放电后,接着放电产生了,则通过电子
时,已完全变为单质。由可知,则。
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
1.三个计算原则
(1)阳极失去的电子数等于阴极得到的电子数。
(2)串联电池中各电极上转移的电子数目相等。
(3)电源输出的电子总数和电解池中各电极上转移的电子数目相等。
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
2.三种常见计算方法
如以通过为桥梁可构建如下关系式:
背景内容一
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容三
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
背景内容五
请在此输入实验背景正文内容,建议正文字号为14-18。请在此输入实验背景正文内容,建议正文字号为14-18。
11. 如图所示的两个电解池中的电极均为铂电极,在池中加入的溶液,池中加入的溶液,进行电解。四个电极上所析出的物质的物质的量之比是( )
A. 2:2:4:1 B. 1:1:2:1 C. 2:1:1:1 D. 2:1:2:1
A
课堂小结
