高中化学人教版(2019)选择性必修2 1.2.2元素周期律 (共24张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修2 1.2.2元素周期律 (共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-08 20:08:22 | ||
图片预览






文档简介
(共24张PPT)
第二节 原子结构与元素的性质
第一章 原子结构与性质
第二课时 元素周期律
1.了解元素的电离能、电负性等概念
2.理解元素原子半径,元素第一电离能及元素的电负性呈现周期性变化
3.能应用元素电离能、电负性解释某些元素的性质
学习目标:
回顾与思考
1.回顾必修第一册第四章相关内容,回答什么是元素周期律?
2.除了原子核外电子排布、原子半径、元素化合价、元素金属性非金属性随原子序数递增呈周期性变化,元素原子还有哪些性质呈周性变化?
元素性质随着原子序数的递增呈周期性变化的规律
元素原子的电离能、电负性等
二、元素周期律
1.原子半径
(1)原子半径决定于什么因素?
能层数:
核电荷数:
电子的能层越多,电子之间的排斥作用越大,将使原子的半径增大。
核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。
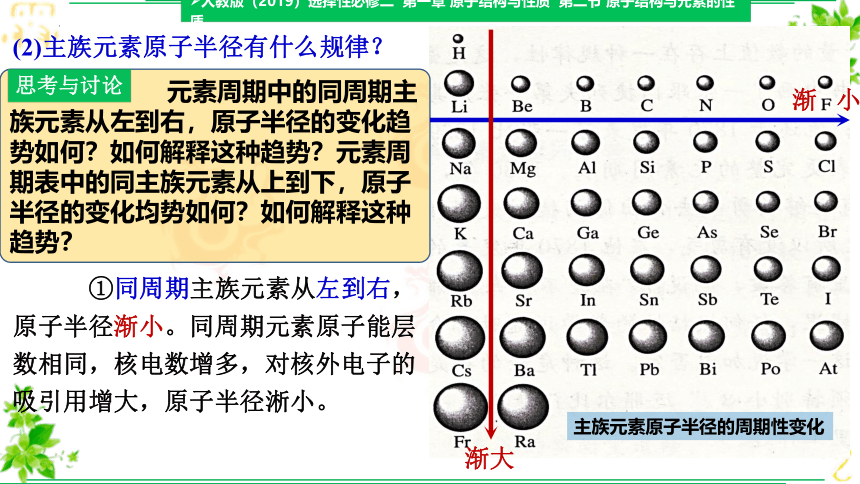
(2)主族元素原子半径有什么规律?
主族元素原子半径的周期性变化
元素周期中的同周期主族元素从左到右,原子半径的变化趋势如何?如何解释这种趋势?元素周期表中的同主族元素从上到下,原子半径的变化均势如何?如何解释这种趋势?
思考与讨论
①同周期主族元素从左到右,原子半径渐小。同周期元素原子能层数相同,核电数增多,对核外电子的吸引用增大,原子半径淅小。
渐 小
渐大
②同主族元素从上到下,原子半径渐大。同主族从下到下,能层数增大使原子半径增大的幅度大于因核电荷数增多引起的原子半径减小的幅度。
(3)怎么快速比较粒子半径大小?
同周期,序大径小:
如 r(Cl) < r(Al) < r(Na)
同主族,层多径大:
同结构,序大径小:
同元素,数大径大:
如 r(I)> r(Br)> r(Cl)> r(F)
如 r(Al3+)如 r(Al) > r(Al3+) r(S2-) > r(S) r(Fe2+) > r(Fe3+)
2.什么是电离能
(1)什么是第一电离能?
气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量。
(3)第一电离能有什么规律?
+1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫第二电离能,依次类推。
(2)电离能有什么意义?
电离能越小气态原子(或离子)越易失电子
电离能越大气态原子(或离子)越难失电子
原子序数
第一电离能(kJ·mol-1)
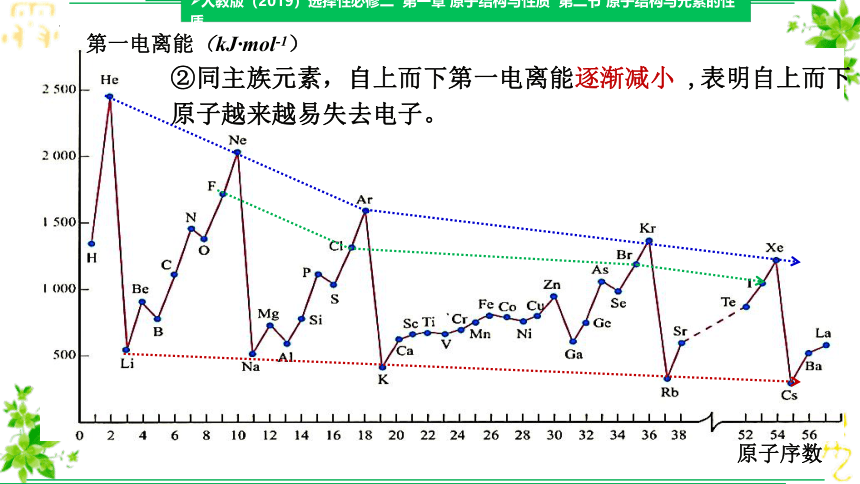
①每个周期的第一种元素(氢或碱金属)的第一电离能最小,最后一种元素(稀有气体)的第一电离能最大;从左到右,总体呈现增大趋势(有个别反常)。
第一电离能(kJ·mol-1)
原子序数
②同主族元素,自上而下第一电离能逐渐减小 ,表明自上而下原子越来越易失去电子。
第一电离能(kJ·mol-1)
原子序数
2s22p1
资料卡片
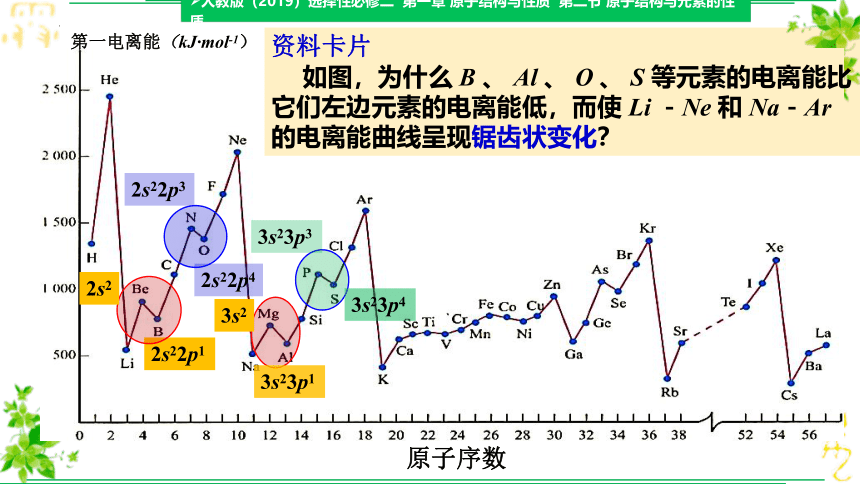
如图,为什么 B 、 Al 、 O 、 S 等元素的电离能比它们左边元素的电离能低,而使 Li -Ne 和 Na-Ar 的电离能曲线呈现锯齿状变化?
3s23p1
3s23p4
2s22p3
3s23p3
2s22p4
3s2
2s2
资料卡片
对于 B 和 Al 这两个锯齿状变化,一般解释为, B 和 Al 的第一电离能失去的电子是 np 能级的,该能级电子的能量比左边 Be 和 Mg 失去的 ns 能级电子的高。对于O和 S 这两个锯齿状变化,一般解释为: N 和 P 的电子排布是半充满的,比较稳定,电离能较高。
思考与讨论
对于 B 和 Al 这两个锯齿状变化,一般解释为, B 和 Al 的第一电离能失去的电子是 np 能级的,该能级电子的能量比左边 Be 和 Mg 失去的 ns 能级电子的高。对于O和 S 这两个锯齿状变化,一般解释为: N 和 P 的电子排布是半充满的,比较稳定,电离能较高。
(1)碱金属的电离能与碱金属的活泼性存在什么联系?
(2)下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
为什么原子的逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有什么联系?
思考与讨论
碱金属电离能越小,能量越高,越活泼,越易失去电子。
(2)同一元素的逐级电离能是逐渐增大的,这是由于原子失去一个电子变成+1价阳离子,半径变小,核电荷数未变而电子数变少,核对外层电子的吸引作用增强,使第二个电子比第一电子难失去,失去第二个电子比失去第一个电子需要更多的能量,依此类推。
化合价数=电离能突变前电离能组数。
由上表可知钠、镁、铝的电离能突变(此时,能层可能发生变化)前分别有一组、二组、三组变化不是很大的电离能数据,所以,化合价分别是+1、+2、+3。
元素相互化合,相邻的原子之间产生的强烈的化学作用力。
3. 电负性
(1) 什么是化学键?
(2)什么是键合电子?
原子中用于形成化学键的电子称为键合电子。
(3)什么是电负性?
用来描述不同元素的原子对键合电子的吸引力的大小(电负性是相对值,没单位)。
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱,金属性越强。
(4)电负性有什么意义?
氟4.0,锂1.0
作为相对标准
①同一周期,主族元素的电负性从左到右逐渐增大,表明其吸引电子的能力逐渐增强。
(5)电负性有什么规律?
②同一主族,元素的电负性从上到下呈现减小趋势,表明其吸引电子的能力逐渐减弱。
(6)电负性有哪些应用?
①电负性的大小可以作为判断金属性和非金属性强弱的尺度
金属:<1.8,类金属: ≈1.8,非金属:>1.8
②判断化学键的类型
一般认为如果两个成键元素原子间的电负性:差值大于1.7,它们之间通常形成离子键;差值小于1.7,它们之间通常形成共价键。
如:
NaCl CaO HCl AlCl3 H2O
电负性的差:
2.1
0.9
1.5
1.4
化学键类型:
离子 离子 共价 共价 共价
2.1
③判断元素化合价的正负
电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值;电负性数值大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
CO2
-2
+4
H2O
-2
+1
HCl
-1
+1
元素的电负性变化趋势
[绘制变化图]请利用图1-23的数据制作第三周期元素、第ⅠA族和ⅦA族元素的电负性变化图,并找出其变化趋势。
[比较与分析]根据图1-22,找出上述相关元素的第一电离能的变化趋势,与电负性的变化趋势有什么不同?并分析其原因。
探究
同周期从左到右电负性渐大,同主族到上到下电负性渐小。
同周期元素原子从左到右,第一电离能总体增加(个别反常),电负性渐大。因为,从左到右,原子半径渐小,原子核对最外层电子吸引力渐大,原子失电子能力渐弱,得电子能力渐强。
同主族元素原子从上到下,第一电离能渐小,电负性也渐小。因为,从上到下,原子半径渐大,原子核对最外层电子吸引力渐小,原子失电子能力渐强,得电子能力渐弱。
原子半径渐大,第一电离能总体减小,电负性渐小
原子半径渐大,第一电离能电、负性减小
原子半径渐小,第一电离能总体增大,电负性渐大
原子半径渐小,第一电离能电、负性减大
注意:电离能包括稀有气体,电负性不包括
小结:
稀有气体及其化合物的发现
1868年,天文学家洛克耶( J . N . Lockyer ,1836-1920)和森( P . C . Janssen ,1824-1907)在太阳光谱中发现了一种新元素,定名为氦( Helium )。20多年后,英国化学家拉姆齐( W 、 Ramsay ,1852-1916)在研究钇铀矿时发现了一种神秘的气体。他研究了这种气体的光谱,疑为氦,求助于光谱学家克鲁克斯,证实这种气体就是氦。这样氦在地球上也被发现了。
1892年,英国物理学家瑞利( L . Rayleigh ,1842-1919)在《自然》杂志上发表了一篇文章,说他在测定氮气的密度时,发现用氨气分解得到的氮气的密度为1.2508 g/L ,比从空气中分离出来的氮气的密度1.2572 g/L 小了一丁点儿!他没有放过这一丁点儿的差别,认为定有缘故,却又找不到答案。英国化学家拉姆齐读了这篇文章,提出一种假设:从氨气分解得到的氮气是纯净的,而空气里可能含有一种比氮气的密度更大的气体,因而源自空气的氮气不纯,测得的密度较大。
科学史话
稀有气体及其化合物的发现
这两位科学家决定合作,通过实验解开这个谜。他们从文献里读到卡文迪许( H . Cavendish ,1731-1810)分离空气组分气体的方法,仔细除去空气里的氧气、氮气、二氧化碳和水蒸气,发现残留了一种未知气体。这种未知气体的体积仅占空气的1/80。拉姆齐观察了这种未知气体的光谱,发现谱图里有不属于任何已知元素的橙、绿色两条谱线,认定是一种新的化学元素,随即和瑞利将它命名为氩( Argon )。
图1-26拉姆齐的实验装置图
1898年,拉姆齐与人合作又在液态空气中发现了三种新元素,分别命为氪( Krypton 、氖( Neon )、氙( Xenon )。1900年,发现放射性元素镭发生衰变释放的气体也是一种新元素,到1923年被最后定名为氡( Radon )。从1868年发现氦算起,到1923年发现氡,前前后后几经曲折,历时半个多世纪,稀有气体的整个家族成员才被全部确认。2006年,第七周期最后一种元素被人工合成(仅探测到4个原子),后定名为 Oganesson ,元素符号为 Og ,中文名称为 。理论预测该元素在常温常压下呈固态,难说是否属于稀有气体,但其归属和命名仍按稀有气体论。
自从发现稀有气体后,人们在很长时间里没有发现稀有气体的化合物。而且,它们的单质都是单原子分子的气体,被认为化学性质是惰性的,因而长期以来稀有气体一直被称为惰性气体。20世纪初,形成了原子核外电子排布的知识后,得知稀有气体原子的最外层电子数都为8,于是,就形成一种理论观念:任何原子,只要最外层电子数达到8,就变成稳定状态,称为惰性气体稳定结构。
气
奥
这个观念统治了化学近半个世纪。然而,1962年发生了重要转折,有一位名叫巴特利特( N . Bartlett )的青年化学家合成了氙的第一个化合物(如图1-27左),不久,在三个不同实验室里又分别合成了XeF2、 XeF4 和 XeF6 。三种简单化合物。人们终于发现,惰性气体不惰,遂改称稀有气体。迄今为止,已经发现的稀有气体化合物已达上百种,所有稀有气体都能形成化合物;除跟氟外,跟氢、氧、氮、碳、氯、磷······都能形成化学键。读了这段科学史话,你有什么感想?。
探索科学的道路不平坦,不仅需要渊博的学习,丰厚的文化积累,更需要用于探索、精益求精的精神,这样才能攀登科技高峰。
再 见 !
第二节 原子结构与元素的性质
第一章 原子结构与性质
第二课时 元素周期律
1.了解元素的电离能、电负性等概念
2.理解元素原子半径,元素第一电离能及元素的电负性呈现周期性变化
3.能应用元素电离能、电负性解释某些元素的性质
学习目标:
回顾与思考
1.回顾必修第一册第四章相关内容,回答什么是元素周期律?
2.除了原子核外电子排布、原子半径、元素化合价、元素金属性非金属性随原子序数递增呈周期性变化,元素原子还有哪些性质呈周性变化?
元素性质随着原子序数的递增呈周期性变化的规律
元素原子的电离能、电负性等
二、元素周期律
1.原子半径
(1)原子半径决定于什么因素?
能层数:
核电荷数:
电子的能层越多,电子之间的排斥作用越大,将使原子的半径增大。
核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。
(2)主族元素原子半径有什么规律?
主族元素原子半径的周期性变化
元素周期中的同周期主族元素从左到右,原子半径的变化趋势如何?如何解释这种趋势?元素周期表中的同主族元素从上到下,原子半径的变化均势如何?如何解释这种趋势?
思考与讨论
①同周期主族元素从左到右,原子半径渐小。同周期元素原子能层数相同,核电数增多,对核外电子的吸引用增大,原子半径淅小。
渐 小
渐大
②同主族元素从上到下,原子半径渐大。同主族从下到下,能层数增大使原子半径增大的幅度大于因核电荷数增多引起的原子半径减小的幅度。
(3)怎么快速比较粒子半径大小?
同周期,序大径小:
如 r(Cl) < r(Al) < r(Na)
同主族,层多径大:
同结构,序大径小:
同元素,数大径大:
如 r(I)> r(Br)> r(Cl)> r(F)
如 r(Al3+)
2.什么是电离能
(1)什么是第一电离能?
气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量。
(3)第一电离能有什么规律?
+1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫第二电离能,依次类推。
(2)电离能有什么意义?
电离能越小气态原子(或离子)越易失电子
电离能越大气态原子(或离子)越难失电子
原子序数
第一电离能(kJ·mol-1)
①每个周期的第一种元素(氢或碱金属)的第一电离能最小,最后一种元素(稀有气体)的第一电离能最大;从左到右,总体呈现增大趋势(有个别反常)。
第一电离能(kJ·mol-1)
原子序数
②同主族元素,自上而下第一电离能逐渐减小 ,表明自上而下原子越来越易失去电子。
第一电离能(kJ·mol-1)
原子序数
2s22p1
资料卡片
如图,为什么 B 、 Al 、 O 、 S 等元素的电离能比它们左边元素的电离能低,而使 Li -Ne 和 Na-Ar 的电离能曲线呈现锯齿状变化?
3s23p1
3s23p4
2s22p3
3s23p3
2s22p4
3s2
2s2
资料卡片
对于 B 和 Al 这两个锯齿状变化,一般解释为, B 和 Al 的第一电离能失去的电子是 np 能级的,该能级电子的能量比左边 Be 和 Mg 失去的 ns 能级电子的高。对于O和 S 这两个锯齿状变化,一般解释为: N 和 P 的电子排布是半充满的,比较稳定,电离能较高。
思考与讨论
对于 B 和 Al 这两个锯齿状变化,一般解释为, B 和 Al 的第一电离能失去的电子是 np 能级的,该能级电子的能量比左边 Be 和 Mg 失去的 ns 能级电子的高。对于O和 S 这两个锯齿状变化,一般解释为: N 和 P 的电子排布是半充满的,比较稳定,电离能较高。
(1)碱金属的电离能与碱金属的活泼性存在什么联系?
(2)下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
为什么原子的逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有什么联系?
思考与讨论
碱金属电离能越小,能量越高,越活泼,越易失去电子。
(2)同一元素的逐级电离能是逐渐增大的,这是由于原子失去一个电子变成+1价阳离子,半径变小,核电荷数未变而电子数变少,核对外层电子的吸引作用增强,使第二个电子比第一电子难失去,失去第二个电子比失去第一个电子需要更多的能量,依此类推。
化合价数=电离能突变前电离能组数。
由上表可知钠、镁、铝的电离能突变(此时,能层可能发生变化)前分别有一组、二组、三组变化不是很大的电离能数据,所以,化合价分别是+1、+2、+3。
元素相互化合,相邻的原子之间产生的强烈的化学作用力。
3. 电负性
(1) 什么是化学键?
(2)什么是键合电子?
原子中用于形成化学键的电子称为键合电子。
(3)什么是电负性?
用来描述不同元素的原子对键合电子的吸引力的大小(电负性是相对值,没单位)。
电负性越大,元素的非金属性越强,电负性越小,元素的非金属性越弱,金属性越强。
(4)电负性有什么意义?
氟4.0,锂1.0
作为相对标准
①同一周期,主族元素的电负性从左到右逐渐增大,表明其吸引电子的能力逐渐增强。
(5)电负性有什么规律?
②同一主族,元素的电负性从上到下呈现减小趋势,表明其吸引电子的能力逐渐减弱。
(6)电负性有哪些应用?
①电负性的大小可以作为判断金属性和非金属性强弱的尺度
金属:<1.8,类金属: ≈1.8,非金属:>1.8
②判断化学键的类型
一般认为如果两个成键元素原子间的电负性:差值大于1.7,它们之间通常形成离子键;差值小于1.7,它们之间通常形成共价键。
如:
NaCl CaO HCl AlCl3 H2O
电负性的差:
2.1
0.9
1.5
1.4
化学键类型:
离子 离子 共价 共价 共价
2.1
③判断元素化合价的正负
电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值;电负性数值大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
CO2
-2
+4
H2O
-2
+1
HCl
-1
+1
元素的电负性变化趋势
[绘制变化图]请利用图1-23的数据制作第三周期元素、第ⅠA族和ⅦA族元素的电负性变化图,并找出其变化趋势。
[比较与分析]根据图1-22,找出上述相关元素的第一电离能的变化趋势,与电负性的变化趋势有什么不同?并分析其原因。
探究
同周期从左到右电负性渐大,同主族到上到下电负性渐小。
同周期元素原子从左到右,第一电离能总体增加(个别反常),电负性渐大。因为,从左到右,原子半径渐小,原子核对最外层电子吸引力渐大,原子失电子能力渐弱,得电子能力渐强。
同主族元素原子从上到下,第一电离能渐小,电负性也渐小。因为,从上到下,原子半径渐大,原子核对最外层电子吸引力渐小,原子失电子能力渐强,得电子能力渐弱。
原子半径渐大,第一电离能总体减小,电负性渐小
原子半径渐大,第一电离能电、负性减小
原子半径渐小,第一电离能总体增大,电负性渐大
原子半径渐小,第一电离能电、负性减大
注意:电离能包括稀有气体,电负性不包括
小结:
稀有气体及其化合物的发现
1868年,天文学家洛克耶( J . N . Lockyer ,1836-1920)和森( P . C . Janssen ,1824-1907)在太阳光谱中发现了一种新元素,定名为氦( Helium )。20多年后,英国化学家拉姆齐( W 、 Ramsay ,1852-1916)在研究钇铀矿时发现了一种神秘的气体。他研究了这种气体的光谱,疑为氦,求助于光谱学家克鲁克斯,证实这种气体就是氦。这样氦在地球上也被发现了。
1892年,英国物理学家瑞利( L . Rayleigh ,1842-1919)在《自然》杂志上发表了一篇文章,说他在测定氮气的密度时,发现用氨气分解得到的氮气的密度为1.2508 g/L ,比从空气中分离出来的氮气的密度1.2572 g/L 小了一丁点儿!他没有放过这一丁点儿的差别,认为定有缘故,却又找不到答案。英国化学家拉姆齐读了这篇文章,提出一种假设:从氨气分解得到的氮气是纯净的,而空气里可能含有一种比氮气的密度更大的气体,因而源自空气的氮气不纯,测得的密度较大。
科学史话
稀有气体及其化合物的发现
这两位科学家决定合作,通过实验解开这个谜。他们从文献里读到卡文迪许( H . Cavendish ,1731-1810)分离空气组分气体的方法,仔细除去空气里的氧气、氮气、二氧化碳和水蒸气,发现残留了一种未知气体。这种未知气体的体积仅占空气的1/80。拉姆齐观察了这种未知气体的光谱,发现谱图里有不属于任何已知元素的橙、绿色两条谱线,认定是一种新的化学元素,随即和瑞利将它命名为氩( Argon )。
图1-26拉姆齐的实验装置图
1898年,拉姆齐与人合作又在液态空气中发现了三种新元素,分别命为氪( Krypton 、氖( Neon )、氙( Xenon )。1900年,发现放射性元素镭发生衰变释放的气体也是一种新元素,到1923年被最后定名为氡( Radon )。从1868年发现氦算起,到1923年发现氡,前前后后几经曲折,历时半个多世纪,稀有气体的整个家族成员才被全部确认。2006年,第七周期最后一种元素被人工合成(仅探测到4个原子),后定名为 Oganesson ,元素符号为 Og ,中文名称为 。理论预测该元素在常温常压下呈固态,难说是否属于稀有气体,但其归属和命名仍按稀有气体论。
自从发现稀有气体后,人们在很长时间里没有发现稀有气体的化合物。而且,它们的单质都是单原子分子的气体,被认为化学性质是惰性的,因而长期以来稀有气体一直被称为惰性气体。20世纪初,形成了原子核外电子排布的知识后,得知稀有气体原子的最外层电子数都为8,于是,就形成一种理论观念:任何原子,只要最外层电子数达到8,就变成稳定状态,称为惰性气体稳定结构。
气
奥
这个观念统治了化学近半个世纪。然而,1962年发生了重要转折,有一位名叫巴特利特( N . Bartlett )的青年化学家合成了氙的第一个化合物(如图1-27左),不久,在三个不同实验室里又分别合成了XeF2、 XeF4 和 XeF6 。三种简单化合物。人们终于发现,惰性气体不惰,遂改称稀有气体。迄今为止,已经发现的稀有气体化合物已达上百种,所有稀有气体都能形成化合物;除跟氟外,跟氢、氧、氮、碳、氯、磷······都能形成化学键。读了这段科学史话,你有什么感想?。
探索科学的道路不平坦,不仅需要渊博的学习,丰厚的文化积累,更需要用于探索、精益求精的精神,这样才能攀登科技高峰。
再 见 !
