课题4 化学式与化合价
图片预览









文档简介
课件57张PPT。 [复习提问]1.写出下列元素的符号:氮 硫 铁 镁 氧 铜 N S Fe Mg O Cu2、写出下列物质的化学符号:氧气 水 二氧化碳 高锰酸钾
氧化镁 五氧化二磷 氯酸钾
3.现有①碳 ②氧气 ③胆矾 ④水
⑤空气 ⑥高锰酸钾 ⑦四氧化三铁、
⑧盐水 等8种物质,其中属于:A.单质的有____________;
B.化合物的有__________;
C.氧化物的有_________;
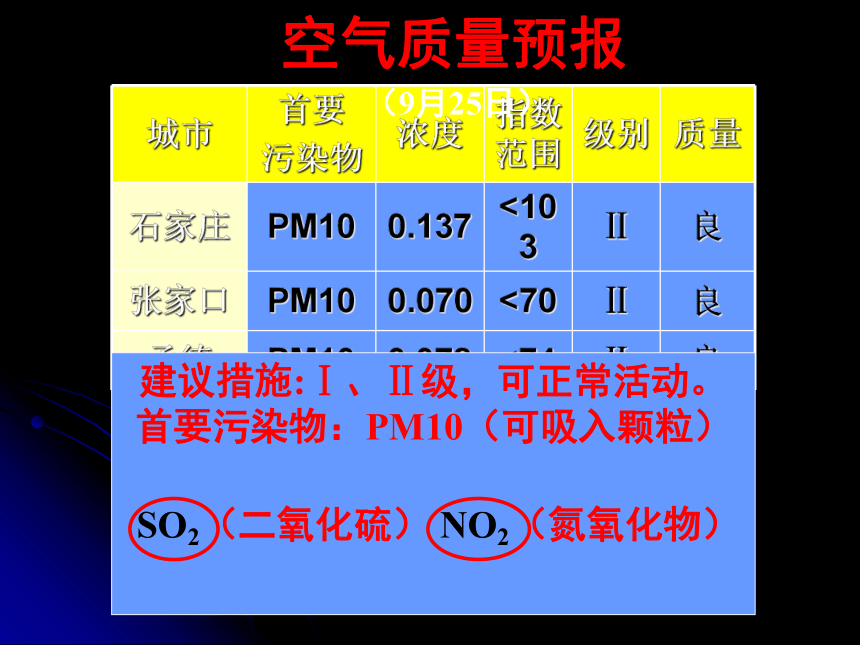
D.混合物的有_________.①②③④⑥⑦④⑦⑤⑧课题4 化学式与化合价 猜一猜 这款化妆品最有可能属于下列哪种类型的产品:( )A.祛皱型B.美白型C.保湿型C建议措施:Ⅰ、Ⅱ级,可正常活动。 首要污染物:PM10(可吸入颗粒)
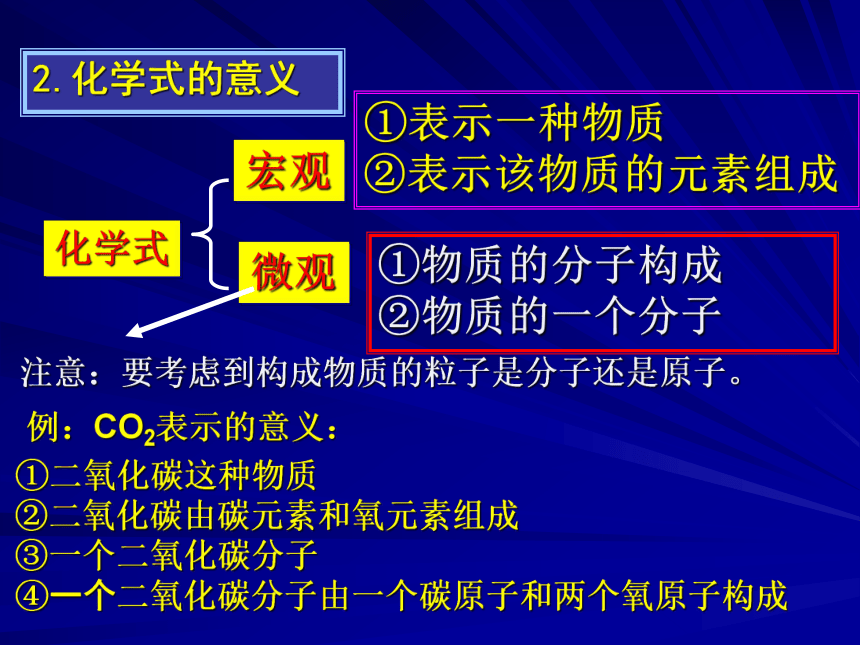
SO2(二氧化硫) NO2(氮氧化物) 空气质量预报(9月25日)1.【概念】用元素符号和数字组合表示物质组成的式子叫化学式。一、什么是化学式?【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。2.化学式的意义①表示一种物质
②表示该物质的元素组成 ①物质的分子构成
②物质的一个分子宏观微观化学式注意:要考虑到构成物质的粒子是分子还是原子。①二氧化碳这种物质
②二氧化碳由碳元素和氧元素组成
③一个二氧化碳分子
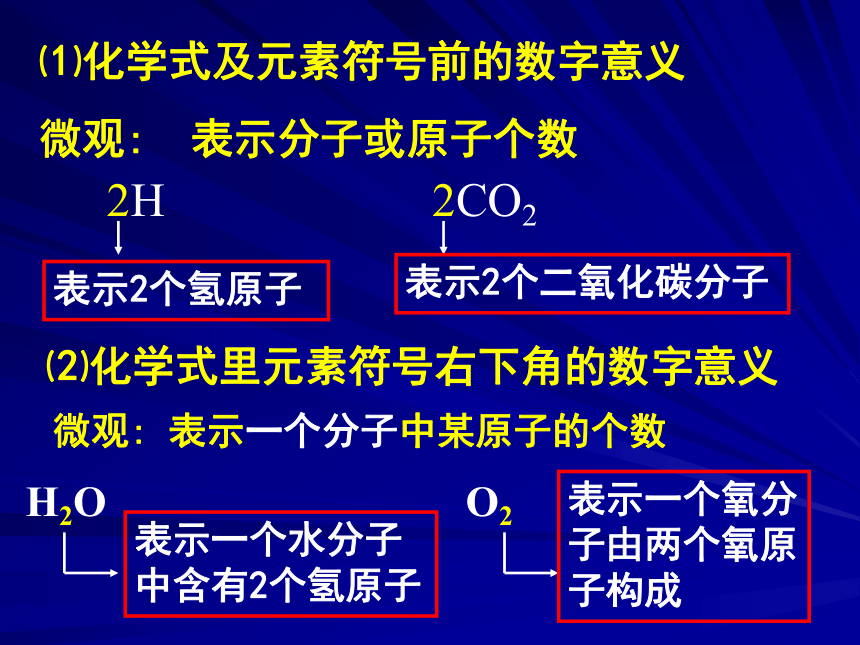
④一个二氧化碳分子由一个碳原子和两个氧原子构成例:CO2表示的意义:表示2个氢原子表示2个二氧化碳分子表示一个水分子中含有2个氢原子表示一个氧分子由两个氧原子构成①表示氢元素;②一个氢原子。
表示两个氢原子。
①表示氢气这种物质②氢气由氢元素组成③一个氢气分子④一个氢气分子由两个氢原子构成。
表示两个氢气分子。H:2H:2H2:H2:【课堂练习】说出下列符号所表示的含义:【练习】 指出下列符号中“2”的意义:O2 2H2O 2CO2 nH2SO4(硫酸)【练习】指出下列符号的意义:3H2O 2O2 CO2 4P2O5 n个HgO1.用化学用语表示:
两个氮分子_____,3个铁原子____,冰______,
n个氧化汞分子_____,液氧____,5个水分子___.2N23FeH2OnHgOO25H2O3.化学式的书写单质(1)金属和某些固态非金属单质
(结构较复杂,直接用元素符号表示)
如:Fe、Cu、Al,C、S、P 等(3)双原子或多原子分子构成的单质
如:O2、N2、H2、Br2、O3 等
元素符号加角标数(2)稀有气体
由原子构成,用元素符号表示
如:He、Ne、Ar 等化合物③一般规律正价写前面,负价写后面
①由金属和非金属组成的化合物如: 氯化钠 硫化锌 三氯化铁 NaCl ZnS FeCl3书写规律:金前非后,数字在后②氧化物:二氧化硫 四氧化三铁 五氧化二磷 SO2 Fe3O4 P2O5书写规律:另前氧后,数字在后4、化学式的读法:从后往前读——“某化某”或“某酸某”①两种元素组成:“某化某”,并读出角标数②三种元素组成:有酸根时读成“某酸某”二氧化碳五氧化二磷CO2P2O5氯酸钾KClO3KMnO4高锰酸钾CaCO3碳酸钙CuSO4硫酸铜1、说出下列物质名称和化学式氧气___、氢气____、铁___、铝___水___二氧化碳____五氧化二磷————①空气中含量最多的两种气体是——、——,
②污染空气的三种有害气体是——、——、——
③A元素的原子核电荷数为1,B元素是地壳中含量最多的元素,由A、B两种元素组成的化合物的化学式是——————;2、按要求写出化学式:根据 Na Mg Cl 三种元素的原子结构示意图,写出 氯化钠、氯化镁 的化学式 。为什么?NaClMgCl2结论:化合物中各元素的原子间有一定的比值第四单元 课题4 化合价与化学式 21、化合价概念:一种元素与其他元素按一定数目比相化合的性质二、化合价化合物都有固定的组成,元素的原子之间有固定的个数比,如:化合物中元素化合价的代数和为零2.化合价的标法和含义+2MgMgO+2+2价的镁元素在氧化镁中镁元素的化合价为+2价+1+2+3-1-2离子符号和化合价的表示方法不同:
离子符号歪带帽,先写数值后写号。
化合价正带帽,后写数值先写号。化合价与离子所带电荷有关:数字相同比较并找规律离子符号和化合价的比较:【基础练习】2H22Mg2+CO2-22H说明下列符号中数字“2”的含义3.化合价的一般规律⑴化合价有正价和负价,在化合物中:①氧元素通常显-2价
②氢元素通常显+1价
③金属元素跟非金属化合时,金属元素通常显正价,非金属通常元素显负价三个通常①在单质分子里,元素化合价为0
②在化合物里正负化合价的代数和为0两个零元素的变价:一些元素在不同的化合物中可显不同的化合价.FeO +2例如:氧化亚铁氧化铁一般规律记忆法:金正、非负、单质零、氢为+1、 氧-2、 正负总价和为零4、原子团:作为一个整体参加反应的原子集团(就好象一个原子一样),原子团也叫做根。氢氧根离子铵根离子硝酸根离子碳酸根离子硫酸根离子磷酸根离子记住
化合价硫酸根:SO4 -2价
碳酸根:CO3 -2价
氢氧根:OH -1价
硝酸根:NO3 -1价
铵 根:NH4 +1价氯酸根:ClO3 -1价 _
高锰酸根:MnO4-1价
锰酸根:MnO4 -2价
亚硫酸根:SO3 -2价
原子团化合价化合价口诀
正一:氢、锂、钾、钠、银,
正二:钙、镁、铜、钡、锌,
正三:铝、 正四:硅 ,
正五、负三氮和磷。
碳有正二和正四,
铁有正二和正三,
硫有负二、正四和正六。
氢为正一、氧负二,
单质为零不能忘。
[附]:酸根化合价
负一:氢氧根和硝酸根,(氯酸根、高锰酸根)
负二:碳酸根和硫酸根,(锰酸根、亚硫酸根)
负三:只有磷酸根,
正一:记住是铵根。常见元素化合价口诀指出下列符号中“2”的意义1、 2N ,
2、H2 ,
3、O2 ,
4、2O2 ,
5、2Na+ ,
6、Mg2+ ,7、Fe2+
8、2Fe3+
9、2NH4+
10、H2O
11、SO42-
12、Mg
13 SO2+2-25.化合价的应用⑴标出化学式中各元素的化合价:
原则:在化合物中正负化合价的代数和为零尝试题1、标出下列物质中各元素的化合价:
氯化锌 金属锌 氢氧化钠 ZnCl2 Zn NaOH+2-10-2+1+1标出下列物质中各元素的化合价:
(1)MgO (2)K20 (3) H20 (4)Ca(OH)2+2 -2+1-2+1-2+2 -2+1(2)根据化学式确定某元素的化合价尝试题2、试确定氯酸钾中氯元素的化合价【思路】先写出化学式KClO3设未知数解:设KClO3中Cl的化合价为X列等式(正负总价和为0)+1+X+(-2) ×3=0解答X=+5
答:氯酸钾中氯元素的化合价为+5+ 5依据:以代数和为零的原则,由不变推可变1、说出下列物质中硫元素的化合价
H2S S H2SO3 H2SO4
2、试确定下列化合物中原子团的化合价
KOH Mg(NO3)2 BaSO4 Na2CO3 Na3PO4-20+4+6-1-1-2-2-3想一想原子团的化合价都是负价吗?不是,如 NH4+1试一试 标出下列物质中划线
元素的化合价O2 H2O NaCl H2S 0 -2 +1 -2KClO3 H2SO4 KMnO4 +5 +6 +7 Ca(OH)2 +2⑶根据化合价书写化学式:尝试题1、已知磷元素有两种氧化物,其中磷的化合价
分别为+3和+5,写出这两种磷的氧化物的化学式【思路】(1)先写元素符号(正前负后)P OP O(2)标出各元素的化合价(正上)+ 3 -2P O依据:正前、负后、和为零P O+ 5 -2(3)把化合价数值化为最简(4)把化简后的数字交叉写在
相应元素符号的右下角(1省略不写)P2 O 3+ 3 -2+ 5 -2P2 O 5P2 O3P2O5省略1、当硫元素显 +4 价时,试确定其氧化物的化学式2、填表:写出各物质的化学式负价元素正价元素化学式-1-2+1+2+3SO2(S OS O+4 -2S O+2 -1SO2)HClMgCl2AlCl3H2SO4MgSO4Al 2(SO4)3能力赛场选择:
1、已知在H3RO4 中,氢元素为+1价,氧为-2价,则其中 R的化合价为( )
A +3 B +4 C +5 D +6
2、下列化合物中,氮元素为+5价的是( )
A NO B NO2 C HNO2 D KNO3
3、元素R的氧化物的化学式为R2O3,则R 元素与OH-组 成 的物质的化学式为( )
A ROH B R(OH) 2 C R(OH) 3 D R(OH) 4CDC比一比,赛一赛 【填空】
下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ______,
氯化铁 FeCl2 ______,
氯化锌 ZnCl ______,
硫化铝 Al3 S2 ______,
氢氧化铜CuOH __________,
氯化钠ClNa ______,CaOFeCl3ZnCl2Al2S3Cu(OH)2NaCl综合应用:
某物质的化学式为HnRO2n-1,则该化合物中R 元 素的化合价为________ . +(3n-2)【解法 】:解:(1)设R的化合价为x
(+1) ·n+x+(-2) ·(2n-1)=0
n+x-4n+2=0
x=+(3n-2)
小结化学式判断化合价书写正负总价和为0一般原则:符号、标价、约简、交叉请用数字和符号表示1、两个氢原子 8、三个氢氧根离子
2、一个氮分子 9、两个氧离子
3、两个氧分子 10、三个水分子
4、氖气 11、两个硝酸根离子
5、铁的化学式 12、铜元素
6、三个亚铁离子 13、硫元素的化合价是-2
7、一个硫离子 14、两个铵根离子
15、二氧化碳中氧元素的化合价是-2 按要求填写下列空格1,写出空气中含量最多物质的化学式____2,写出地壳中含量最多的元素名称______3,写出最轻气体的物质名称______4、写出人体中含量最多的金属元素的符号___5,最易自燃物质的化学式_____6,3个铁离子的化学符号______四氧化三铁__、氧化镁___氧化铝___氧化铜___、二氧化锰___氯酸钾___、氯化钾____、高锰酸钾
____、锰酸钾____、双氧水___写出下列反应的化学方程式, 注明反应类型(分解反应、化合反应)1、用高锰酸钾制氧气
2、用氯酸钾和二氧化锰制氧气
3、用双氧水制氧气
4、电解水
5、氢气在空气中燃烧发生爆炸6、红磷在空气中燃烧
7、硫在空气中燃烧
8、铁丝在氧气中燃
9、木炭在空气中燃烧三、有关相对分子质量的计算∴H2O的相对分子质量
=1×2+16=18H2O的意义:一个H2O分子是由两个H原子和一个O原子构成的。相对分子质量的理解真实质量:一个H2O分子的质量=两个H原子+一个O原子的质量相对质量:一个H2O分子的相对分子质量=两个H原子相对原子质量+一个O原子的相对原子质量第四单元 课题4 化合价与化学式 31、定义:化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr) .计算 H2SO4和H3PO4的相对分子质量【说明】每种纯净物的组成是固定不变的,所以,每种纯净物的相对分子质量也是固定不变的。如:H2:2 O2:32 H2O:18 CO2:44 计算2 (NH4)2SO4的相对分子质量的总和2.计算物质组成元素的质量比例1:求Fe2O3中铁元素和氧元素的质量比。Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3物质组成元素的质量比就是相对原子质量与该原子个数乘积之比例2:计算锰酸钾(K2MnO4)中各元素的质
量比。【解】 K2MnO4中K:Mn:O元素的质量比
= (39×2):55:(16×4)=78:55:64练习:⑴计算NH4NO3 中各元素的质量比
⑵计算CH3COOH中各元素的质量比3.计算物质中某元素的质量分数:【公式】例:⑴计算二氧化硫中硫元素的质量分数⑴ SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数
=某元素的质量分数=化合物中该元素的相对原子质量×原子个数化合物的相对分子质量×100%⑵计算80tNH4NO3中含氮元素的质量解: 80tNH4NO3中含氮元素的质量
=80t×35%=28t4.计算一定质量的化合物中某一元素的质量:⑶多少克KMnO4中含氧元素128g?解:128g÷40.5%=316g【练习】1.质量相同的SO2和SO3两种物质中,
所含硫元素的质量比。5:4【能力提高】【例1】元素R、M形成的化合物中,R与M的元素质量比为3:1,R与M的相对原子质量之比12:1,则该化合物的化学式为?RM4【练习】在化合物R2M3,元素R与元素M的质量比为9:8,则R与M的相对原子质量之比为.27:16练习1、根据四氧化三铁的化学式计算:
⑴四氧化三铁的相对分子质量;
⑵四氧化三铁中含铁的质量分数;
⑶四氧化铁中铁、氧两种元素的质量比;
⑷10克四氧化铁中含铁多少克?
⑸多少克氧化铁与11.6克四氧化三铁中含铁两相等23272.41%21:87.24g12g第四单元 课题4 化合价与化学式 小测 Ca—40 C—12 O—16
补充 1、计算碳酸钙(CaCO3)的相对分子质量。
2、计算碳酸钙(CaCO3)中各元素的质量比。
3、计算碳酸钙(CaCO3)中氧元素的质量分数。4、用元素符号或化学式表示①三个水分子 ____
② 两个钡原子 _______③五个氯分子________
④八个氯原子 _____⑤硫化钾中,硫元素显-2价__
⑥化合物中,铜元素显+2价_______
① 计算硝酸铵(NH4NO3)中氮元素的质量分数。
② 计算尿素[CO(NH2 ) 2]中氮元素的质量分数。【能力提高】【例1】质量相等的SO2和SO3这两种物质中所含的分子个数比是多少?所含O原子的个数比是多少?【解】 设SO2和SO3的质量都为1,而SO2和SO3的相对分子质量分别是64和80,所以有:水二氧化碳氧气氯酸钾五氧化二磷氮气H2OCO2O2KClO3P2O5N2
氧化镁 五氧化二磷 氯酸钾
3.现有①碳 ②氧气 ③胆矾 ④水
⑤空气 ⑥高锰酸钾 ⑦四氧化三铁、
⑧盐水 等8种物质,其中属于:A.单质的有____________;
B.化合物的有__________;
C.氧化物的有_________;
D.混合物的有_________.①②③④⑥⑦④⑦⑤⑧课题4 化学式与化合价 猜一猜 这款化妆品最有可能属于下列哪种类型的产品:( )A.祛皱型B.美白型C.保湿型C建议措施:Ⅰ、Ⅱ级,可正常活动。 首要污染物:PM10(可吸入颗粒)
SO2(二氧化硫) NO2(氮氧化物) 空气质量预报(9月25日)1.【概念】用元素符号和数字组合表示物质组成的式子叫化学式。一、什么是化学式?【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。2.化学式的意义①表示一种物质
②表示该物质的元素组成 ①物质的分子构成
②物质的一个分子宏观微观化学式注意:要考虑到构成物质的粒子是分子还是原子。①二氧化碳这种物质
②二氧化碳由碳元素和氧元素组成
③一个二氧化碳分子
④一个二氧化碳分子由一个碳原子和两个氧原子构成例:CO2表示的意义:表示2个氢原子表示2个二氧化碳分子表示一个水分子中含有2个氢原子表示一个氧分子由两个氧原子构成①表示氢元素;②一个氢原子。
表示两个氢原子。
①表示氢气这种物质②氢气由氢元素组成③一个氢气分子④一个氢气分子由两个氢原子构成。
表示两个氢气分子。H:2H:2H2:H2:【课堂练习】说出下列符号所表示的含义:【练习】 指出下列符号中“2”的意义:O2 2H2O 2CO2 nH2SO4(硫酸)【练习】指出下列符号的意义:3H2O 2O2 CO2 4P2O5 n个HgO1.用化学用语表示:
两个氮分子_____,3个铁原子____,冰______,
n个氧化汞分子_____,液氧____,5个水分子___.2N23FeH2OnHgOO25H2O3.化学式的书写单质(1)金属和某些固态非金属单质
(结构较复杂,直接用元素符号表示)
如:Fe、Cu、Al,C、S、P 等(3)双原子或多原子分子构成的单质
如:O2、N2、H2、Br2、O3 等
元素符号加角标数(2)稀有气体
由原子构成,用元素符号表示
如:He、Ne、Ar 等化合物③一般规律正价写前面,负价写后面
①由金属和非金属组成的化合物如: 氯化钠 硫化锌 三氯化铁 NaCl ZnS FeCl3书写规律:金前非后,数字在后②氧化物:二氧化硫 四氧化三铁 五氧化二磷 SO2 Fe3O4 P2O5书写规律:另前氧后,数字在后4、化学式的读法:从后往前读——“某化某”或“某酸某”①两种元素组成:“某化某”,并读出角标数②三种元素组成:有酸根时读成“某酸某”二氧化碳五氧化二磷CO2P2O5氯酸钾KClO3KMnO4高锰酸钾CaCO3碳酸钙CuSO4硫酸铜1、说出下列物质名称和化学式氧气___、氢气____、铁___、铝___水___二氧化碳____五氧化二磷————①空气中含量最多的两种气体是——、——,
②污染空气的三种有害气体是——、——、——
③A元素的原子核电荷数为1,B元素是地壳中含量最多的元素,由A、B两种元素组成的化合物的化学式是——————;2、按要求写出化学式:根据 Na Mg Cl 三种元素的原子结构示意图,写出 氯化钠、氯化镁 的化学式 。为什么?NaClMgCl2结论:化合物中各元素的原子间有一定的比值第四单元 课题4 化合价与化学式 21、化合价概念:一种元素与其他元素按一定数目比相化合的性质二、化合价化合物都有固定的组成,元素的原子之间有固定的个数比,如:化合物中元素化合价的代数和为零2.化合价的标法和含义+2MgMgO+2+2价的镁元素在氧化镁中镁元素的化合价为+2价+1+2+3-1-2离子符号和化合价的表示方法不同:
离子符号歪带帽,先写数值后写号。
化合价正带帽,后写数值先写号。化合价与离子所带电荷有关:数字相同比较并找规律离子符号和化合价的比较:【基础练习】2H22Mg2+CO2-22H说明下列符号中数字“2”的含义3.化合价的一般规律⑴化合价有正价和负价,在化合物中:①氧元素通常显-2价
②氢元素通常显+1价
③金属元素跟非金属化合时,金属元素通常显正价,非金属通常元素显负价三个通常①在单质分子里,元素化合价为0
②在化合物里正负化合价的代数和为0两个零元素的变价:一些元素在不同的化合物中可显不同的化合价.FeO +2例如:氧化亚铁氧化铁一般规律记忆法:金正、非负、单质零、氢为+1、 氧-2、 正负总价和为零4、原子团:作为一个整体参加反应的原子集团(就好象一个原子一样),原子团也叫做根。氢氧根离子铵根离子硝酸根离子碳酸根离子硫酸根离子磷酸根离子记住
化合价硫酸根:SO4 -2价
碳酸根:CO3 -2价
氢氧根:OH -1价
硝酸根:NO3 -1价
铵 根:NH4 +1价氯酸根:ClO3 -1价 _
高锰酸根:MnO4-1价
锰酸根:MnO4 -2价
亚硫酸根:SO3 -2价
原子团化合价化合价口诀
正一:氢、锂、钾、钠、银,
正二:钙、镁、铜、钡、锌,
正三:铝、 正四:硅 ,
正五、负三氮和磷。
碳有正二和正四,
铁有正二和正三,
硫有负二、正四和正六。
氢为正一、氧负二,
单质为零不能忘。
[附]:酸根化合价
负一:氢氧根和硝酸根,(氯酸根、高锰酸根)
负二:碳酸根和硫酸根,(锰酸根、亚硫酸根)
负三:只有磷酸根,
正一:记住是铵根。常见元素化合价口诀指出下列符号中“2”的意义1、 2N ,
2、H2 ,
3、O2 ,
4、2O2 ,
5、2Na+ ,
6、Mg2+ ,7、Fe2+
8、2Fe3+
9、2NH4+
10、H2O
11、SO42-
12、Mg
13 SO2+2-25.化合价的应用⑴标出化学式中各元素的化合价:
原则:在化合物中正负化合价的代数和为零尝试题1、标出下列物质中各元素的化合价:
氯化锌 金属锌 氢氧化钠 ZnCl2 Zn NaOH+2-10-2+1+1标出下列物质中各元素的化合价:
(1)MgO (2)K20 (3) H20 (4)Ca(OH)2+2 -2+1-2+1-2+2 -2+1(2)根据化学式确定某元素的化合价尝试题2、试确定氯酸钾中氯元素的化合价【思路】先写出化学式KClO3设未知数解:设KClO3中Cl的化合价为X列等式(正负总价和为0)+1+X+(-2) ×3=0解答X=+5
答:氯酸钾中氯元素的化合价为+5+ 5依据:以代数和为零的原则,由不变推可变1、说出下列物质中硫元素的化合价
H2S S H2SO3 H2SO4
2、试确定下列化合物中原子团的化合价
KOH Mg(NO3)2 BaSO4 Na2CO3 Na3PO4-20+4+6-1-1-2-2-3想一想原子团的化合价都是负价吗?不是,如 NH4+1试一试 标出下列物质中划线
元素的化合价O2 H2O NaCl H2S 0 -2 +1 -2KClO3 H2SO4 KMnO4 +5 +6 +7 Ca(OH)2 +2⑶根据化合价书写化学式:尝试题1、已知磷元素有两种氧化物,其中磷的化合价
分别为+3和+5,写出这两种磷的氧化物的化学式【思路】(1)先写元素符号(正前负后)P OP O(2)标出各元素的化合价(正上)+ 3 -2P O依据:正前、负后、和为零P O+ 5 -2(3)把化合价数值化为最简(4)把化简后的数字交叉写在
相应元素符号的右下角(1省略不写)P2 O 3+ 3 -2+ 5 -2P2 O 5P2 O3P2O5省略1、当硫元素显 +4 价时,试确定其氧化物的化学式2、填表:写出各物质的化学式负价元素正价元素化学式-1-2+1+2+3SO2(S OS O+4 -2S O+2 -1SO2)HClMgCl2AlCl3H2SO4MgSO4Al 2(SO4)3能力赛场选择:
1、已知在H3RO4 中,氢元素为+1价,氧为-2价,则其中 R的化合价为( )
A +3 B +4 C +5 D +6
2、下列化合物中,氮元素为+5价的是( )
A NO B NO2 C HNO2 D KNO3
3、元素R的氧化物的化学式为R2O3,则R 元素与OH-组 成 的物质的化学式为( )
A ROH B R(OH) 2 C R(OH) 3 D R(OH) 4CDC比一比,赛一赛 【填空】
下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ______,
氯化铁 FeCl2 ______,
氯化锌 ZnCl ______,
硫化铝 Al3 S2 ______,
氢氧化铜CuOH __________,
氯化钠ClNa ______,CaOFeCl3ZnCl2Al2S3Cu(OH)2NaCl综合应用:
某物质的化学式为HnRO2n-1,则该化合物中R 元 素的化合价为________ . +(3n-2)【解法 】:解:(1)设R的化合价为x
(+1) ·n+x+(-2) ·(2n-1)=0
n+x-4n+2=0
x=+(3n-2)
小结化学式判断化合价书写正负总价和为0一般原则:符号、标价、约简、交叉请用数字和符号表示1、两个氢原子 8、三个氢氧根离子
2、一个氮分子 9、两个氧离子
3、两个氧分子 10、三个水分子
4、氖气 11、两个硝酸根离子
5、铁的化学式 12、铜元素
6、三个亚铁离子 13、硫元素的化合价是-2
7、一个硫离子 14、两个铵根离子
15、二氧化碳中氧元素的化合价是-2 按要求填写下列空格1,写出空气中含量最多物质的化学式____2,写出地壳中含量最多的元素名称______3,写出最轻气体的物质名称______4、写出人体中含量最多的金属元素的符号___5,最易自燃物质的化学式_____6,3个铁离子的化学符号______四氧化三铁__、氧化镁___氧化铝___氧化铜___、二氧化锰___氯酸钾___、氯化钾____、高锰酸钾
____、锰酸钾____、双氧水___写出下列反应的化学方程式, 注明反应类型(分解反应、化合反应)1、用高锰酸钾制氧气
2、用氯酸钾和二氧化锰制氧气
3、用双氧水制氧气
4、电解水
5、氢气在空气中燃烧发生爆炸6、红磷在空气中燃烧
7、硫在空气中燃烧
8、铁丝在氧气中燃
9、木炭在空气中燃烧三、有关相对分子质量的计算∴H2O的相对分子质量
=1×2+16=18H2O的意义:一个H2O分子是由两个H原子和一个O原子构成的。相对分子质量的理解真实质量:一个H2O分子的质量=两个H原子+一个O原子的质量相对质量:一个H2O分子的相对分子质量=两个H原子相对原子质量+一个O原子的相对原子质量第四单元 课题4 化合价与化学式 31、定义:化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr) .计算 H2SO4和H3PO4的相对分子质量【说明】每种纯净物的组成是固定不变的,所以,每种纯净物的相对分子质量也是固定不变的。如:H2:2 O2:32 H2O:18 CO2:44 计算2 (NH4)2SO4的相对分子质量的总和2.计算物质组成元素的质量比例1:求Fe2O3中铁元素和氧元素的质量比。Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3物质组成元素的质量比就是相对原子质量与该原子个数乘积之比例2:计算锰酸钾(K2MnO4)中各元素的质
量比。【解】 K2MnO4中K:Mn:O元素的质量比
= (39×2):55:(16×4)=78:55:64练习:⑴计算NH4NO3 中各元素的质量比
⑵计算CH3COOH中各元素的质量比3.计算物质中某元素的质量分数:【公式】例:⑴计算二氧化硫中硫元素的质量分数⑴ SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数
=某元素的质量分数=化合物中该元素的相对原子质量×原子个数化合物的相对分子质量×100%⑵计算80tNH4NO3中含氮元素的质量解: 80tNH4NO3中含氮元素的质量
=80t×35%=28t4.计算一定质量的化合物中某一元素的质量:⑶多少克KMnO4中含氧元素128g?解:128g÷40.5%=316g【练习】1.质量相同的SO2和SO3两种物质中,
所含硫元素的质量比。5:4【能力提高】【例1】元素R、M形成的化合物中,R与M的元素质量比为3:1,R与M的相对原子质量之比12:1,则该化合物的化学式为?RM4【练习】在化合物R2M3,元素R与元素M的质量比为9:8,则R与M的相对原子质量之比为.27:16练习1、根据四氧化三铁的化学式计算:
⑴四氧化三铁的相对分子质量;
⑵四氧化三铁中含铁的质量分数;
⑶四氧化铁中铁、氧两种元素的质量比;
⑷10克四氧化铁中含铁多少克?
⑸多少克氧化铁与11.6克四氧化三铁中含铁两相等23272.41%21:87.24g12g第四单元 课题4 化合价与化学式 小测 Ca—40 C—12 O—16
补充 1、计算碳酸钙(CaCO3)的相对分子质量。
2、计算碳酸钙(CaCO3)中各元素的质量比。
3、计算碳酸钙(CaCO3)中氧元素的质量分数。4、用元素符号或化学式表示①三个水分子 ____
② 两个钡原子 _______③五个氯分子________
④八个氯原子 _____⑤硫化钾中,硫元素显-2价__
⑥化合物中,铜元素显+2价_______
① 计算硝酸铵(NH4NO3)中氮元素的质量分数。
② 计算尿素[CO(NH2 ) 2]中氮元素的质量分数。【能力提高】【例1】质量相等的SO2和SO3这两种物质中所含的分子个数比是多少?所含O原子的个数比是多少?【解】 设SO2和SO3的质量都为1,而SO2和SO3的相对分子质量分别是64和80,所以有:水二氧化碳氧气氯酸钾五氧化二磷氮气H2OCO2O2KClO3P2O5N2
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
