第5章初识酸和碱复习题九年级化学沪教版(上海)第二学期(含答案)
文档属性
| 名称 | 第5章初识酸和碱复习题九年级化学沪教版(上海)第二学期(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 148.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-09 18:33:12 | ||
图片预览

文档简介
第5章初识酸和碱复习题
一、单选题
1.消除铁制品表面的锈可用
A.水 B.稀盐酸 C.洗涤剂 D.食盐水
2.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是
A.铜制塑像 B.镀锌水管 C.大理石栏杆 D.铝合金门窗
3.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
4.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
5.水是化学学习和研究的重要物质。下列有关水的说法错误的是
A.有水生成的反应一定是中和反应 B.水是一种常见的溶剂
C.水通电分解得到两种单质 D.自然界水循环的途径是水的三态转化
6.下列关于酸的说法错误的是
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸和稀硫酸都可用于金属除锈
C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
D.稀硫酸能够与活泼金属反应制取氢气
7.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡,经过一段时间后,下列有关叙述正确的是( )
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏右,食盐溶液一定饱和,烧碱潮解
C.指针偏左,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定变浓,烧碱潮解
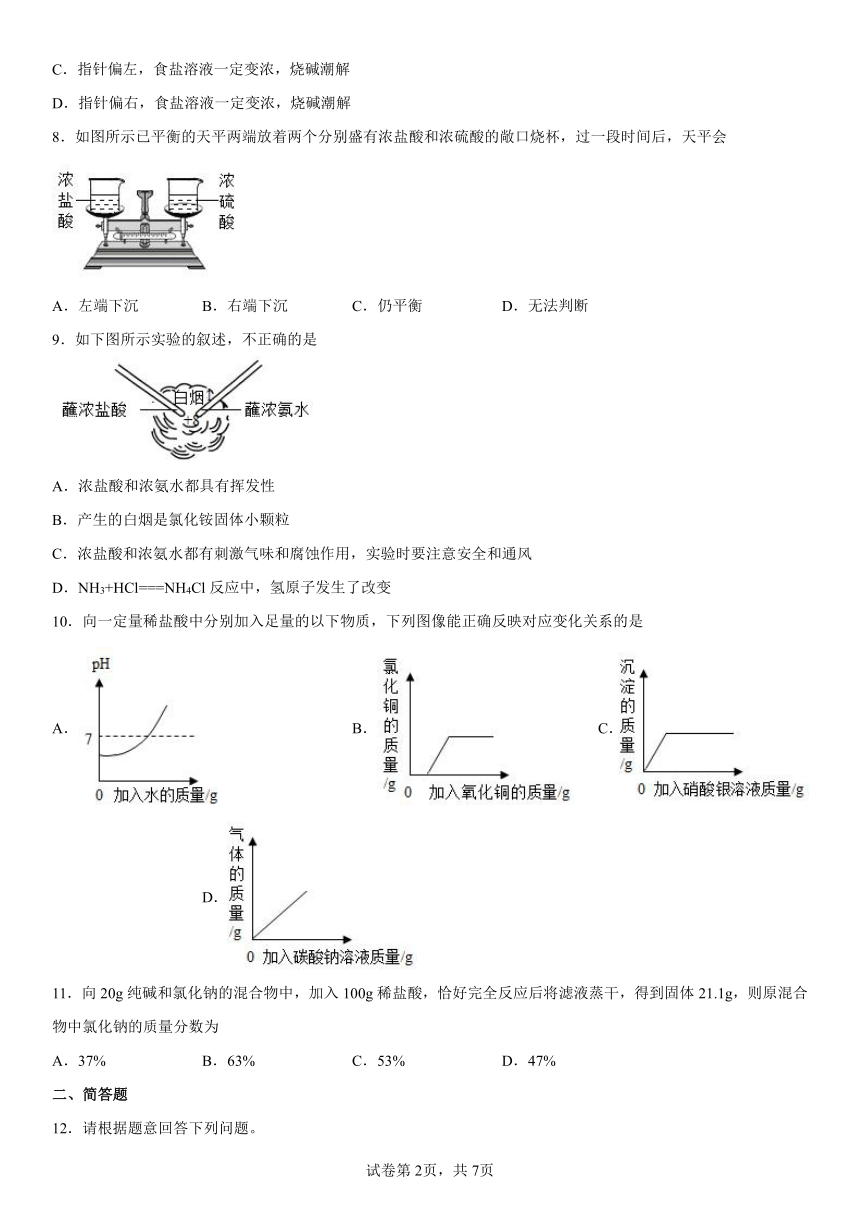
8.如图所示已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会
A.左端下沉 B.右端下沉 C.仍平衡 D.无法判断
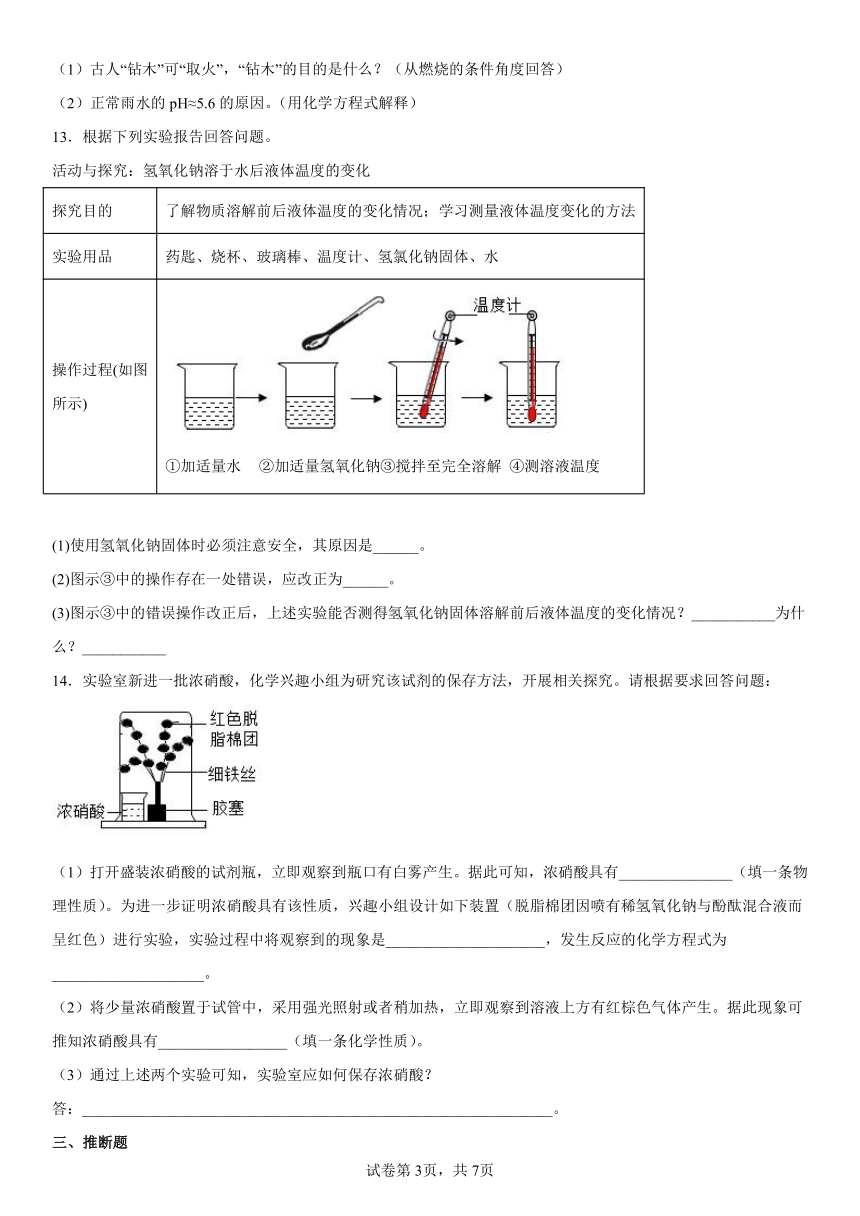
9.如下图所示实验的叙述,不正确的是
A.浓盐酸和浓氨水都具有挥发性
B.产生的白烟是氯化铵固体小颗粒
C.浓盐酸和浓氨水都有刺激气味和腐蚀作用,实验时要注意安全和通风
D.NH3+HCl===NH4Cl反应中,氢原子发生了改变
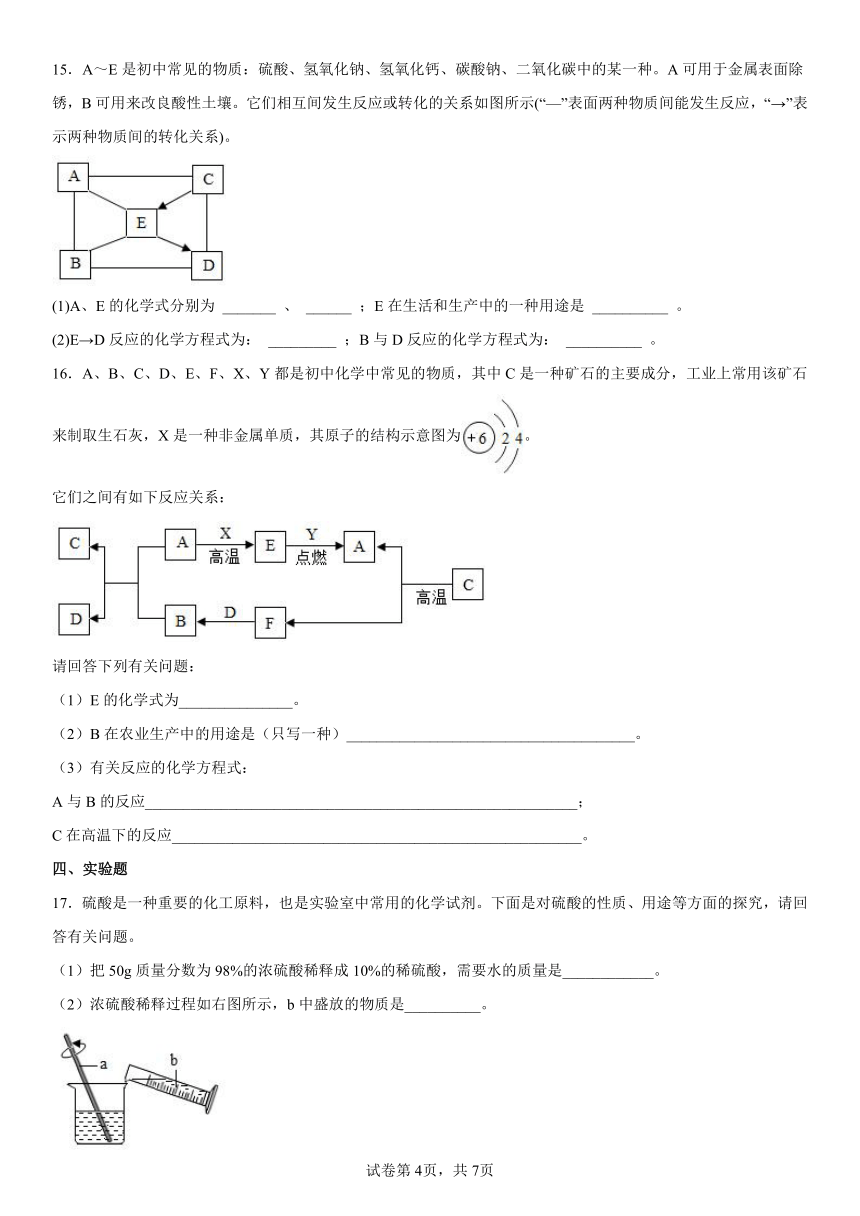
10.向一定量稀盐酸中分别加入足量的以下物质,下列图像能正确反映对应变化关系的是
A. B. C. D.
11.向20g纯碱和氯化钠的混合物中,加入100g稀盐酸,恰好完全反应后将滤液蒸干,得到固体21.1g,则原混合物中氯化钠的质量分数为
A.37% B.63% C.53% D.47%
二、简答题
12.请根据题意回答下列问题。
(1)古人“钻木”可“取火”,“钻木”的目的是什么?(从燃烧的条件角度回答)
(2)正常雨水的pH≈5.6的原因。(用化学方程式解释)
13.根据下列实验报告回答问题。
活动与探究:氢氧化钠溶于水后液体温度的变化
探究目的 了解物质溶解前后液体温度的变化情况;学习测量液体温度变化的方法
实验用品 药匙、烧杯、玻璃棒、温度计、氢氯化钠固体、水
操作过程(如图 所示) ①加适量水 ②加适量氢氧化钠③搅拌至完全溶解 ④测溶液温度
(1)使用氢氧化钠固体时必须注意安全,其原因是______。
(2)图示③中的操作存在一处错误,应改正为______。
(3)图示③中的错误操作改正后,上述实验能否测得氢氧化钠固体溶解前后液体温度的变化情况?___________为什么?___________
14.实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据要求回答问题:
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有_______________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如下装置(脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是_____________________,发生反应的化学方程式为____________________。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。据此现象可推知浓硝酸具有_________________(填一条化学性质)。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?
答:______________________________________________________________。
三、推断题
15.A~E是初中常见的物质:硫酸、氢氧化钠、氢氧化钙、碳酸钠、二氧化碳中的某一种。A可用于金属表面除锈,B可用来改良酸性土壤。它们相互间发生反应或转化的关系如图所示(“—”表面两种物质间能发生反应,“→”表示两种物质间的转化关系)。
(1)A、E的化学式分别为 _______ 、 ______ ;E在生活和生产中的一种用途是 __________ 。
(2)E→D反应的化学方程式为: _________ ;B与D反应的化学方程式为: __________ 。
16.A、B、C、D、E、F、X、Y都是初中化学中常见的物质,其中C是一种矿石的主要成分,工业上常用该矿石来制取生石灰,X是一种非金属单质,其原子的结构示意图为。
它们之间有如下反应关系:
请回答下列有关问题:
(1)E的化学式为_______________。
(2)B在农业生产中的用途是(只写一种)______________________________________。
(3)有关反应的化学方程式:
A与B的反应_________________________________________________________;
C在高温下的反应______________________________________________________。
四、实验题
17.硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。下面是对硫酸的性质、用途等方面的探究,请回答有关问题。
(1)把50g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是____________。
(2)浓硫酸稀释过程如右图所示,b中盛放的物质是__________。
(3)如下图所示将过量的稀硫酸分别加入A~E五只烧杯中。
①根据金属活动性顺序解释A烧杯中无明显现象的原因___________。
②反应结束后,B烧杯溶液中的溶质为___________(填化学式)。
③证明C中发生了化学反应的现象是__________。
④D中反应的化学方程式___________。
⑤根据E烧杯中的反应,写出硫酸的一种用途____________。
18.下图是化学兴趣小组同学设计和改进的实验装置,请你参与他们的探究活动。回答下列问题:
(1)图1:小镜同学用一根粗铜丝绕成线圈罩在蜡烛的火焰上,火焰很快熄灭。请分析蜡烛火焰熄灭的原因 ______ ,此实验说明金属铜具有 ______ 性。小易同学在铺有一层纯碱粉末的烧杯中点燃一支蜡烛,然后沿着烧杯壁缓缓倒入稀硫酸,蜡烛火焰熄灭。请分析蜡烛熄灭的原因 ______ 。
(2)图2:小含同学在烧杯中加入浓氨水;在烧杯、中都加入 蒸馏水,并分别滴加3滴酚酞试液于蒸馏水中,得到无色溶液。用一只大烧杯把、两烧杯罩在一起,几分钟后,溶液颜色变成红色的烧杯是 ______ (填“”“”或“”),请你用分子的知识解释烧杯中溶液变红的原因 ______ 。
19.实验小组用图甲所示装置探究盐酸与氢氧化钠的反应,结果如图乙所示。
(1)稀盐酸和氢氧化钠反应的化学方程式为 ________ 。
(2)b点时,烧瓶内的溶液呈 ______ (填“酸”“碱”或“中”)性。
(3)在a、b、c、d四点中,对应甲中烧瓶内溶液呈无色的是 ______ (填字母序号)。
五、计算题
20.称取5g含杂质的氢氧化钙固体样品放入烧杯中,向烧杯中加入50g溶质的质量分数为7.3%的稀盐酸(假设杂质不与稀盐酸反应),二者恰好完全反应。请计算:固体样品中氢氧化钙的质量分数。
21.将10%HCl溶液和未知浓度的NaOH溶液混合均匀并测量记录溶液温度,实验结果如有图所示,每次实验中HCl溶液和NaOH溶液的质量总和始终保持46.5g,根据相关信息回答下列问题:
(1)该反应是_____(填“吸热”或“放热”)反应;
(2)恰好反应时盐酸溶液的质量为_____g;
(3)计算NaOH溶液的溶质质量分数_____。(写出计算过程)
(4)当滴加盐酸41.5g时,所得溶液中氯化钠的溶质质量分数为______。(保留小数点后两位小数)
22.有一道作业题:取100 g溶质质量分数为8%的氢氧化钠溶液倒入烧杯中,向其中加入100 g 19.6%的稀硫酸,充分反应后,求所得溶液中硫酸钠的质量分数。批改时老师发现两种答案:
结果编号 ① ②
计算结果 14.2% 7.1%
请你分析并回答问题:
(1)氢氧化钠与硫酸反应时的质量比为________。
(2)请判断哪个结果是正确的______。(写出计算过程)
(3)反应前后钠元素的质量________(填“增大”“减小”或“不变”)。
23.为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入92g稀硫酸,恰好完全反应,测得剩余固体的质量为2g(杂质不溶于水也不与酸反应)。
(1)样品中Fe2O3的质量为 g。
(2)计算反应后所得溶液中溶质的质量分数(要求写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.C
5.A
6.C
7.D
8.B
9.D
10.C
11.D
12.(1)摩擦生热,使温度达到可燃物的着火点。
(2)CO2+H2O===H2CO3
13. 氢氧化钠具有腐蚀性 使用玻璃棒搅拌 不能 因为没有测量加入氢氧化钠固体前水的温度
14. 挥发性 脱脂棉由红色褪成无色 易分解的性质 避光,密封保存
15. H2SO4 Na2CO3 生产洗涤剂(合理即可) Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2= CaCO3↓+H2O
16. CO 改良酸性土壤 CO2 +Ca(OH)2 =CaCO3↓+ H2O CaCO3CaO+CO2↑
17. 440g 浓硫酸 铜在金属活动性顺序中排在H后,不能与酸发生反应(或不能置换出酸中的氢) H2SO4和MgSO4 溶液红色褪去 除铁锈(或生产硫酸铁)
18. 铜丝具有导热性,能将蜡烛燃烧产生的热量传导出去,使得蜡烛周围的温度低于蜡烛的着火点,致使蜡烛的火焰熄灭(合理即可) 导热 烧杯中的纯碱与稀硫酸反应产生大量的二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛熄灭(合理即可) 浓氨水具有挥发性,氨分子运动到烧杯中,溶于水得到氨水,氨水呈碱性,遇酚酞试液,会使溶液变为红色(合理即可)
19. 碱 c、d
20.74%
21.(1)放热(2)36.5(3)40%(详见解析)(4)6.29%
22.(1)40∶49(2)7.1%(3)7.1%
23.(1)8
(2)解:设硫酸铁的溶质质量为x。
x=20g
反应后所得溶液中溶质的质量分数=
答:反应后所得溶液中溶质的质量分数为20%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.消除铁制品表面的锈可用
A.水 B.稀盐酸 C.洗涤剂 D.食盐水
2.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是
A.铜制塑像 B.镀锌水管 C.大理石栏杆 D.铝合金门窗
3.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
4.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
5.水是化学学习和研究的重要物质。下列有关水的说法错误的是
A.有水生成的反应一定是中和反应 B.水是一种常见的溶剂
C.水通电分解得到两种单质 D.自然界水循环的途径是水的三态转化
6.下列关于酸的说法错误的是
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸和稀硫酸都可用于金属除锈
C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
D.稀硫酸能够与活泼金属反应制取氢气
7.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡,经过一段时间后,下列有关叙述正确的是( )
A.指针偏左,食盐溶液一定变稀,烧碱潮解
B.指针偏右,食盐溶液一定饱和,烧碱潮解
C.指针偏左,食盐溶液一定变浓,烧碱潮解
D.指针偏右,食盐溶液一定变浓,烧碱潮解
8.如图所示已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会
A.左端下沉 B.右端下沉 C.仍平衡 D.无法判断
9.如下图所示实验的叙述,不正确的是
A.浓盐酸和浓氨水都具有挥发性
B.产生的白烟是氯化铵固体小颗粒
C.浓盐酸和浓氨水都有刺激气味和腐蚀作用,实验时要注意安全和通风
D.NH3+HCl===NH4Cl反应中,氢原子发生了改变
10.向一定量稀盐酸中分别加入足量的以下物质,下列图像能正确反映对应变化关系的是
A. B. C. D.
11.向20g纯碱和氯化钠的混合物中,加入100g稀盐酸,恰好完全反应后将滤液蒸干,得到固体21.1g,则原混合物中氯化钠的质量分数为
A.37% B.63% C.53% D.47%
二、简答题
12.请根据题意回答下列问题。
(1)古人“钻木”可“取火”,“钻木”的目的是什么?(从燃烧的条件角度回答)
(2)正常雨水的pH≈5.6的原因。(用化学方程式解释)
13.根据下列实验报告回答问题。
活动与探究:氢氧化钠溶于水后液体温度的变化
探究目的 了解物质溶解前后液体温度的变化情况;学习测量液体温度变化的方法
实验用品 药匙、烧杯、玻璃棒、温度计、氢氯化钠固体、水
操作过程(如图 所示) ①加适量水 ②加适量氢氧化钠③搅拌至完全溶解 ④测溶液温度
(1)使用氢氧化钠固体时必须注意安全,其原因是______。
(2)图示③中的操作存在一处错误,应改正为______。
(3)图示③中的错误操作改正后,上述实验能否测得氢氧化钠固体溶解前后液体温度的变化情况?___________为什么?___________
14.实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据要求回答问题:
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有_______________(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如下装置(脱脂棉团因喷有稀氢氧化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是_____________________,发生反应的化学方程式为____________________。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。据此现象可推知浓硝酸具有_________________(填一条化学性质)。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?
答:______________________________________________________________。
三、推断题
15.A~E是初中常见的物质:硫酸、氢氧化钠、氢氧化钙、碳酸钠、二氧化碳中的某一种。A可用于金属表面除锈,B可用来改良酸性土壤。它们相互间发生反应或转化的关系如图所示(“—”表面两种物质间能发生反应,“→”表示两种物质间的转化关系)。
(1)A、E的化学式分别为 _______ 、 ______ ;E在生活和生产中的一种用途是 __________ 。
(2)E→D反应的化学方程式为: _________ ;B与D反应的化学方程式为: __________ 。
16.A、B、C、D、E、F、X、Y都是初中化学中常见的物质,其中C是一种矿石的主要成分,工业上常用该矿石来制取生石灰,X是一种非金属单质,其原子的结构示意图为。
它们之间有如下反应关系:
请回答下列有关问题:
(1)E的化学式为_______________。
(2)B在农业生产中的用途是(只写一种)______________________________________。
(3)有关反应的化学方程式:
A与B的反应_________________________________________________________;
C在高温下的反应______________________________________________________。
四、实验题
17.硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。下面是对硫酸的性质、用途等方面的探究,请回答有关问题。
(1)把50g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是____________。
(2)浓硫酸稀释过程如右图所示,b中盛放的物质是__________。
(3)如下图所示将过量的稀硫酸分别加入A~E五只烧杯中。
①根据金属活动性顺序解释A烧杯中无明显现象的原因___________。
②反应结束后,B烧杯溶液中的溶质为___________(填化学式)。
③证明C中发生了化学反应的现象是__________。
④D中反应的化学方程式___________。
⑤根据E烧杯中的反应,写出硫酸的一种用途____________。
18.下图是化学兴趣小组同学设计和改进的实验装置,请你参与他们的探究活动。回答下列问题:
(1)图1:小镜同学用一根粗铜丝绕成线圈罩在蜡烛的火焰上,火焰很快熄灭。请分析蜡烛火焰熄灭的原因 ______ ,此实验说明金属铜具有 ______ 性。小易同学在铺有一层纯碱粉末的烧杯中点燃一支蜡烛,然后沿着烧杯壁缓缓倒入稀硫酸,蜡烛火焰熄灭。请分析蜡烛熄灭的原因 ______ 。
(2)图2:小含同学在烧杯中加入浓氨水;在烧杯、中都加入 蒸馏水,并分别滴加3滴酚酞试液于蒸馏水中,得到无色溶液。用一只大烧杯把、两烧杯罩在一起,几分钟后,溶液颜色变成红色的烧杯是 ______ (填“”“”或“”),请你用分子的知识解释烧杯中溶液变红的原因 ______ 。
19.实验小组用图甲所示装置探究盐酸与氢氧化钠的反应,结果如图乙所示。
(1)稀盐酸和氢氧化钠反应的化学方程式为 ________ 。
(2)b点时,烧瓶内的溶液呈 ______ (填“酸”“碱”或“中”)性。
(3)在a、b、c、d四点中,对应甲中烧瓶内溶液呈无色的是 ______ (填字母序号)。
五、计算题
20.称取5g含杂质的氢氧化钙固体样品放入烧杯中,向烧杯中加入50g溶质的质量分数为7.3%的稀盐酸(假设杂质不与稀盐酸反应),二者恰好完全反应。请计算:固体样品中氢氧化钙的质量分数。
21.将10%HCl溶液和未知浓度的NaOH溶液混合均匀并测量记录溶液温度,实验结果如有图所示,每次实验中HCl溶液和NaOH溶液的质量总和始终保持46.5g,根据相关信息回答下列问题:
(1)该反应是_____(填“吸热”或“放热”)反应;
(2)恰好反应时盐酸溶液的质量为_____g;
(3)计算NaOH溶液的溶质质量分数_____。(写出计算过程)
(4)当滴加盐酸41.5g时,所得溶液中氯化钠的溶质质量分数为______。(保留小数点后两位小数)
22.有一道作业题:取100 g溶质质量分数为8%的氢氧化钠溶液倒入烧杯中,向其中加入100 g 19.6%的稀硫酸,充分反应后,求所得溶液中硫酸钠的质量分数。批改时老师发现两种答案:
结果编号 ① ②
计算结果 14.2% 7.1%
请你分析并回答问题:
(1)氢氧化钠与硫酸反应时的质量比为________。
(2)请判断哪个结果是正确的______。(写出计算过程)
(3)反应前后钠元素的质量________(填“增大”“减小”或“不变”)。
23.为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入92g稀硫酸,恰好完全反应,测得剩余固体的质量为2g(杂质不溶于水也不与酸反应)。
(1)样品中Fe2O3的质量为 g。
(2)计算反应后所得溶液中溶质的质量分数(要求写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.C
5.A
6.C
7.D
8.B
9.D
10.C
11.D
12.(1)摩擦生热,使温度达到可燃物的着火点。
(2)CO2+H2O===H2CO3
13. 氢氧化钠具有腐蚀性 使用玻璃棒搅拌 不能 因为没有测量加入氢氧化钠固体前水的温度
14. 挥发性 脱脂棉由红色褪成无色 易分解的性质 避光,密封保存
15. H2SO4 Na2CO3 生产洗涤剂(合理即可) Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2= CaCO3↓+H2O
16. CO 改良酸性土壤 CO2 +Ca(OH)2 =CaCO3↓+ H2O CaCO3CaO+CO2↑
17. 440g 浓硫酸 铜在金属活动性顺序中排在H后,不能与酸发生反应(或不能置换出酸中的氢) H2SO4和MgSO4 溶液红色褪去 除铁锈(或生产硫酸铁)
18. 铜丝具有导热性,能将蜡烛燃烧产生的热量传导出去,使得蜡烛周围的温度低于蜡烛的着火点,致使蜡烛的火焰熄灭(合理即可) 导热 烧杯中的纯碱与稀硫酸反应产生大量的二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛熄灭(合理即可) 浓氨水具有挥发性,氨分子运动到烧杯中,溶于水得到氨水,氨水呈碱性,遇酚酞试液,会使溶液变为红色(合理即可)
19. 碱 c、d
20.74%
21.(1)放热(2)36.5(3)40%(详见解析)(4)6.29%
22.(1)40∶49(2)7.1%(3)7.1%
23.(1)8
(2)解:设硫酸铁的溶质质量为x。
x=20g
反应后所得溶液中溶质的质量分数=
答:反应后所得溶液中溶质的质量分数为20%
答案第1页,共2页
答案第1页,共2页
