化学人教版(2019)选择性必修3 2.2.2 炔烃 考点课件(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.2 炔烃 考点课件(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-11 11:15:26 | ||
图片预览





文档简介
(共24张PPT)
第二节 烯烃 炔烃
第二章 烃
考点二 乙炔的分子结构和制法
考点三 炔烃的命名及同分异构体书写
内容索引
考点四 炔烃的性质和用途
考点五 脂肪烃的来源及其应用
考点一 炔烃的概念和通式
分子里含有碳碳三键的一类脂肪烃
一、炔烃的概念和通式
1、概念:
2、炔烃的通式:
考点一 炔烃的概念和通式
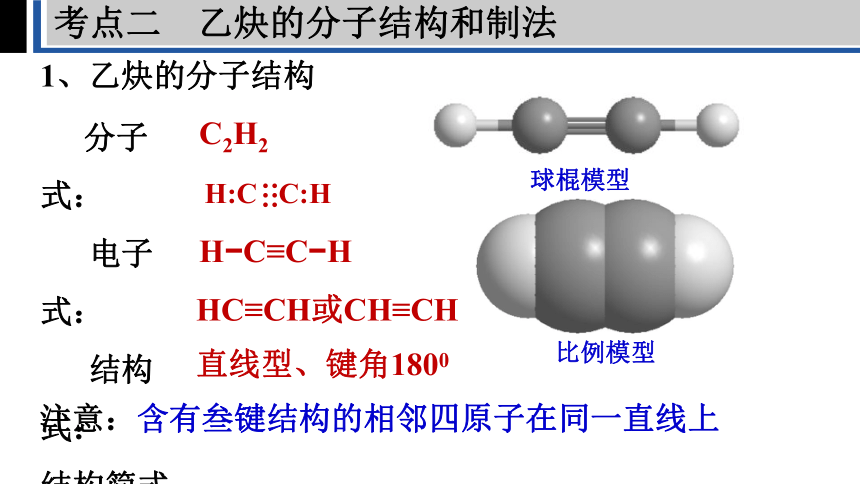
1、乙炔的分子结构
分子式:
电子式:
结构式:
结构简式:
空间结构:
C2H2
H:C C:H
:::
H C≡C H
HC≡CH或CH≡CH
直线型、键角1800
注意:含有叁键结构的相邻四原子在同一直线上
球棍模型
比例模型
考点二 乙炔的分子结构和制法
2、乙炔的制法
(2)乙炔的实验室制法
CaC2 + 2H2O → C2H2↑ + Ca(OH)2
②反应原理:
①原料:电石与H2O
(1)工业制法
—甲烷裂解法
2CH4 CH≡CH + 3H2
1500℃
考点二 乙炔的分子结构和制法
2、乙炔的制法
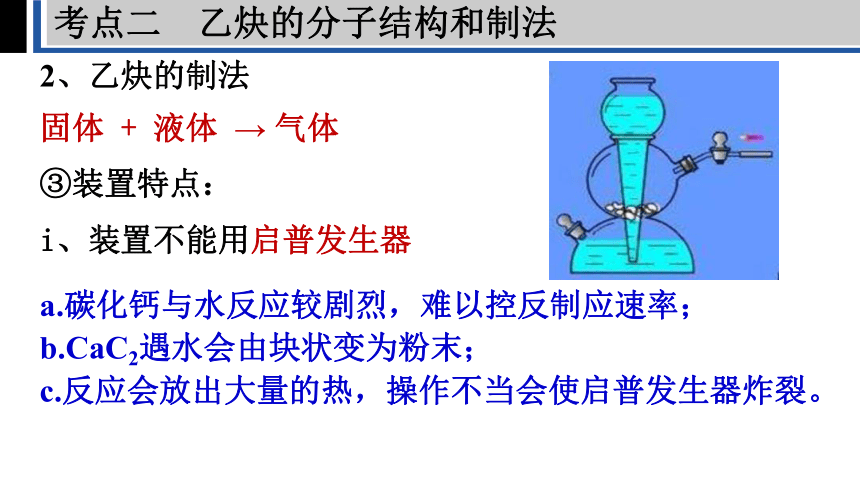
③装置特点:
固体 + 液体 → 气体
i、装置不能用启普发生器
a.碳化钙与水反应较剧烈,难以控反制应速率;
b.CaC2遇水会由块状变为粉末;
c.反应会放出大量的热,操作不当会使启普发生器炸裂。
考点二 乙炔的分子结构和制法
控制反应速率,得到平稳的乙炔气流
ii、实验中常用饱和食盐水代替水
2、乙炔的制法
③装置特点:
封住液面,防气体逸出,控制反应速率。
iii、实验中用分液漏斗
考点二 乙炔的分子结构和制法
④净化:
杂质——H2S、PH3等
通常将气体通过CuSO4 /NaOH溶液除去H2S和PH3
⑤收集:
排水集气法
2、乙炔的制法
考点二 乙炔的分子结构和制法
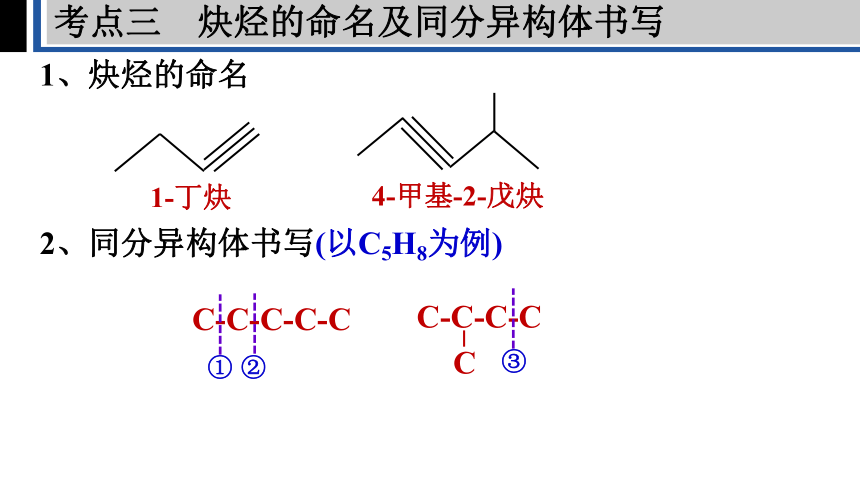
1、炔烃的命名
2、同分异构体书写(以C5H8为例)
1-丁炔
4-甲基-2-戊炔
C-C-C-C-C
C-C-C-C
C
①
②
③
考点三 炔烃的命名及同分异构体书写
1、物理性质:
(1)纯净的乙炔为无色无味的气体(由电石生成的乙炔因含有H2S等杂质而有特殊的臭味),微溶于水、易溶于有机溶剂;
(2)低级炔烃常温下为气态(包含C4),C5~C18为液态,C≥19为固态,相对密度随C原子数目的增多逐渐增大,但仍小于1;
(3)难溶于水,易溶于CCl4等有机溶剂。
考点四 炔烃的性质和用途
2、炔烃的化学性质:
(1)氧化反应
①可燃性
2C2H2+5O2 4CO2+2H2O(l)
点燃
实验现象:
火焰明亮并伴有浓烈黑烟
注意
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
考点四 炔烃的性质和用途
(1)氧化反应
②炔烃被KMnO4氧化
现象:酸性KMnO4溶液褪色,有气体逸出
2KMnO4+3H2SO4+C2H2→2MnSO4+K2SO4+2CO2↑+4H2O
反应机理:断三键、变羧基
[O]
2H-C-O-H
=
O
H-O-C-O-H
=
O
(H2O+CO2)
CH≡CH
[O]
考点四 炔烃的性质和用途
例、某炔烃经酸性高锰酸钾溶液氧化后得到以下两种有机物,试推断其结构。
CH3COOH
COOH
CH3C≡C CH(CH3)2
CH3COOH
HOOC
CH3CH2CH2C≡CCH2CH3
CH3CH2CH2COOH+CH3CH2COOH
①KMnO4
OH-、250C
②H+
考点四 炔烃的性质和用途
2、炔烃的化学性质:
(2)加成反应
①与H2加成
Pd、Pt或Ni
CH3CH≡CHCH3+2H2 CH3CH2CH2CH3
考点四 炔烃的性质和用途
碳碳键键能对比
类型 C C C=C C≡C
键能 (kJ/mol)
348
615
812
+267
+197
结论:炔烃比烯烃更易加氢。选用适当的催化剂、控制反应条件,可使炔烃的加成停留在烯烃。
2、炔烃的化学性质:
(2)加成反应
①与H2加成
CH≡C C=CH2CH2OH
CH3
Pd、Pt或Ni
CH3CH≡CHCH3+2H2 CH3CH2CH2CH3
H2
Pd-CaCO3
CH2=CH C=CH2CH2OH
CH3
考点四 炔烃的性质和用途
(2)加成反应
②与卤素加成
实验设计:
将C2H2气体通入Br2水中
实验现象:
溴水的棕黄色逐渐褪去
实验原理:
CH≡CH+Br2 CHBr=CHBr
1,2-二溴乙烯
1,1,2,2-四溴乙烷
CHBr=CHBr+Br2 CHBr2CHBr2
考点四 炔烃的性质和用途
(2)加成反应
③与HX加成
了解:炔烃加HX比烯烃困难,
不对称炔烃和HX加成,符号马氏规则;
如下光照或过氧化物存在下则按反马氏加成。
CH3 C≡CH
2HCl
FeCl3
CH3 CCl2 CH3
C4H9 C≡CH+HBr
光照或
过氧化物
C4H9 CH=CHBr
考点四 炔烃的性质和用途
练、某气态烃0.5mol能与1molHCl氯化氢完全加成,加成产物分子上的氢原子又可被6molCl2取代,则气态烃可能是( )
A. CH ≡CH B. CH2=CH2
C. CH≡C CH3 D. CH2=C(CH3)CH3
C
考点四 炔烃的性质和用途
(2)加成反应
③与H2O加成
CH≡CH+H2O
HgSO4/H2SO4
94 ~ 970C
H2C=CH
OH
乙烯醇一种极不稳定的结构
H2C=CH
OH
重排
O
H2C C H
H
考点四 炔烃的性质和用途
即:CH3CHO
(3)聚合反应:
低级炔烃在不同条件下可聚合成不同的聚合物。如:乙炔可以发生二聚、三聚和四聚,可聚成链状化合物,也可成环。
2CH≡CH
CuCl2,NH4Cl,HCl
84~960C
如:将乙炔通入到热的CuCl2和NH4Cl的HCl溶液中,可发生二聚或三聚。
CH≡CH
CH≡C CH=CH2
CH2=CH C≡C CH=CH2
考点四 炔烃的性质和用途
(3)聚合反应:
低级炔烃在特殊条件下,可聚合成苯及苯的同系物
3CH≡CH
一定条件
3CH3 C≡CH
一定条件
H3C
CH3
CH3
考点四 炔烃的性质和用途
(3)聚合反应:
nCH≡CH
一定条件
CH=CH
[ ]
n
聚乙炔(导电高分子材料)
3、乙炔的用途
(1)乙炔是一种重要的基本有机原料,
可以用来制备氯乙烯、聚氯乙烯和乙醛等。
(2)乙炔燃烧时产生的氧炔焰可用来切割或焊接金属
考点四 炔烃的性质和用途
考点五 脂肪烃的来源及其应用
液化石油气:丙烷、丁烷、丙烯、丁烯
炼制 方法 分馏 催化裂化 裂解 催化重整
原 理
主要 原料
主 要 产 品
用蒸发冷凝的方法把石油分成不同沸点范围的蒸馏产物
在催化剂存在的条件下,把相对分子质量大,沸点高的烃断裂为相对分子量小,沸点低的烃
高温下,把长链分子烃断裂为各种短链的气态烃或液态烃
在催化剂条件下,把碳链的结构重新排列成新分子结构
原油
重油
直链烷烃分馏产品
汽油馏分中的烃类分子
石油气、汽油、煤油、柴油和重油润滑油、凡士林、石蜡
提高汽油产量,短链烷烃和烯烃乙烷、丙烷、丁烯等
乙烯
丙烯
丁二烯
提高汽油的辛烷值和制取芳香烃
第二节 烯烃 炔烃
第二章 烃
考点二 乙炔的分子结构和制法
考点三 炔烃的命名及同分异构体书写
内容索引
考点四 炔烃的性质和用途
考点五 脂肪烃的来源及其应用
考点一 炔烃的概念和通式
分子里含有碳碳三键的一类脂肪烃
一、炔烃的概念和通式
1、概念:
2、炔烃的通式:
考点一 炔烃的概念和通式
1、乙炔的分子结构
分子式:
电子式:
结构式:
结构简式:
空间结构:
C2H2
H:C C:H
:::
H C≡C H
HC≡CH或CH≡CH
直线型、键角1800
注意:含有叁键结构的相邻四原子在同一直线上
球棍模型
比例模型
考点二 乙炔的分子结构和制法
2、乙炔的制法
(2)乙炔的实验室制法
CaC2 + 2H2O → C2H2↑ + Ca(OH)2
②反应原理:
①原料:电石与H2O
(1)工业制法
—甲烷裂解法
2CH4 CH≡CH + 3H2
1500℃
考点二 乙炔的分子结构和制法
2、乙炔的制法
③装置特点:
固体 + 液体 → 气体
i、装置不能用启普发生器
a.碳化钙与水反应较剧烈,难以控反制应速率;
b.CaC2遇水会由块状变为粉末;
c.反应会放出大量的热,操作不当会使启普发生器炸裂。
考点二 乙炔的分子结构和制法
控制反应速率,得到平稳的乙炔气流
ii、实验中常用饱和食盐水代替水
2、乙炔的制法
③装置特点:
封住液面,防气体逸出,控制反应速率。
iii、实验中用分液漏斗
考点二 乙炔的分子结构和制法
④净化:
杂质——H2S、PH3等
通常将气体通过CuSO4 /NaOH溶液除去H2S和PH3
⑤收集:
排水集气法
2、乙炔的制法
考点二 乙炔的分子结构和制法
1、炔烃的命名
2、同分异构体书写(以C5H8为例)
1-丁炔
4-甲基-2-戊炔
C-C-C-C-C
C-C-C-C
C
①
②
③
考点三 炔烃的命名及同分异构体书写
1、物理性质:
(1)纯净的乙炔为无色无味的气体(由电石生成的乙炔因含有H2S等杂质而有特殊的臭味),微溶于水、易溶于有机溶剂;
(2)低级炔烃常温下为气态(包含C4),C5~C18为液态,C≥19为固态,相对密度随C原子数目的增多逐渐增大,但仍小于1;
(3)难溶于水,易溶于CCl4等有机溶剂。
考点四 炔烃的性质和用途
2、炔烃的化学性质:
(1)氧化反应
①可燃性
2C2H2+5O2 4CO2+2H2O(l)
点燃
实验现象:
火焰明亮并伴有浓烈黑烟
注意
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
考点四 炔烃的性质和用途
(1)氧化反应
②炔烃被KMnO4氧化
现象:酸性KMnO4溶液褪色,有气体逸出
2KMnO4+3H2SO4+C2H2→2MnSO4+K2SO4+2CO2↑+4H2O
反应机理:断三键、变羧基
[O]
2H-C-O-H
=
O
H-O-C-O-H
=
O
(H2O+CO2)
CH≡CH
[O]
考点四 炔烃的性质和用途
例、某炔烃经酸性高锰酸钾溶液氧化后得到以下两种有机物,试推断其结构。
CH3COOH
COOH
CH3C≡C CH(CH3)2
CH3COOH
HOOC
CH3CH2CH2C≡CCH2CH3
CH3CH2CH2COOH+CH3CH2COOH
①KMnO4
OH-、250C
②H+
考点四 炔烃的性质和用途
2、炔烃的化学性质:
(2)加成反应
①与H2加成
Pd、Pt或Ni
CH3CH≡CHCH3+2H2 CH3CH2CH2CH3
考点四 炔烃的性质和用途
碳碳键键能对比
类型 C C C=C C≡C
键能 (kJ/mol)
348
615
812
+267
+197
结论:炔烃比烯烃更易加氢。选用适当的催化剂、控制反应条件,可使炔烃的加成停留在烯烃。
2、炔烃的化学性质:
(2)加成反应
①与H2加成
CH≡C C=CH2CH2OH
CH3
Pd、Pt或Ni
CH3CH≡CHCH3+2H2 CH3CH2CH2CH3
H2
Pd-CaCO3
CH2=CH C=CH2CH2OH
CH3
考点四 炔烃的性质和用途
(2)加成反应
②与卤素加成
实验设计:
将C2H2气体通入Br2水中
实验现象:
溴水的棕黄色逐渐褪去
实验原理:
CH≡CH+Br2 CHBr=CHBr
1,2-二溴乙烯
1,1,2,2-四溴乙烷
CHBr=CHBr+Br2 CHBr2CHBr2
考点四 炔烃的性质和用途
(2)加成反应
③与HX加成
了解:炔烃加HX比烯烃困难,
不对称炔烃和HX加成,符号马氏规则;
如下光照或过氧化物存在下则按反马氏加成。
CH3 C≡CH
2HCl
FeCl3
CH3 CCl2 CH3
C4H9 C≡CH+HBr
光照或
过氧化物
C4H9 CH=CHBr
考点四 炔烃的性质和用途
练、某气态烃0.5mol能与1molHCl氯化氢完全加成,加成产物分子上的氢原子又可被6molCl2取代,则气态烃可能是( )
A. CH ≡CH B. CH2=CH2
C. CH≡C CH3 D. CH2=C(CH3)CH3
C
考点四 炔烃的性质和用途
(2)加成反应
③与H2O加成
CH≡CH+H2O
HgSO4/H2SO4
94 ~ 970C
H2C=CH
OH
乙烯醇一种极不稳定的结构
H2C=CH
OH
重排
O
H2C C H
H
考点四 炔烃的性质和用途
即:CH3CHO
(3)聚合反应:
低级炔烃在不同条件下可聚合成不同的聚合物。如:乙炔可以发生二聚、三聚和四聚,可聚成链状化合物,也可成环。
2CH≡CH
CuCl2,NH4Cl,HCl
84~960C
如:将乙炔通入到热的CuCl2和NH4Cl的HCl溶液中,可发生二聚或三聚。
CH≡CH
CH≡C CH=CH2
CH2=CH C≡C CH=CH2
考点四 炔烃的性质和用途
(3)聚合反应:
低级炔烃在特殊条件下,可聚合成苯及苯的同系物
3CH≡CH
一定条件
3CH3 C≡CH
一定条件
H3C
CH3
CH3
考点四 炔烃的性质和用途
(3)聚合反应:
nCH≡CH
一定条件
CH=CH
[ ]
n
聚乙炔(导电高分子材料)
3、乙炔的用途
(1)乙炔是一种重要的基本有机原料,
可以用来制备氯乙烯、聚氯乙烯和乙醛等。
(2)乙炔燃烧时产生的氧炔焰可用来切割或焊接金属
考点四 炔烃的性质和用途
考点五 脂肪烃的来源及其应用
液化石油气:丙烷、丁烷、丙烯、丁烯
炼制 方法 分馏 催化裂化 裂解 催化重整
原 理
主要 原料
主 要 产 品
用蒸发冷凝的方法把石油分成不同沸点范围的蒸馏产物
在催化剂存在的条件下,把相对分子质量大,沸点高的烃断裂为相对分子量小,沸点低的烃
高温下,把长链分子烃断裂为各种短链的气态烃或液态烃
在催化剂条件下,把碳链的结构重新排列成新分子结构
原油
重油
直链烷烃分馏产品
汽油馏分中的烃类分子
石油气、汽油、煤油、柴油和重油润滑油、凡士林、石蜡
提高汽油产量,短链烷烃和烯烃乙烷、丙烷、丁烯等
乙烯
丙烯
丁二烯
提高汽油的辛烷值和制取芳香烃
