化学人教版(2019)选择性必修3 2.2.1 烯烃 考点课件(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.1 烯烃 考点课件(共41张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 859.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-11 11:17:02 | ||
图片预览










文档简介
(共41张PPT)
第二节 烯烃 炔烃
第二章 烃
考点二 乙烯的性质
考点四 烯烃的命名、同分异构体书写
考点三 乙烯的用途和制法
内容索引
考点一 乙烯的组成和结构
考点五 烯烃的性质
考点六 烯烃的的来源与制法
1、乙烯的分子式
已知:乙烯中仅含C、H两种元素,通过实验测得乙烯中
碳元素的质量分数为85.7%,且标况下密度为1.25g/L。
求乙烯的分子式。
分析:取1mol气体为研究对象
m=ρV =1.25g/L×22.4L/mol=28g
mc=28g×85.7%=24g Nc=24g/12g=2个
mH=28g-24g=4g NH=4g/1g=4个
故乙烯的分子式为:C2H4
考点一 乙烯的组成和结构
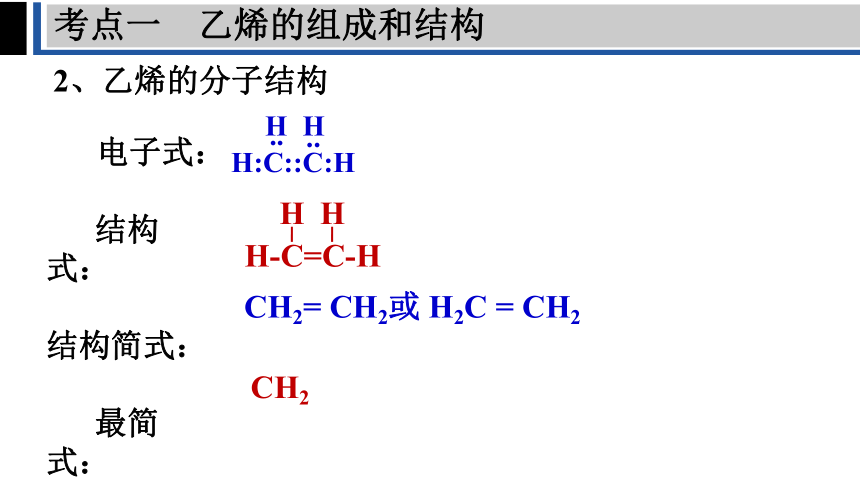
2、乙烯的分子结构
电子式:
结构式:
结构简式:
最简式:
H
H
..
..
H:C::C:H
H
H
H-C=C-H
CH2= CH2或 H2C = CH2
CH2
考点一 乙烯的组成和结构
3、乙烯的空间结构
6个原子共平面,任何键之间的键角均为1200 ,平面型分子。
考点一 乙烯的组成和结构
1、乙烯的物理性质:
无色、稍有气味,密度为1.25g/L,比空气略轻,难溶于水。
考点二 乙烯的性质
2、乙烯的化学性质(官能团:碳碳双键)
(1)加成反应
原因:乙烯分子中碳碳双键里的一个键容易断裂。
加成反应:有机物中双键或叁键中的一个键断裂,两端的碳原子与其它原子或原子团结合生成新的有机物的反应。
实验设计:
实验现象:
实验本质:
将乙烯气体通入溴水中
溴水(棕黄色)褪色(无色)
CH2=CH2+Br2→CH2BrCH2Br(无色液体)
考点二 乙烯的性质
(1)加成反应
应用:鉴别或除去乙烯
2、乙烯的化学性质
练:A. 溴水(棕黄色) B. 溴的四氯化碳溶液(橙红色)
(1)鉴别甲烷和乙烯________
(2)除去甲烷中的乙烯杂质_____
(3)除去CO中的乙烯杂质_______
A、B
A
CCl4会吸收CH4
A、B
CO不溶于CCl4和H4O
考点二 乙烯的性质
CH2=CH2+Br2→CH2BrCH2Br(无色液体)
应用:鉴别或除去乙烯
2、乙烯的化学性质
(1)加成反应(乙烯还能与Cl2、H2 、HX(X=Cl、Br)、H2O、HCN等发生加成反应,I2不能与乙烯加成。)
CH2=CH2+Cl2 → CH2ClCH2Cl
CH2=CH2+H2 CH3CH3
催化剂
CH2=CH2+HCl CH3CH2Cl
催化剂
CH2=CH2+H2O CH3CH2OH
催化剂
CH2=CH2+HCN CH3CH2CN
催化剂
(制备一氯乙烷)
乙烯水化法制乙醇
(丙腈)
H C N氰化氢
考点二 乙烯的性质
2、乙烯的化学性质
(2)氧化反应
a、可燃性(被O2彻底氧化)
C2H4+O2 2CO2+2H2O
点燃
实验现象:
原因分析:
火焰明亮,少量黑烟,放出热量
是因含碳量高,燃烧不充分(析出C的小颗粒),火焰明亮是碳颗粒受灼烧而发光。
考点二 乙烯的性质
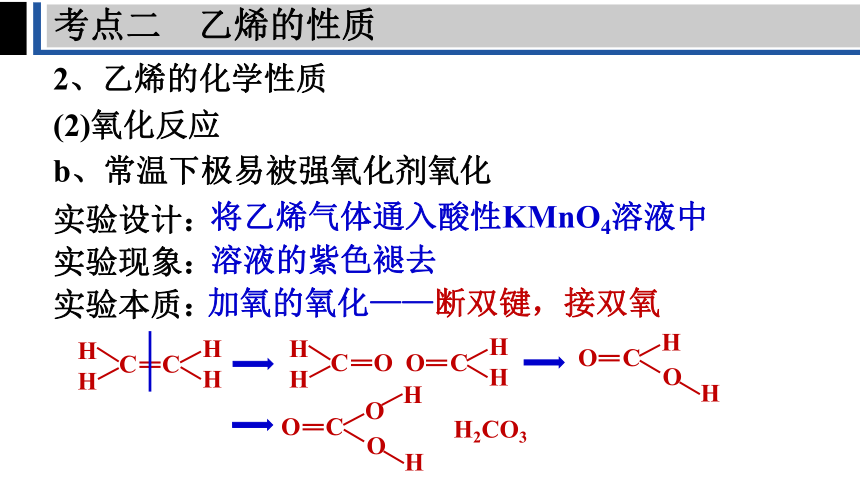
2、乙烯的化学性质
(2)氧化反应
b、常温下极易被强氧化剂氧化
实验设计:
实验现象:
实验本质:
将乙烯气体通入酸性KMnO4溶液中
溶液的紫色褪去
加氧的氧化——断双键,接双氧
C C
H
H
H
H
C O
H
H
O C
H
H
O C
H
H
O
O C
H
H
O
O
H2CO3
考点二 乙烯的性质
5CH2=CH2+12KMnO4+18H2SO4→
12MnSO4+6K2SO4+10CO2↑+28H2O
应用:鉴别乙烯 (不能用于除杂)
考点二 乙烯的性质
2、乙烯的化学性质
(2)氧化反应
b、常温下极易被强氧化剂氧化
2CH2=CH2+O2 2CH3CHO
催化剂
加热、加压
2CH2=CH2+O2 2
Ag
250oC
H2C CH2
O
环氧乙烷
考点二 乙烯的性质
2、乙烯的化学性质
(2)氧化反应
c、催化氧化(与O2)
2、乙烯的化学性质
(3)加聚反应(加成聚合反应,简称加聚反应)
nCH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯)
单体:
链节:
聚合度:
CH2=CH2
—CH2—CH2—
n
混合物
考点二 乙烯的性质
1、乙烯的用途
(1)植物生长调节剂
(2)有机化工原料
衡量一个国家石油化工产业发展水平—乙烯的产量
2、乙烯的制法
(1)工业制法:主要是从石油炼制厂和石油化工厂所产生的气体中分离出来的。
考点三 乙烯的用途和制法
(2)实验室制法
实验原理:
CH3CH2OH CH2=CH2↑+H2O
浓硫酸
170oC
CH2CH2
OH
H
消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等)而生成含不饱和键的化合物的反应。
β α
考点二 乙烯的性质
分子里含有碳碳双键的一类链状烃;
仅含有一个碳碳双键的链烃称为单烯烃;
含有两个碳碳双键的链烃称为二烯烃,以此类推
1、烯烃的概念
2、烯烃的通式
CnH2n (n≥2)
思考:通式为CnH2n的烃一定是烯烃?
考点四 烯烃的命名、同分异构体书写
3、烯烃的命名
(1) CH3CH=CHC(CH3)3
C2H5
(2) CH2=CCH2C=CH2
CH3
4,4-二甲基-2-戊烯
2-甲基-4-乙基-1,4-戊二烯
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
官能团异构:
碳链异构:
位置异构:
顺反异构:
环烷烃和(单)烯烃
考点四 烯烃的命名、同分异构体书写
官能团异构:环烷烃
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
碳链异构:
位置异构:
顺反异构:
(单)烯烃
C
C
C
C
C
C
C
C
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
(单)烯烃
C
C
C
C
C
C
C
C
① ①
C
C
C
C
②
C
C
C
C
C
C
C
C
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
碳链异构:
位置异构:
顺反异构:
顺反异构:补全氢
CH3
CH
CH3
CH
CH2
C
CH3
CH3
CH2
CH
CH3
CH2
C
C
C
C
C
C
C
C
C
C
C
C
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
顺反异构:考虑立体结构
CH3 CH=CH CH3
CH2
C
CH3
CH3
CH2
CH
CH3
CH2
C=
C
CH3
CH2
H
H
H
C=
C
CH3
CH3
H
H
C=
C
CH3
H
CH3
H
C=
C
CH3
H
CH3
H
考点四 烯烃的命名、同分异构体书写
(1)状态:
1、烯烃的物理性质
2~4个碳原子的烯烃为气相,5~18个碳原子的烯烃为液相,18个碳原子以上的烯烃为固相。
(2)熔沸点:
(3)密度:
(4)溶解性:
随C数目的增加,熔沸点升高
①直链烯烃的沸点高于带支链的异构体;
②顺式异构体的沸点一般高于反式异构体。
随C数目的增加而增大;但相对密度都小于1
几乎不溶于水;但可溶于有机溶剂
考点五 烯烃的性质
(1)氧化反应
2、烯烃的化学性质
①可燃性:
CnH2n+ O2 n CO2+n H2O
点燃
3n
2
②能使酸性KMnO4/KCr2O7溶液褪色
考点五 烯烃的性质
(2)加成反应
2、烯烃的化学性质
①与卤素单质加成:
烯烃易与氯、溴发生加成反应,碘一般不与烯烃反应,氟与烯烃反应太剧烈,往往得到碳链断裂的各种产物。
练.1mol的某烯烃能与1molCl2发生加成反应,生成氯代烃,1mol该氯代烃能与4molCl2发生完全取代反应,该烃的结构简式为__________。
CH2= CH2
考点五 烯烃的性质
(2)加成反应
2、烯烃的化学性质
②与H2加成
(用Ni、Pt、Pb作催化剂并加热)
练. 相对分子质量为70的烯烃,分子式为_______,
若该烯烃与足量H2加成后生成含3个甲基的烷烃,
则该烯烃可能的结构简式___________________。
C5H10
分析: 有3个甲基,说明该烷烃只有一个支链
C C
C C
C
①
②
③
C C
C C
C
C C
C C
C
C C
C C
C
考点五 烯烃的性质
(2)加成反应
2、烯烃的化学性质
②与H2加成
练.某单烯烃与足量H2加成后
产物如图所示,则该烯烃可能有_____种。
CH3 CH CH C(CH3)3
CH3
CH3
CH3 CH CH C CH3
CH3
CH3
CH3
CH3
①
②
③
3
考点五 烯烃的性质
(2)加成反应
③与HX、H2O、HCN加成
(条件:催化剂、加热)
练. 写出丙烯与HCl发生加成反应的化学方程式
CH3CH=CH2+HCl
催化剂
CH3CH CH2
H Cl
CH3CH CH2
Cl H
马氏规则:不对称烯烃与HX加成时,氢原子将加到烯烃双键含氢较多的碳原子上。
(主要产物)
(副产物)
考点五 烯烃的性质
(2)加成反应
③与HX、H2O、HCN加成
CH3CH=CH2+HBr
过氧化物
日光
CH3CH CH2
H Br
CH3CH CH2
Br H
(副产物)
(主要产物)
考点五 烯烃的性质
反马氏规则:在光和过氧化物作用下,不对称烯烃与HX发生加成反应的取向与马氏规则不一致时,叫烯烃加成的过氧化物效应,也称反马氏效应。
(3)双烯加成
二烯烃:含有两个碳碳双键的链烃
(通式:CnH2n-2)
分类:
C=C=C-C
C=C-C=C
C=C-C-C=C
累积二烯烃
共轭二烯烃
孤立二烯烃
不稳定
共轭二烯烃: 分子内原子间相互影响叫做共轭效应
特点: 原子共平面、键长平均化、体系能量低稳定
特殊性质: 1、2-加成和1、4-加成
考点五 烯烃的性质
(3)双烯加成:
1、2-加成和1、4-加成
CH2=CH CH=CH2+Br2→
CH2 CH CH=CH2
Br
Br
CH2 CH=CH CH2
Br
Br
1、2-加成
1、4-加成
CH2=CH CH=CH2+2Br2→
CH2 CH CH CH2
Br
Br
Br
Br
考点五 烯烃的性质
(4)D-A反应[狄尔斯-阿尔德(Diels-Alder)反应]
=CH2
=CH2
HC
HC
+
CH2
CH2
=
150~200oC
高压
1
2
3
5
4
6
+
150~200oC
高压
1
2
3
5
4
6
考点五 烯烃的性质
练.完成下列方程式的书写
+
加热
高压
=CH2
=CH2
HC
HC
+
HC
HC
=
C
C
O
=
=
O
O
加热
高压
C
C
O
=
=
O
O
考点五 烯烃的性质
(5)加聚反应
nCH2=C-CH=CH2
CH3
CH2 C
CH3
CH=CH2
[ ]
n
CH CH2
CH3
C=CH2
[ ]
n
[ ]
n
CH2 C=CH CH2
CH3
2-甲基-1,3-丁二烯
天然橡胶
考点五 烯烃的性质
(5)加聚反应(工业上常用苯乙烯、1,3-丁二烯和
丙烯腈来合成ABS塑料)
CH=CH2
CH2=CH CH=CH2
+
+
CH=CH2
CN
CH CH2
CH2 CH=CH CH2
CH CH2
CN
[ ]
n
考点五 烯烃的性质
CH CH2
CH2 CH=CH CH2
CH CH2
CN
[ ]
n
练.请写出下列高聚物单体
方法:去掉两边,中间主链双变单、单变双;三个相邻双键去掉中间双键。
考点五 烯烃的性质
(6)α-取代反应:
α碳原子(直接与双键相连的碳原子)上的氢原子(α氢原子)容易发生取代反应。
CH3 CH=CH2+Cl2
α
光照
CCl4溶液
室温
500~600oC
CH2 CH=CH2
Cl
CH3 CH CH2
Cl
Cl
CH2 CH=CH2
Cl
考点五 烯烃的性质
1、工业制法:
石油裂解
2、实验室制法:
①醇脱水
②卤代烷脱HX
(条件:浓硫酸、加热)
(条件:强碱的醇溶液、加热)
CH3-CH-CH2CH2CH3
OH
浓硫酸、
-H2O
CH2=CH-CH2CH2CH3
CH3-CH=CHCH2CH3
或
考点六 烯烃的的来源与制法
CH3 CH CH2CH2CH3
Br
C2H5OH
+KOH
CH2=CH CH2CH2CH3
CH3 CH=CHCH2CH3
+ KBr + H2O
考点六 烯烃的的来源与制法
①醇脱水
②卤代烷脱HX
(条件:浓硫酸、加热)
(条件:强碱的醇溶液、加热)
CH3-CH-CH2CH2CH3
OH
浓硫酸、
-H2O
CH2=CH-CH2CH2CH3
CH3-CH=CHCH2CH3
或
第二节 烯烃 炔烃
第二章 烃
考点二 乙烯的性质
考点四 烯烃的命名、同分异构体书写
考点三 乙烯的用途和制法
内容索引
考点一 乙烯的组成和结构
考点五 烯烃的性质
考点六 烯烃的的来源与制法
1、乙烯的分子式
已知:乙烯中仅含C、H两种元素,通过实验测得乙烯中
碳元素的质量分数为85.7%,且标况下密度为1.25g/L。
求乙烯的分子式。
分析:取1mol气体为研究对象
m=ρV =1.25g/L×22.4L/mol=28g
mc=28g×85.7%=24g Nc=24g/12g=2个
mH=28g-24g=4g NH=4g/1g=4个
故乙烯的分子式为:C2H4
考点一 乙烯的组成和结构
2、乙烯的分子结构
电子式:
结构式:
结构简式:
最简式:
H
H
..
..
H:C::C:H
H
H
H-C=C-H
CH2= CH2或 H2C = CH2
CH2
考点一 乙烯的组成和结构
3、乙烯的空间结构
6个原子共平面,任何键之间的键角均为1200 ,平面型分子。
考点一 乙烯的组成和结构
1、乙烯的物理性质:
无色、稍有气味,密度为1.25g/L,比空气略轻,难溶于水。
考点二 乙烯的性质
2、乙烯的化学性质(官能团:碳碳双键)
(1)加成反应
原因:乙烯分子中碳碳双键里的一个键容易断裂。
加成反应:有机物中双键或叁键中的一个键断裂,两端的碳原子与其它原子或原子团结合生成新的有机物的反应。
实验设计:
实验现象:
实验本质:
将乙烯气体通入溴水中
溴水(棕黄色)褪色(无色)
CH2=CH2+Br2→CH2BrCH2Br(无色液体)
考点二 乙烯的性质
(1)加成反应
应用:鉴别或除去乙烯
2、乙烯的化学性质
练:A. 溴水(棕黄色) B. 溴的四氯化碳溶液(橙红色)
(1)鉴别甲烷和乙烯________
(2)除去甲烷中的乙烯杂质_____
(3)除去CO中的乙烯杂质_______
A、B
A
CCl4会吸收CH4
A、B
CO不溶于CCl4和H4O
考点二 乙烯的性质
CH2=CH2+Br2→CH2BrCH2Br(无色液体)
应用:鉴别或除去乙烯
2、乙烯的化学性质
(1)加成反应(乙烯还能与Cl2、H2 、HX(X=Cl、Br)、H2O、HCN等发生加成反应,I2不能与乙烯加成。)
CH2=CH2+Cl2 → CH2ClCH2Cl
CH2=CH2+H2 CH3CH3
催化剂
CH2=CH2+HCl CH3CH2Cl
催化剂
CH2=CH2+H2O CH3CH2OH
催化剂
CH2=CH2+HCN CH3CH2CN
催化剂
(制备一氯乙烷)
乙烯水化法制乙醇
(丙腈)
H C N氰化氢
考点二 乙烯的性质
2、乙烯的化学性质
(2)氧化反应
a、可燃性(被O2彻底氧化)
C2H4+O2 2CO2+2H2O
点燃
实验现象:
原因分析:
火焰明亮,少量黑烟,放出热量
是因含碳量高,燃烧不充分(析出C的小颗粒),火焰明亮是碳颗粒受灼烧而发光。
考点二 乙烯的性质
2、乙烯的化学性质
(2)氧化反应
b、常温下极易被强氧化剂氧化
实验设计:
实验现象:
实验本质:
将乙烯气体通入酸性KMnO4溶液中
溶液的紫色褪去
加氧的氧化——断双键,接双氧
C C
H
H
H
H
C O
H
H
O C
H
H
O C
H
H
O
O C
H
H
O
O
H2CO3
考点二 乙烯的性质
5CH2=CH2+12KMnO4+18H2SO4→
12MnSO4+6K2SO4+10CO2↑+28H2O
应用:鉴别乙烯 (不能用于除杂)
考点二 乙烯的性质
2、乙烯的化学性质
(2)氧化反应
b、常温下极易被强氧化剂氧化
2CH2=CH2+O2 2CH3CHO
催化剂
加热、加压
2CH2=CH2+O2 2
Ag
250oC
H2C CH2
O
环氧乙烷
考点二 乙烯的性质
2、乙烯的化学性质
(2)氧化反应
c、催化氧化(与O2)
2、乙烯的化学性质
(3)加聚反应(加成聚合反应,简称加聚反应)
nCH2=CH2
[ CH2—CH2 ]n
催化剂
(聚乙烯)
单体:
链节:
聚合度:
CH2=CH2
—CH2—CH2—
n
混合物
考点二 乙烯的性质
1、乙烯的用途
(1)植物生长调节剂
(2)有机化工原料
衡量一个国家石油化工产业发展水平—乙烯的产量
2、乙烯的制法
(1)工业制法:主要是从石油炼制厂和石油化工厂所产生的气体中分离出来的。
考点三 乙烯的用途和制法
(2)实验室制法
实验原理:
CH3CH2OH CH2=CH2↑+H2O
浓硫酸
170oC
CH2CH2
OH
H
消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等)而生成含不饱和键的化合物的反应。
β α
考点二 乙烯的性质
分子里含有碳碳双键的一类链状烃;
仅含有一个碳碳双键的链烃称为单烯烃;
含有两个碳碳双键的链烃称为二烯烃,以此类推
1、烯烃的概念
2、烯烃的通式
CnH2n (n≥2)
思考:通式为CnH2n的烃一定是烯烃?
考点四 烯烃的命名、同分异构体书写
3、烯烃的命名
(1) CH3CH=CHC(CH3)3
C2H5
(2) CH2=CCH2C=CH2
CH3
4,4-二甲基-2-戊烯
2-甲基-4-乙基-1,4-戊二烯
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
官能团异构:
碳链异构:
位置异构:
顺反异构:
环烷烃和(单)烯烃
考点四 烯烃的命名、同分异构体书写
官能团异构:环烷烃
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
碳链异构:
位置异构:
顺反异构:
(单)烯烃
C
C
C
C
C
C
C
C
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
(单)烯烃
C
C
C
C
C
C
C
C
① ①
C
C
C
C
②
C
C
C
C
C
C
C
C
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
碳链异构:
位置异构:
顺反异构:
顺反异构:补全氢
CH3
CH
CH3
CH
CH2
C
CH3
CH3
CH2
CH
CH3
CH2
C
C
C
C
C
C
C
C
C
C
C
C
考点四 烯烃的命名、同分异构体书写
4、烯烃的同分异构体书写
例:写出符合分子式为C4H8的有机物的结构简式
顺反异构:考虑立体结构
CH3 CH=CH CH3
CH2
C
CH3
CH3
CH2
CH
CH3
CH2
C=
C
CH3
CH2
H
H
H
C=
C
CH3
CH3
H
H
C=
C
CH3
H
CH3
H
C=
C
CH3
H
CH3
H
考点四 烯烃的命名、同分异构体书写
(1)状态:
1、烯烃的物理性质
2~4个碳原子的烯烃为气相,5~18个碳原子的烯烃为液相,18个碳原子以上的烯烃为固相。
(2)熔沸点:
(3)密度:
(4)溶解性:
随C数目的增加,熔沸点升高
①直链烯烃的沸点高于带支链的异构体;
②顺式异构体的沸点一般高于反式异构体。
随C数目的增加而增大;但相对密度都小于1
几乎不溶于水;但可溶于有机溶剂
考点五 烯烃的性质
(1)氧化反应
2、烯烃的化学性质
①可燃性:
CnH2n+ O2 n CO2+n H2O
点燃
3n
2
②能使酸性KMnO4/KCr2O7溶液褪色
考点五 烯烃的性质
(2)加成反应
2、烯烃的化学性质
①与卤素单质加成:
烯烃易与氯、溴发生加成反应,碘一般不与烯烃反应,氟与烯烃反应太剧烈,往往得到碳链断裂的各种产物。
练.1mol的某烯烃能与1molCl2发生加成反应,生成氯代烃,1mol该氯代烃能与4molCl2发生完全取代反应,该烃的结构简式为__________。
CH2= CH2
考点五 烯烃的性质
(2)加成反应
2、烯烃的化学性质
②与H2加成
(用Ni、Pt、Pb作催化剂并加热)
练. 相对分子质量为70的烯烃,分子式为_______,
若该烯烃与足量H2加成后生成含3个甲基的烷烃,
则该烯烃可能的结构简式___________________。
C5H10
分析: 有3个甲基,说明该烷烃只有一个支链
C C
C C
C
①
②
③
C C
C C
C
C C
C C
C
C C
C C
C
考点五 烯烃的性质
(2)加成反应
2、烯烃的化学性质
②与H2加成
练.某单烯烃与足量H2加成后
产物如图所示,则该烯烃可能有_____种。
CH3 CH CH C(CH3)3
CH3
CH3
CH3 CH CH C CH3
CH3
CH3
CH3
CH3
①
②
③
3
考点五 烯烃的性质
(2)加成反应
③与HX、H2O、HCN加成
(条件:催化剂、加热)
练. 写出丙烯与HCl发生加成反应的化学方程式
CH3CH=CH2+HCl
催化剂
CH3CH CH2
H Cl
CH3CH CH2
Cl H
马氏规则:不对称烯烃与HX加成时,氢原子将加到烯烃双键含氢较多的碳原子上。
(主要产物)
(副产物)
考点五 烯烃的性质
(2)加成反应
③与HX、H2O、HCN加成
CH3CH=CH2+HBr
过氧化物
日光
CH3CH CH2
H Br
CH3CH CH2
Br H
(副产物)
(主要产物)
考点五 烯烃的性质
反马氏规则:在光和过氧化物作用下,不对称烯烃与HX发生加成反应的取向与马氏规则不一致时,叫烯烃加成的过氧化物效应,也称反马氏效应。
(3)双烯加成
二烯烃:含有两个碳碳双键的链烃
(通式:CnH2n-2)
分类:
C=C=C-C
C=C-C=C
C=C-C-C=C
累积二烯烃
共轭二烯烃
孤立二烯烃
不稳定
共轭二烯烃: 分子内原子间相互影响叫做共轭效应
特点: 原子共平面、键长平均化、体系能量低稳定
特殊性质: 1、2-加成和1、4-加成
考点五 烯烃的性质
(3)双烯加成:
1、2-加成和1、4-加成
CH2=CH CH=CH2+Br2→
CH2 CH CH=CH2
Br
Br
CH2 CH=CH CH2
Br
Br
1、2-加成
1、4-加成
CH2=CH CH=CH2+2Br2→
CH2 CH CH CH2
Br
Br
Br
Br
考点五 烯烃的性质
(4)D-A反应[狄尔斯-阿尔德(Diels-Alder)反应]
=CH2
=CH2
HC
HC
+
CH2
CH2
=
150~200oC
高压
1
2
3
5
4
6
+
150~200oC
高压
1
2
3
5
4
6
考点五 烯烃的性质
练.完成下列方程式的书写
+
加热
高压
=CH2
=CH2
HC
HC
+
HC
HC
=
C
C
O
=
=
O
O
加热
高压
C
C
O
=
=
O
O
考点五 烯烃的性质
(5)加聚反应
nCH2=C-CH=CH2
CH3
CH2 C
CH3
CH=CH2
[ ]
n
CH CH2
CH3
C=CH2
[ ]
n
[ ]
n
CH2 C=CH CH2
CH3
2-甲基-1,3-丁二烯
天然橡胶
考点五 烯烃的性质
(5)加聚反应(工业上常用苯乙烯、1,3-丁二烯和
丙烯腈来合成ABS塑料)
CH=CH2
CH2=CH CH=CH2
+
+
CH=CH2
CN
CH CH2
CH2 CH=CH CH2
CH CH2
CN
[ ]
n
考点五 烯烃的性质
CH CH2
CH2 CH=CH CH2
CH CH2
CN
[ ]
n
练.请写出下列高聚物单体
方法:去掉两边,中间主链双变单、单变双;三个相邻双键去掉中间双键。
考点五 烯烃的性质
(6)α-取代反应:
α碳原子(直接与双键相连的碳原子)上的氢原子(α氢原子)容易发生取代反应。
CH3 CH=CH2+Cl2
α
光照
CCl4溶液
室温
500~600oC
CH2 CH=CH2
Cl
CH3 CH CH2
Cl
Cl
CH2 CH=CH2
Cl
考点五 烯烃的性质
1、工业制法:
石油裂解
2、实验室制法:
①醇脱水
②卤代烷脱HX
(条件:浓硫酸、加热)
(条件:强碱的醇溶液、加热)
CH3-CH-CH2CH2CH3
OH
浓硫酸、
-H2O
CH2=CH-CH2CH2CH3
CH3-CH=CHCH2CH3
或
考点六 烯烃的的来源与制法
CH3 CH CH2CH2CH3
Br
C2H5OH
+KOH
CH2=CH CH2CH2CH3
CH3 CH=CHCH2CH3
+ KBr + H2O
考点六 烯烃的的来源与制法
①醇脱水
②卤代烷脱HX
(条件:浓硫酸、加热)
(条件:强碱的醇溶液、加热)
CH3-CH-CH2CH2CH3
OH
浓硫酸、
-H2O
CH2=CH-CH2CH2CH3
CH3-CH=CHCH2CH3
或
