专题8《金属和金属材料》章末复习 九年级化学仁爱版下册(有答案)
文档属性
| 名称 | 专题8《金属和金属材料》章末复习 九年级化学仁爱版下册(有答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 153.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-11 00:00:00 | ||
图片预览



文档简介
专题8《金属和金属材料》章末复习
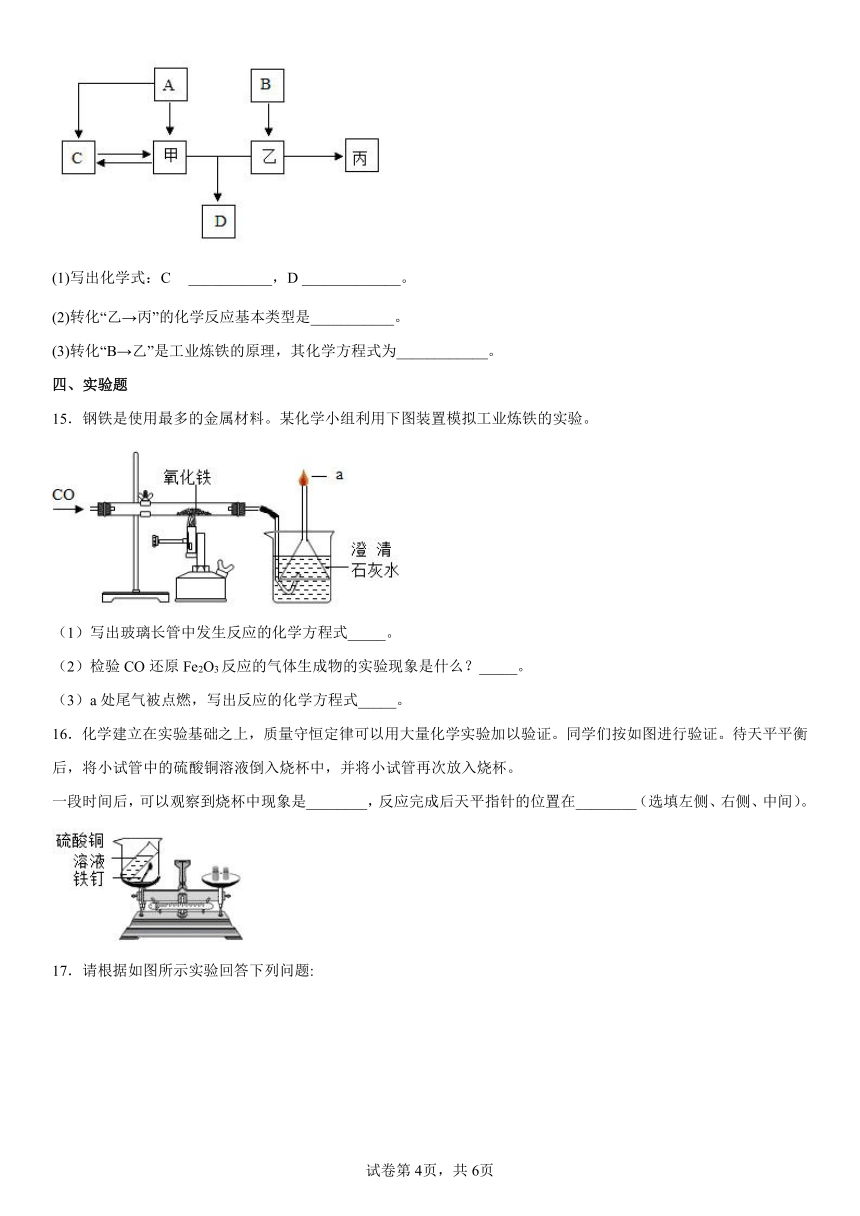
一、单选题
1.下列有关实验现象的描述正确的是
A.铜片投入稀盐酸中产生大量无色气泡
B.铁丝在空气中燃烧,火星四射,生成红棕色固休
C.高温下木炭还原氧化铜,黑色固体变红
D.镁条在空气中燃烧,发出耀眼的白光,冒黑烟
2.下列关于合金的叙述中,正确的是
A.金属形成合金之后失去金属光泽
B.只有金属和金属之间才能形成合金
C.铁合金比纯铁的应用范围更广
D.合金不能传热、导电
3.金属材料在生产、生活中使用很广泛。下列用途是利用了金属的导电性的是
A.铁制铁锅 B.金制项链 C.铜制导线 D.铝制易拉罐
4.下列实验能达到实验目的的是
A.氧气验满 B.探究甲烷的组成
C.验证质量守恒定律 D.比较合金与纯金属硬度
5.下列不能与氯化亚铁溶液反应的金属是
A.Cu B.Zn C.Al D.Mg
6.如图所示是某化学小组设计的铁制品锈蚀的实验装置。下列相关叙述中正确的是
①铁锈的主要成分是Fe2O3②一段时间后,塑料瓶可能会变瘪 ③一段时间后,水面处铁丝锈蚀最严重 ④一段时间后,铁丝会由下向上出现锈蚀现象
A.②③④ B.①②④ C.①②③ D.①③④
7.已知金属 M Fe 和 H 活动性强弱关系 Fe > M > H,下列说法正确的是
A.金属 M 放入 Zn(NO3 )2 溶液中,有锌析出
B.金属 M 放入 CuSO4 溶液中,金属表面有红色固体析出
C.金属铁(足量)放入 M(NO3 )2 中,生成 Fe(NO3 )3
D.金属铁放入 AgNO3 溶液中,一段时间后,溶液质量变大
8.已调平的托盘天平(高灵敏度)两边各放一个等质量的烧杯,向烧杯中倒入质量相等、质量分数也相等的足量的稀硫酸,然后在左边的烧杯中放入一定质量的铁粉,同时在右边的烧杯中放入等质量的锌粉,在反应过程中天平指针的偏转情况为
A.先左后右 B.先右后左 C.向右偏转 D.向左偏转
二、简答题
9.(1)飞机上的镀铬铁制品能防锈蚀,其防锈蚀原理是阻止铁与________接触。
(2)设计对比实验是化学研究常用的方法,下图是某化学小组设计的探究铁钉锈蚀条件的实验。要达到实验目的还需补充什么实验 __________
10.近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。请回答下列问题。
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料是______(填序号)。
A.玻璃车窗 B.镁铝合金车体 C.塑料小桌板
(2)高铁电路多用铜质导线,这是利用了铜的延展性和______性。
(3)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧化碳在高温条件下反应,其化学方程式为______。
(4)车身表面烤漆不仅美观,还能起到防锈的作用,其防锈的原理是______。
(5)目前世界上已有50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是______(写出一条即可)。
11.向盛有一定质量和的混合溶液中的烧杯中逐渐加入粉,边加边搅拌,溶液质量与加入粉的质量关系如图所示。
(1)写出(不包括b点)段反应的化学方程式__________。
(2)b点的溶液中含有的金属离子有哪些(写离子符号)__________?
(3)d点的固体中含有哪几种物质__________?
三、推断题
12.A至I初中化学常见物质,A与B在高温条件下反应生成C和D,该反应在工业上可用于冶炼金属,A和C是组成元素相同的两种气体,D在有气体E和水的条件下会生成固体B。D与F的溶液反应生成G和固体H,F可用于配制波尔多液。
(1)固态C的俗名是___________,实验室区分气体A和C的液体试剂为_________。
(2)E、F的化学式分别是__________、___________。
(3)A和B在高温的条件下反应生成C和D的化学方程式为__________,D与F反应生成G和H的基本反应类型是_____________。
(4)向F的溶液中加入一定量的D,充分反应后,过滤,向滤渣中滴加I的稀溶液,有气泡产生,同时生成G,则滤渣的成分是____,I的化学式为____________。
13.已知A、B、C、D、E、F为初中化学常见的物质,其中A是一种能使带火星的木条复燃的气体,他们的关系如图所示,图中“→”表示一种物质可以转化为另一种物质,部分反应物,生成物已省略;“—”表示两种物质之间可以发生反应,且反应物已全部给出。部分反应条件已省略。请回答下列问题:
(1)物质A的化学式_______。
(2)请写出F→D反应的化学方程式________。
14.如图,甲、乙、丙为常见单质,A、B、C、D为常见氧化物。在通常状况下,C为液体,B和丙均为红色固体,D为黑色固体。转化关系如图所示,部分反应物、生成物、反应条件省略。
(1)写出化学式:C ___________,D _____________。
(2)转化“乙→丙”的化学反应基本类型是___________。
(3)转化“B→乙”是工业炼铁的原理,其化学方程式为____________。
四、实验题
15.钢铁是使用最多的金属材料。某化学小组利用下图装置模拟工业炼铁的实验。
(1)写出玻璃长管中发生反应的化学方程式_____。
(2)检验CO还原Fe2O3反应的气体生成物的实验现象是什么?_____。
(3)a处尾气被点燃,写出反应的化学方程式_____。
16.化学建立在实验基础之上,质量守恒定律可以用大量化学实验加以验证。同学们按如图进行验证。待天平平衡后,将小试管中的硫酸铜溶液倒入烧杯中,并将小试管再次放入烧杯。
一段时间后,可以观察到烧杯中现象是________,反应完成后天平指针的位置在________(选填左侧、右侧、中间)。
17.请根据如图所示实验回答下列问题:
(1)图甲是配制碳酸氢钠溶液可能会用到的部分仪器,其中不需要的仪器是__________(填序号),若图甲D中将碳酸氢钠固体放在托盘天平的右盘,砝码放在左盘,会导致所称取溶质的质量__________(选填“偏大”“偏小”或“不变”)。
(2)图乙所示是碳酸氢钠的溶解度曲线图在室温(20℃)下,__________(填“能”或“不能”)配制出质量分数为10%的碳酸氢钠溶液。请你通过计算说明__________。
(3)图丙实验中能证明铁钉生锈需要水的实验组合是__________(填字母编号)。实验①中植物油的作用是_______。为了防止铁制品生锈,可以采取的合理措施是写出一种措施是________。(写出一种措施即可)
五、计算题
18.为测定某黄铜(铜锌合金)样品中铜的含量,某化学兴趣小组分三次进行实验,实验数据如下表,请计算。
所取药品 第一次 第二次 第三次
黄铜样品质量(g) 12 10 10
稀盐酸质量(g) 100 100 150
生成气体质量(g) 0.2 0.2 0.2
(1)第___________次实验中,药品成分恰好完全反应;
(2)所用稀盐酸中溶质的质量分数(写计算过程,精确到0.1%)
19.小明用黄铜(铜、锌合金)测定某稀硫酸中溶质的质量分数,向盛有100g稀硫酸的烧杯中依次加入黄铜(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:
实验次数 第一次 第二次 第三次
黄铜质量/g 10 10 10
烧杯中物质总质量/g 109.9 119.8 129.8
(1)共生成氢气______g。
(2)所用稀硫酸中溶质的质量分数。
20.某化学实验小组的同学对实验室一颗生锈的铁钉产生了兴趣,经称量,生锈的铁钉重7.2克(假设其成分只有Fe和Fe2O3,不含其它杂质),把该铁钉放入一定浓度的稀硫酸中,充分反应,测得产生气体质量与稀硫酸质量关系如图所示。求:
(1)反应结束时产生气体的总质量为________。
(2)所用稀硫酸溶质的质量分数?______
(3)该铁钉中氧化铁的质量分数?______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.D
5.A
6.C
7.B
8.A
9. 氧气和水 补充铁钉在干燥的空气中不发生锈蚀的实验
10.(1)B
(2)导电
(3)Fe2O3+3CO3CO2+2Fe
(4)隔绝氧气和水
(5)节约金属资源/减少污染等
11.(1)
(2)、
(3)Ag、Cu、Zn
12. 干冰 澄清石灰水 O2 CuSO4 3CO+Fe2O32Fe+3CO2 置换反应 Fe和Cu H2SO4
13.(1)O2
(2)(合理即可)
14.(1) H2O Fe3O4
(2)置换反应
(3)
15. 烧杯中澄清的石灰水变浑浊
16. 铁钉表面有红色固体生成,蓝色液体变成浅绿色 中间
17.(1) A 偏小
(2) 不能
(3) ②③ 防止氧气溶于水,干扰实验 刷漆(或涂油等)
18.(1)二;
(2)解:设所用稀盐酸中溶质的质量分数为x
x=7.3%
答:所用稀盐酸中溶质的质量分数为7.3%。
19.(1)0.2
(2)解:由图可知,第三次加入10g黄铜后生成氢气的质量=10g+119.8g 129.8g=0,即第三次加入黄铜后没有生成氢气,即第二次实验时硫酸已完全反应
设参加反应的硫酸的质量为x
=
x=9.8g
所用稀硫酸中溶质的质量分数= ×100%=9.8%
答:所用稀硫酸中溶质的质量分数为9.8%。
20.(1)0.2g
(2)设生成0.2g的氢气,消耗铁的质量为x,稀硫酸的质量为y。
,
解得x=5.6g,y=9.8g
根据图像分析可知,稀硫酸和单质铁反应时消耗的质量为130g-30g=100g,故所用稀硫酸溶质的质量分数为:
答:所用稀硫酸溶质的质量分数为9.8%。
(3)由质量守恒定律可知,铁钉中Fe2O3的质量为:7.2g-5.6g=1.6g,该铁钉中氧化铁的质量分数为:
答:该铁钉中氧化铁的质量分数为22.2%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关实验现象的描述正确的是
A.铜片投入稀盐酸中产生大量无色气泡
B.铁丝在空气中燃烧,火星四射,生成红棕色固休
C.高温下木炭还原氧化铜,黑色固体变红
D.镁条在空气中燃烧,发出耀眼的白光,冒黑烟
2.下列关于合金的叙述中,正确的是
A.金属形成合金之后失去金属光泽
B.只有金属和金属之间才能形成合金
C.铁合金比纯铁的应用范围更广
D.合金不能传热、导电
3.金属材料在生产、生活中使用很广泛。下列用途是利用了金属的导电性的是
A.铁制铁锅 B.金制项链 C.铜制导线 D.铝制易拉罐
4.下列实验能达到实验目的的是
A.氧气验满 B.探究甲烷的组成
C.验证质量守恒定律 D.比较合金与纯金属硬度
5.下列不能与氯化亚铁溶液反应的金属是
A.Cu B.Zn C.Al D.Mg
6.如图所示是某化学小组设计的铁制品锈蚀的实验装置。下列相关叙述中正确的是
①铁锈的主要成分是Fe2O3②一段时间后,塑料瓶可能会变瘪 ③一段时间后,水面处铁丝锈蚀最严重 ④一段时间后,铁丝会由下向上出现锈蚀现象
A.②③④ B.①②④ C.①②③ D.①③④
7.已知金属 M Fe 和 H 活动性强弱关系 Fe > M > H,下列说法正确的是
A.金属 M 放入 Zn(NO3 )2 溶液中,有锌析出
B.金属 M 放入 CuSO4 溶液中,金属表面有红色固体析出
C.金属铁(足量)放入 M(NO3 )2 中,生成 Fe(NO3 )3
D.金属铁放入 AgNO3 溶液中,一段时间后,溶液质量变大
8.已调平的托盘天平(高灵敏度)两边各放一个等质量的烧杯,向烧杯中倒入质量相等、质量分数也相等的足量的稀硫酸,然后在左边的烧杯中放入一定质量的铁粉,同时在右边的烧杯中放入等质量的锌粉,在反应过程中天平指针的偏转情况为
A.先左后右 B.先右后左 C.向右偏转 D.向左偏转
二、简答题
9.(1)飞机上的镀铬铁制品能防锈蚀,其防锈蚀原理是阻止铁与________接触。
(2)设计对比实验是化学研究常用的方法,下图是某化学小组设计的探究铁钉锈蚀条件的实验。要达到实验目的还需补充什么实验 __________
10.近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。请回答下列问题。
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料是______(填序号)。
A.玻璃车窗 B.镁铝合金车体 C.塑料小桌板
(2)高铁电路多用铜质导线,这是利用了铜的延展性和______性。
(3)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧化碳在高温条件下反应,其化学方程式为______。
(4)车身表面烤漆不仅美观,还能起到防锈的作用,其防锈的原理是______。
(5)目前世界上已有50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是______(写出一条即可)。
11.向盛有一定质量和的混合溶液中的烧杯中逐渐加入粉,边加边搅拌,溶液质量与加入粉的质量关系如图所示。
(1)写出(不包括b点)段反应的化学方程式__________。
(2)b点的溶液中含有的金属离子有哪些(写离子符号)__________?
(3)d点的固体中含有哪几种物质__________?
三、推断题
12.A至I初中化学常见物质,A与B在高温条件下反应生成C和D,该反应在工业上可用于冶炼金属,A和C是组成元素相同的两种气体,D在有气体E和水的条件下会生成固体B。D与F的溶液反应生成G和固体H,F可用于配制波尔多液。
(1)固态C的俗名是___________,实验室区分气体A和C的液体试剂为_________。
(2)E、F的化学式分别是__________、___________。
(3)A和B在高温的条件下反应生成C和D的化学方程式为__________,D与F反应生成G和H的基本反应类型是_____________。
(4)向F的溶液中加入一定量的D,充分反应后,过滤,向滤渣中滴加I的稀溶液,有气泡产生,同时生成G,则滤渣的成分是____,I的化学式为____________。
13.已知A、B、C、D、E、F为初中化学常见的物质,其中A是一种能使带火星的木条复燃的气体,他们的关系如图所示,图中“→”表示一种物质可以转化为另一种物质,部分反应物,生成物已省略;“—”表示两种物质之间可以发生反应,且反应物已全部给出。部分反应条件已省略。请回答下列问题:
(1)物质A的化学式_______。
(2)请写出F→D反应的化学方程式________。
14.如图,甲、乙、丙为常见单质,A、B、C、D为常见氧化物。在通常状况下,C为液体,B和丙均为红色固体,D为黑色固体。转化关系如图所示,部分反应物、生成物、反应条件省略。
(1)写出化学式:C ___________,D _____________。
(2)转化“乙→丙”的化学反应基本类型是___________。
(3)转化“B→乙”是工业炼铁的原理,其化学方程式为____________。
四、实验题
15.钢铁是使用最多的金属材料。某化学小组利用下图装置模拟工业炼铁的实验。
(1)写出玻璃长管中发生反应的化学方程式_____。
(2)检验CO还原Fe2O3反应的气体生成物的实验现象是什么?_____。
(3)a处尾气被点燃,写出反应的化学方程式_____。
16.化学建立在实验基础之上,质量守恒定律可以用大量化学实验加以验证。同学们按如图进行验证。待天平平衡后,将小试管中的硫酸铜溶液倒入烧杯中,并将小试管再次放入烧杯。
一段时间后,可以观察到烧杯中现象是________,反应完成后天平指针的位置在________(选填左侧、右侧、中间)。
17.请根据如图所示实验回答下列问题:
(1)图甲是配制碳酸氢钠溶液可能会用到的部分仪器,其中不需要的仪器是__________(填序号),若图甲D中将碳酸氢钠固体放在托盘天平的右盘,砝码放在左盘,会导致所称取溶质的质量__________(选填“偏大”“偏小”或“不变”)。
(2)图乙所示是碳酸氢钠的溶解度曲线图在室温(20℃)下,__________(填“能”或“不能”)配制出质量分数为10%的碳酸氢钠溶液。请你通过计算说明__________。
(3)图丙实验中能证明铁钉生锈需要水的实验组合是__________(填字母编号)。实验①中植物油的作用是_______。为了防止铁制品生锈,可以采取的合理措施是写出一种措施是________。(写出一种措施即可)
五、计算题
18.为测定某黄铜(铜锌合金)样品中铜的含量,某化学兴趣小组分三次进行实验,实验数据如下表,请计算。
所取药品 第一次 第二次 第三次
黄铜样品质量(g) 12 10 10
稀盐酸质量(g) 100 100 150
生成气体质量(g) 0.2 0.2 0.2
(1)第___________次实验中,药品成分恰好完全反应;
(2)所用稀盐酸中溶质的质量分数(写计算过程,精确到0.1%)
19.小明用黄铜(铜、锌合金)测定某稀硫酸中溶质的质量分数,向盛有100g稀硫酸的烧杯中依次加入黄铜(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:
实验次数 第一次 第二次 第三次
黄铜质量/g 10 10 10
烧杯中物质总质量/g 109.9 119.8 129.8
(1)共生成氢气______g。
(2)所用稀硫酸中溶质的质量分数。
20.某化学实验小组的同学对实验室一颗生锈的铁钉产生了兴趣,经称量,生锈的铁钉重7.2克(假设其成分只有Fe和Fe2O3,不含其它杂质),把该铁钉放入一定浓度的稀硫酸中,充分反应,测得产生气体质量与稀硫酸质量关系如图所示。求:
(1)反应结束时产生气体的总质量为________。
(2)所用稀硫酸溶质的质量分数?______
(3)该铁钉中氧化铁的质量分数?______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.D
5.A
6.C
7.B
8.A
9. 氧气和水 补充铁钉在干燥的空气中不发生锈蚀的实验
10.(1)B
(2)导电
(3)Fe2O3+3CO3CO2+2Fe
(4)隔绝氧气和水
(5)节约金属资源/减少污染等
11.(1)
(2)、
(3)Ag、Cu、Zn
12. 干冰 澄清石灰水 O2 CuSO4 3CO+Fe2O32Fe+3CO2 置换反应 Fe和Cu H2SO4
13.(1)O2
(2)(合理即可)
14.(1) H2O Fe3O4
(2)置换反应
(3)
15. 烧杯中澄清的石灰水变浑浊
16. 铁钉表面有红色固体生成,蓝色液体变成浅绿色 中间
17.(1) A 偏小
(2) 不能
(3) ②③ 防止氧气溶于水,干扰实验 刷漆(或涂油等)
18.(1)二;
(2)解:设所用稀盐酸中溶质的质量分数为x
x=7.3%
答:所用稀盐酸中溶质的质量分数为7.3%。
19.(1)0.2
(2)解:由图可知,第三次加入10g黄铜后生成氢气的质量=10g+119.8g 129.8g=0,即第三次加入黄铜后没有生成氢气,即第二次实验时硫酸已完全反应
设参加反应的硫酸的质量为x
=
x=9.8g
所用稀硫酸中溶质的质量分数= ×100%=9.8%
答:所用稀硫酸中溶质的质量分数为9.8%。
20.(1)0.2g
(2)设生成0.2g的氢气,消耗铁的质量为x,稀硫酸的质量为y。
,
解得x=5.6g,y=9.8g
根据图像分析可知,稀硫酸和单质铁反应时消耗的质量为130g-30g=100g,故所用稀硫酸溶质的质量分数为:
答:所用稀硫酸溶质的质量分数为9.8%。
(3)由质量守恒定律可知,铁钉中Fe2O3的质量为:7.2g-5.6g=1.6g,该铁钉中氧化铁的质量分数为:
答:该铁钉中氧化铁的质量分数为22.2%。
答案第1页,共2页
答案第1页,共2页
