化学人教版(2019)选择性必修1 4.3金属的腐蚀与防护(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.3金属的腐蚀与防护(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-11 16:43:38 | ||
图片预览







文档简介
(共22张PPT)
POWERPOINT
金属的腐蚀与防护
第四章第三节
学习目标
1、了解化学腐蚀和电化学腐蚀的含义,认识钢铁吸氧腐蚀和析氢腐蚀发生的条件及原理
2.掌握常见的金属防护的方法,并能解释其原理
气体或液体
氧化还原
气体或液体物质
本质:M-ne-=Mn+ 发生氧化反应
化学腐蚀
电化学腐蚀
与氧化剂直接接触反应
吸氧腐蚀(水膜呈中性或酸性较弱)
析氢腐蚀(水膜呈酸性)
原电池反应
1.析氢腐蚀
(酸性环境)
负极: Fe - 2e- = Fe2+
正极: 2H++ 2e- =H2 ↑
电池总反应: Fe + 2H+ =Fe2+ + H2 ↑
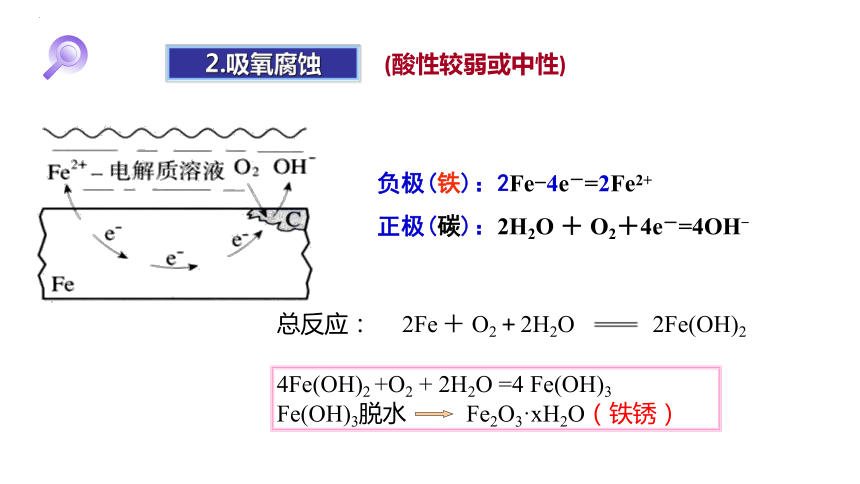
2.吸氧腐蚀
(酸性较弱或中性)
负极(铁):2Fe-4e-=2Fe2+
正极(碳):2H2O + O2+4e-=4OH-
总反应: 2Fe + O2+2H2O 2Fe(OH)2
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
Fe(OH)3脱水 Fe2O3·xH2O(铁锈)
1、实际上,金属腐蚀过程中电化学腐蚀和化学腐蚀往往同时发生,但绝大多数属于电化学腐蚀。电化学腐蚀比化学腐蚀的速率也大得多。
2、析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,金属腐蚀主要是吸氧腐蚀
3、钢铁发生析氢腐蚀或吸氧腐蚀时,都是铁做负极失电子生成Fe2+ 而不是Fe3+
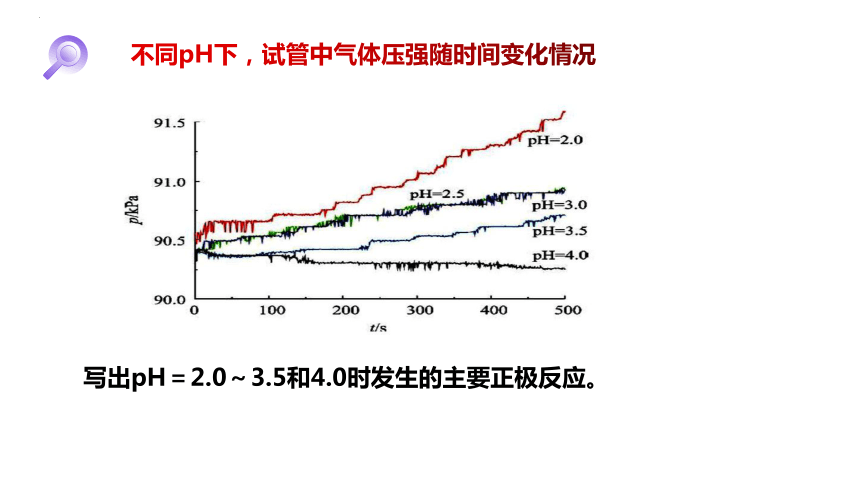
不同pH下,试管中气体压强随时间变化情况
写出pH=2.0~3.5和4.0时发生的主要正极反应。
无色气体产生
负极
加快
D
制成不锈钢
(改变金属材料组成)
喷漆
镀铬
在机械表面涂防锈油
船身如何防腐蚀的?
用牺牲锌块的方法来保护船身
船身上装锌块
海水
原电池
正
负
—— —— —— —— —— —— —— —— — —— —— —— —— ——
—— —— —— — ——
钢闸门
海水
锌
板
e-
正极(阴极)
e-
负极
(牺牲阳极)
实验 装置 按如图所示连接好装置,过一段时间,用胶头滴管从Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6]溶液
实验 现象 电流表
阴极 有 产生,电极反应: ;
试管中溶液 蓝色沉淀
阳极 锌棒 ,电极反应: 。
指针发生偏转
气泡
2H++ 2e- = H2↑
未生成
溶解变细
Zn -2e- = Zn2+
铁钉的裸露部分周围溶液没有特征蓝色物质生成。铁钉周围变红,说明氧气在铁的表面得电子,生成了氢氧根离子,铁做正极,证明了原电池保护。
思考:如何证明铁被保护?
什么现象证明是原电池保护?
实验现象1
实验现象2
思考:生成蓝色物质说明了什么?
铁钉的裸露部分周围有亚铁离子生成,氧气在铜丝的表面得到电子,生成氢氧根离子,铜丝附近变红。铁没有得到保护。
实验4-4(2)
e-
e-
—— —— —— —— —— —— —— —— — —— —— —— —— ——
—— —— —— — ——
海水
阳极
阴极
(2)外加电流法
钢闸门
惰性
电极
利用电解原理把被保护的金属作为电解池的阴极,惰性电极作为辅助阳极。通电后,电子被强制流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零,从而被保护。
常用于防止土壤、海水及河水中的金属设备的腐蚀。
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(5)>(2)>(1)>(3)>(4)
小结:金属被保护的比较规律
电解池的阴极保护
原电池的正极
一般保护
>
>
×
×
×
×
POWERPOINT
谢谢您的观看
THANKS FOR WATCHING
POWERPOINT
金属的腐蚀与防护
第四章第三节
学习目标
1、了解化学腐蚀和电化学腐蚀的含义,认识钢铁吸氧腐蚀和析氢腐蚀发生的条件及原理
2.掌握常见的金属防护的方法,并能解释其原理
气体或液体
氧化还原
气体或液体物质
本质:M-ne-=Mn+ 发生氧化反应
化学腐蚀
电化学腐蚀
与氧化剂直接接触反应
吸氧腐蚀(水膜呈中性或酸性较弱)
析氢腐蚀(水膜呈酸性)
原电池反应
1.析氢腐蚀
(酸性环境)
负极: Fe - 2e- = Fe2+
正极: 2H++ 2e- =H2 ↑
电池总反应: Fe + 2H+ =Fe2+ + H2 ↑
2.吸氧腐蚀
(酸性较弱或中性)
负极(铁):2Fe-4e-=2Fe2+
正极(碳):2H2O + O2+4e-=4OH-
总反应: 2Fe + O2+2H2O 2Fe(OH)2
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
Fe(OH)3脱水 Fe2O3·xH2O(铁锈)
1、实际上,金属腐蚀过程中电化学腐蚀和化学腐蚀往往同时发生,但绝大多数属于电化学腐蚀。电化学腐蚀比化学腐蚀的速率也大得多。
2、析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,金属腐蚀主要是吸氧腐蚀
3、钢铁发生析氢腐蚀或吸氧腐蚀时,都是铁做负极失电子生成Fe2+ 而不是Fe3+
不同pH下,试管中气体压强随时间变化情况
写出pH=2.0~3.5和4.0时发生的主要正极反应。
无色气体产生
负极
加快
D
制成不锈钢
(改变金属材料组成)
喷漆
镀铬
在机械表面涂防锈油
船身如何防腐蚀的?
用牺牲锌块的方法来保护船身
船身上装锌块
海水
原电池
正
负
—— —— —— —— —— —— —— —— — —— —— —— —— ——
—— —— —— — ——
钢闸门
海水
锌
板
e-
正极(阴极)
e-
负极
(牺牲阳极)
实验 装置 按如图所示连接好装置,过一段时间,用胶头滴管从Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6]溶液
实验 现象 电流表
阴极 有 产生,电极反应: ;
试管中溶液 蓝色沉淀
阳极 锌棒 ,电极反应: 。
指针发生偏转
气泡
2H++ 2e- = H2↑
未生成
溶解变细
Zn -2e- = Zn2+
铁钉的裸露部分周围溶液没有特征蓝色物质生成。铁钉周围变红,说明氧气在铁的表面得电子,生成了氢氧根离子,铁做正极,证明了原电池保护。
思考:如何证明铁被保护?
什么现象证明是原电池保护?
实验现象1
实验现象2
思考:生成蓝色物质说明了什么?
铁钉的裸露部分周围有亚铁离子生成,氧气在铜丝的表面得到电子,生成氢氧根离子,铜丝附近变红。铁没有得到保护。
实验4-4(2)
e-
e-
—— —— —— —— —— —— —— —— — —— —— —— —— ——
—— —— —— — ——
海水
阳极
阴极
(2)外加电流法
钢闸门
惰性
电极
利用电解原理把被保护的金属作为电解池的阴极,惰性电极作为辅助阳极。通电后,电子被强制流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零,从而被保护。
常用于防止土壤、海水及河水中的金属设备的腐蚀。
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(5)>(2)>(1)>(3)>(4)
小结:金属被保护的比较规律
电解池的阴极保护
原电池的正极
一般保护
>
>
×
×
×
×
POWERPOINT
谢谢您的观看
THANKS FOR WATCHING
